Adenoamele renale sunt neoplasme epiteliale rare, benigne, compuse din proliferări de celule epiteliale corticale renale, cel mai adesea raportate la câini, pisici și cai.
Termeni asociați:
- Adenom
- Nefropatie
- Neoplasm
- Tumoră renală
- Carcinom cu celule renale limpede
- Leziune
- Ocratoxină
- Cancerogenitate
- Carcinom renal
Descărcați în format PDF
Despre această pagină
Cancer de celule renale ☆
Adenom renal
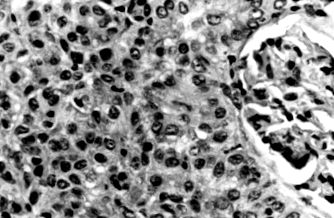
Figura 1. Adenom cortical renal. Această tumoare a fost identificată ca o leziune incidentală într-un specimen de nefrectomie obținut de la un pacient cu un carcinom cu celule renale care implică o altă regiune a rinichiului. Celulele tumorale sunt mici, cu citoplasmă slabă și nuclei mici; nucleolii nu sunt aparenți. Un glomerul normal (dreapta) este adiacent tumorii.
Sistemul urinar1
Adenoame renale.
Adenoamele renale sunt neoplasme epiteliale rare, benigne, compuse din proliferări de celule epiteliale corticale renale, raportate cel mai adesea la câini, pisici și cai. Sunt descoperiri accidentale la autopsie (sin: necropsie) și sunt de obicei mici (1 până la 3 cm), mase alb-gălbui, solitare, bine circumscrise, neincapsulate în cortex. Microscopic, adenoamele sunt compuse din foi solide, tubuli sau proliferări papilare de celule epiteliale cuboidale de dimensiuni uniforme și au citoplasmă granulară eozinofilă și nuclee mici, rotunde până la ovale. Cifrele mitotice, necroza și fibroza sunt rare. Aceste tumori accidentale sunt clinic asimptomatice.
Diagnosticul imagisticii rinichilor și Nefrologia intervențională
Tumori renale benigne
Adenomul renal este cea mai frecventă tumoare renală benignă. Apare din celule tubulare renale mature și are aproape întotdeauna o dimensiune mai mică de 2 până la 3 cm. Nu există trăsături radiologice caracteristice care să o distingă de alte tumori solide. De obicei, aceste leziuni vor fi localizate corticomedular, vor apărea solide în SUA și vor demonstra îmbunătățirea uniformă a CT. Hamartoamele rinichiului, angiomiolipomele (LMA), sunt un grup de tumori benigne care se disting radiologic. Deoarece LMA este compusă din diferite țesuturi, inclusiv grăsime, mușchi, elemente vasculare și chiar cartilaj, grăsimea în special poate fi detectată radiologic. SUA vor demonstra că masa este solidă cu ecouri crescute datorită prezenței grăsimii în leziune. CT este diagnostic în care se va observa grăsimea, cu un număr CT de obicei de 20 sau mai puțin. Mai puțin frecvent, este prezentă doar o cantitate minimă de grăsime și trebuie căutată cu atenție la scanările CT necontrastate cu secțiune subțire.
Carcinom cu celule renale
Adenoame și carcinoame renale papilare
Majoritatea adenoamelor și carcinoamelor renale papilare sunt caracterizate genetic printr-o combinație unică de trisomii autozomale cu trisomia 17 ca semn distinctiv cel mai important. Adenoamele papilare prezintă în mod specific un model cromozomial −Y, +7, +17. Adenoamele papilare sunt frecvente și se caracterizează morfologic printr-o arhitectură tubulo-papilară de grad nuclear scăzut și cu diametrul de 5 mm sau mai mic.
Un mic subset de pRCC cu caracteristici asemănătoare cRCC, cum ar fi citoplasma clară, se caracterizează prin translocații cu autozomi X care implică Xp11.2. Un tip de roman descris recent care aparține acestui subset ar putea fi RCC cu un t (6; 11) (p21; q12) care implică gena TFEB pe 6p21. Ambele subseturi sunt caracterizate prin fuziuni genetice cu familia de bază de elice - buclă - elice de factori de transcripție. Toate aceste tumori au tendința să apară preferențial la copii și adulți tineri; acesta din urmă ar putea fi legat de terapie.
Carcinogenitatea compușilor metalici
1.6.2 Modele de animale și teste pe termen scurt
Considerente Generale
1.6.2 Modele de animale și studii in vitro
Mai multe studii au raportat tendința plumbului de a induce leziuni cromozomiale prin creșterea frecvenței micronuclei și creșterea ratei SCE. Thiera și colab. (2003) au tratat celule V79 de hamster chinezesc cu 0,01-10 μM acetat de plumb sau clorură de plumb timp de 18 ore. Grupul a constatat că aceste specii de plumb cresc frecvența micronuclei într-o manieră dependentă de doză (Thiera și colab., 2003). Un studiu realizat de Bonacker și colab. (2005) au descoperit, de asemenea, că acetat de plumb și clorură de plumb cresc frecvența micronuclei într-o manieră dependentă de doză în celulele V79. O linie celulară de melanom uman a fost tratată cu 0,01-10 μM acetat de plumb timp de 24 h (test SCE) sau 44 h (test micronuclei). Celulele au prezentat o creștere dependentă de doză a ratei SCE și a frecvenței micronuclei (Poma și colab., 2003). Un alt studiu a examinat celulele fibroblastelor pulmonare umane tratate cu 0,1-5 μg/cm2 cromat de plumb timp de 24 de ore și a stabilit plumbul ca agent de deteriorare a cromozomilor. Studiul a constatat că numărul de cromozomi deteriorați la metafază a crescut într-o manieră dependentă de doză (Wise și colab., 2004).
Cititorul este trimis din nou la capitolele despre mecanismele selectate de toxicitate a metalelor și carcinogeneză (capitolul 9) și capitolul despre plumb (capitolul 43) din acest manual pentru informații suplimentare.
Imunohistologia prostatei, a vezicii urinare, a rinichilor și a testiculului
ADENOM METANEFRIC
Adenomul metanefric al rinichiului este o formă unică de adenom renal caracterizat printr-o proliferare a structurilor tubulare și micropapilare spre glomeruloide căptușite de celule epiteliale cuboidale blande. Raportul relativ ridicat nuclear-citoplasmatic al celulelor adenom metanefrice și colorarea lor citoplasmatică ușor amfofilă conferă un aspect tipic „albastru” de mică putere nodulului neoplazic. Acesta din urmă este în contrast cu aspectul eozinofilic mai ușor al principalei sale entități de diagnostic diferențial, și anume varianta solidă a CCR papilar. 392-395 La fel ca RCC papilar, adenomul metanefric poate prezenta histiocite spumoase în nucleele papilare și calcificări psammomatoase ocazionale. Caracteristicile imunohistochimice utile ale tumorii sunt pozitivitatea acesteia pentru WT1 și colorarea negativă pentru EMA și CK7, un profil care contrastează cu cel al RCC papilar solid (WT1−, EMA + și CK7 +) (Fig. 16.37). 392-395
RMN-ul rinichilor și al glandelor suprarenale
Leziuni solide
Leziunile renale solide sunt, în esență, maligne. Rarele excepții sunt adenomul renal și oncocitomul, care nu pot fi diferențiate de leziunile renale solide maligne. Pseudoleziile - leziuni neoplazice care simulează neoplasme - confundă evaluarea solidității. Aceste leziuni includ infarctul renal, pielonefrita, tromboza venelor renale (RVT) și trauma renală. Deoarece aceste leziuni reflectă tulburări ale parenchimului renal subiacent, morfologia este păstrată în detrimentul semnalului și al îmbunătățirii. Aceste leziuni tind să se manifeste cu rezultate geografice sau difuze (semnal și/sau îmbunătățire), mai degrabă decât cu caracteristici focale, de masă - sau cu schema de leziuni renale „bob” versus „bilă” (Fig. 4-30).
Masele neoplazice se extind mai mult sau mai puțin centrifugal, conformându-se aproximativ cu sferele sau „bilele”. În acest proces, forma „fasole” a rinichiului este deformată. Între timp, alte leziuni păstrează forma de fasole a rinichiului fie prin creșterea neoplazică infiltrativă, fie prin afectarea neoplazică a unui segment sau a întregului rinichi (de exemplu, infecție, infarct). Această schemă de diagnostic utilă servește la încadrarea diagnosticelor diferențiale, nu separă benignul de malign, deoarece leziunile benigne și maligne se încadrează în ambele categorii.
Toxicologie renală
KG. Dickman, A.P. Grollman, în Comprehensive Toxicology, 2010
7.18.3.3.6 Cancerogenitate
Există dovezi foarte limitate care sugerează că citrinul acționează ca cancerigen. Un studiu a demonstrat că șobolanii dezvoltă adenoame renale atunci când sunt hrăniți cu o dietă suplimentată cu 0,1% citrinină (Arai și Hibino 1983). Dovada genotoxicității lipsește și au existat rapoarte mixte de mutagenitate atunci când au fost testate pe sisteme bacteriene (Martin și colab. 1986; Thust și Kneist 1979). În celulele cultivate, citrinina poate fi clastogenă, dar numai după bioactivare cu microsomi hepatici și nu s-au găsit dovezi ale deteriorării oxidative a ADN-ului (Liu și colab. 2003; Thust și Kneist 1979). Aneuploidia a fost detectată în două linii celulare diferite tratate cu citrinină (Knasmuller și colab. 2004; Pfeiffer și colab. 1998).
- Hydrothorax - o prezentare generală Subiecte ScienceDirect
- Hidrodensitometrie - o prezentare generală Subiecte ScienceDirect
- Frecvența meselor - o prezentare generală Subiecte ScienceDirect
- Hiperestrogenismul - o prezentare generală Subiecte ScienceDirect
- Anemia hipocromă - o prezentare generală Subiecte ScienceDirect