Hiperestrogenismul cauzat de sarcină, alunițe hidatiforme, tumori sau tratamentul cu estrogeni este cea mai frecventă cauză a creșterii TBG, principalul purtător al hormonului tiroidian din ser.
Termeni asociați:
- Zearalenonă
- Toxicitate
- Furaje
- Dihorii
- Teste
- Estrus
- Anorexie
- Porcine
- Galben
Descărcați în format PDF
Despre această pagină
Toxicoza Zearalenonei
Prezentare clinică
Forme/subtipuri de boală
Hiperestrogenismul include semne clinice de est prelungit, anestru, infertilitate, revenire întârziată la est, creștere a dezvoltării mamare sau mamare și lactație anormală, organe genitale externe umflate și atrofie a ovarelor sau a testiculelor.
Istorie, Plângere șefă
Semne clinice estrogenice
Constatări ale examenului fizic
Organe genitale mărite sau umflate
Uter și vulva edematoasă și vulva prolapsată
Mărirea anormală a glandei mamare
Atrofia testiculară și ovariană
Etiologie și Fiziopatologie
Zearalenona și metaboliții se leagă de receptorii citosolici pentru 17β-estradiol și stimulează sinteza specifică a ARN-ului și semnele de estrogenism. Creșterea feedback-ului estrogenic asupra glandei pituitare reduce concentrațiile de hormoni foliculostimulatori și maturarea și ovulația foliculului ovarian.
Zearalenona este absorbită din tractul gastro-intestinal și metabolizată de ficat în α- și β-zearalenol (care poate prezenta o activitate estrogenică mai mare decât zearalenona) și poate fi ulterior redusă la α- și β-zearalanol. Zearalenona și metaboliții sunt conjugați și excretați în urină și fecale. Ciclul enterohepatic poate prelungi timpul de înjumătățire al zearalenonei și prelungi efectele adverse.
Tulburări ale sistemelor urinare și reproductive
Christal G. Pollock DVM, Diplomat ABVP (Avian), în Dihori, Iepuri și rozătoare (Ediția a treia), 2012
Diagnostic și tratament
Hiperestrogenismul se observă de obicei la jill-urile de peste 1 an. Semnele clinice pot include anorexie, letargie, umflare vulvară, descărcare vulvară, paloare și suflare sistolică. Hiperestrogenismul extins poate provoca hemoragii melenice, petechiale sau echimotice și alopecie dorsală bilaterală simetrică. Pot fi observate, de asemenea, metrite concomitente, piometre sau vaginite. Pareza membrelor pelvine, ataxia și paralizia au fost raportate secundar hematomului subdural. 25
Rezultatele timpurii ale CBC pot prezenta trombocitoză și leucocitoză neutrofilă; cu toate acestea, până la momentul prezentării, CBC va dezvălui, în general, anemie neregenerativă (hematocrit mai mic de 20% până la 25%), globule roșii nucleate, neutropenie și trombocitopenie (număr de trombocite mai mic de 50.000/μL). 28,58,64 Hemoragia apare atunci când numărul de trombocite scade sub 20.000/μL. 64 Confirmați anemia non-regenerativă cu un număr de reticulocite. Când rezultatele CBC sau ale numărului de reticulocite sunt echivoce, aspirați măduva osoasă pentru evaluare citologică.
Dihorii mor de obicei de hemoragie secundară trombocitopeniei. Rezultatele necropsiei pot include mucoase palide și măduvă osoasă, hematomielie, hidrometru și hemoragii petechiale, echimotice sau subcutanate. 25.58 Neutropenia poate predispune sângele la infecții bacteriene, cum ar fi piometra, vaginita și bronhopneumonia. Din punct de vedere histologic, pot fi observate degenerescența hepatică centrilobulară, panmelelftiză și hiperplazie endometrială chistică. 25
Scopul principal al terapiei este reducerea nivelului de estrogen. Tratamentul definitiv necesită ovariohisterectomia sau îndepărtarea chirurgicală a unui rest ovarian. Resturile ovariene pot fi găsite lângă pediculul ovarian sau în grăsimea mezenterică. Deoarece aceste dihorii sunt deseori riscuri chirurgicale și anestezice slabe, îngrijirea agresivă de susținere este adesea necesară preoperator. Faceți transfuzii de sânge după cum este necesar. Dihorii nu posedă grupe de sânge și sunt posibile transfuzii multiple de la mai mulți donatori. 58 Oxigenul purtător de oxigen pe bază de hemoglobină (Biopure Corporation, Cambridge, MA; 11 până la 15 ml/kg IV pe o perioadă de 4 ore) poate fi utilizat în dihorii anemici. 51 Mai rar, au fost descrise și transfuzii de măduvă osoasă. Măsurile suplimentare de îngrijire de susținere pot include steroizi anabolizanți, corticosteroizi și dextran de fier. Eritropoietina a fost încercată, dar se pare că este ineficientă, posibil din cauza inhibării estrogenilor. 51,58
Manipularea medicală a hiperestrogenismului este cel mai probabil să aibă succes atunci când estrogenul a fost crescut de mai puțin de 4 săptămâni. Administrați GnRH (20 μg/dihor SC, IM) sau gonadotropină corionică umană (hCG) (20 până la 100 UI/dihor IM). 25,37,58 Se administrează hCG la cel puțin 10 zile de la debutul estului, apoi se repetă în 7 zile dacă umflarea vulvară nu sa rezolvat. 53.58 Utilizarea progestogenilor de a doua generație, cum ar fi proligestone (Covinan, Intervet Australia Schering-Plough Animal Health, Victoria, Australia) (50 mg SC), a fost propusă atunci când jill-ul a fost în est de 10 zile. Proligestone a fost, de asemenea, recomandat în Regatul Unit pentru a preveni estrusul chiar înainte de sezonul de reproducere. 37
Un jill poate fi, de asemenea, convertit în anestru prin reproducerea ei cu un mascul vasectomizat sau prin inducerea mecanică a ovulației cu o sondă vaginală, cum ar fi un aplicator cu vârf de bumbac. Rezultatele acestor proceduri sunt imprevizibile și adesea nereușite la dihorii moribondi.
Prognosticul toxicității estrogenilor sa bazat în mod clasic pe valoarea hematocritului (Hct). Hct mai mare de 25% este asociat cu un prognostic corect până la bun, Hct între 15% și 25% este asociat cu un prognostic păzit, iar Hct mai mic de 15% este asociat cu un prognostic slab până la grav.
Toxicitatea estrogenului cauzată de estul persistent este prevenită prin sterilizarea de rutină a tuturor dihorilor femele care nu sunt destinate reproducerii până la vârsta de 6 luni. La operație, identificați cu atenție toate țesuturile ovariene care pot fi localizate în depozite mari de grăsime. Împiedicați rămășițele reproducătoare să rămână în est timp de mai mult de 2 până la 4 săptămâni. 37
Volumul II
Modulatori selectivi ai receptorilor de estrogen și estrogen
Tamoxifenul blochează creșterea TBG indusă de estrogen, în timp ce tamoxifenul singur la femeile aflate în postmenopauză crește nivelurile serice de TBG, T4 și T3. 270 Tamoxifen, un modulator selectiv al receptorilor de estrogen (SERM) utilizat preponderent în prevenirea și tratamentul cancerului de sân, s-a dovedit a crește nivelurile de TBG, cu creșterea rezultată a nivelurilor totale de T4 și T3. Pe lângă faptul că provoacă creșteri semnificative ale TBG, s-a demonstrat că tamoxifenul suprimă semnificativ nivelurile de FT3 și FT4 după 6 luni de tratament, însoțit de o creștere semnificativă a TSH după 1 an de tratament.
Unele SERM mai noi includ raloxifenul și droloxifenul. Aceste medicamente provoacă, de asemenea, creșteri ale TBG, cu o creștere ușoară sau nulă a nivelului total de hormoni tiroidieni; modificările induse de aceste medicamente sunt mai mici decât cele observate la utilizarea estrogenului. Raloxifenul, care a fost dezvoltat pentru tratamentul osteoporozei, administrat la o doză orală de 60 mg/zi, a crescut ușor nivelurile de TBG, fără modificări semnificative ale TSH și ale nivelurilor liberi de hormoni tiroidieni la martori și la pacienții cu hipertiroidism subclinic. Droloxifenul administrat femeilor aflate în postmenopauză timp de 6 săptămâni a dus la o creștere a TBG care a fost semnificativă, dar mult mai mică decât cea indusă de 0,625 mg/zi de estrogen pentru aceeași perioadă de timp; această creștere a TBG nu a avut niciun efect semnificativ asupra nivelului de hormoni tiroidieni.
Consecințele creșterii concentrației TBG în ser includ niveluri serice mai ridicate atât de T4, cât și de T3 și, într-o măsură mai mică, de alți metaboliți ai deiodării T4. Rata de rotație fracțională a T4 este redusă în principal din cauza unei creșteri a bazei de T4 intravasculară. Pe de altă parte, concentrațiile FT4 și FT3 și cantitatea absolută de hormon care a fost degradată în fiecare zi rămân normale.
Tulburări care cauzează alopecie simetrică
Hiperestrogenism la câinele feminin
Definiție
Hiperestrogenismul este o boală endocrină neobișnuită la câinele de sex feminin și este rezultatul nivelurilor ridicate de estrogen sau ale raporturilor anormale de hormoni sexuali.
Este, de asemenea, cunoscut sub numele de dezechilibru ovarian tip I.
Se observă de obicei la câini femele de vârstă mijlocie, intacte.
Există o incidență mai mare la buldogii englezi și francezi.
Cauze și Fiziopatologie
Ovarele chistice sau o tumoră funcțională ovariană determină niveluri anormale de hormoni.
Dezechilibrele hormonale interferează cu ciclul normal al foliculilor de păr și duc la alopecie.
Semne clinice
Alopecie bilaterală simetrică în primul rând pe flancuri laterale, regiuni inghinale, perineale
Posibile alopecii ale gâtului, pieptului, picioarelor posterioare caudale și mediale
Comedoane, care afectează în special vulva
Ginecomastie, mameloane mărite și vulvă
Anomalii ale ciclului estru
Diagnostic
Ecografia abdominală sau chirurgia exploratorie identifică țesutul ovarian anormal.
Țesutul ovarian este supus examinării histopatologice.
Testele de estrogen pot prezenta niveluri ridicate de estrogen din sânge.
Examinarea hematologică și un aspirat osos sunt indicate pentru a evalua o măduvă osoasă hipoplazică (anemie neregenerativă, trombocitopenie, leucopenie) secundară toxicității estrogenice.
Examenul histopatologic al pielii poate releva următoarele: A.
Rezultatele sunt similare cu alte endocrinopatii, în special hipotiroidismul și bolile de piele asociate tumorii la câinii masculi.
Foliculii de păr sunt în stop de ciclu de creștere.
Firele telogene fără păr sunt prezente în număr mare.
Regresul părului apare ca răspuns la ovariohisterectomia.
Dacă se suspectează o neoplasmă ovariană, atunci se fac radiografii toracice pentru a evalua metastaza.
Diagnostic diferentiat
Tratament și monitorizare
Ovariohisterectomia rezolvă semnele dermatologice.
Deoarece micrometastazele pot fi prezente înainte de operație, monitorizați animalul pentru recidiva simptomelor dermatologice și eventuală metastazare a oricărei tumori.
Neurologie și neuroanatomie aviară clinică
Sindrom hiperlipidemic sau emboli lipidici
Acest sindrom este legat de hiperestrogenism la femeile active din punct de vedere reproductiv (vezi capitolul 12). Lipidele excesive circulă în fluxul sanguin, provocând nămoluri vasculare și emboli lipidici. Termenul laic este „accident vascular cerebral de gălbenuș”, deși nu este cu adevărat un embolus de gălbenuș. Acest sindrom poate fi adesea recunoscut în momentul recoltării sângelui; sângele este atât de saturat cu lipide încât aspectul a fost descris ca „milkshake de căpșuni” sau „supă cremă de roșii”, ceea ce este ușor de văzut. (Trebuie folosită precauție la colectarea sângelui, deoarece aceste păsări pot avea tulburări de coagulare simultane.) Colesterolul și trigliceridele sunt crescute în mod constant în această boală. Tratamentul constă în diluare sau diureză cu fluide, medicamente statinice care scad colesterolul (medicamente pentru om, cum ar fi gemfibrozil, simvastatină și colestipol pot fi compuse pentru utilizare aviară) și modificarea dietei (după cum este necesar). Se poate adăuga și niacină. Tratamentul poate fi plin de satisfacții, dar unele manifestări precum înclinarea capului pot persista. Tratamentul trebuie continuat pe viață. Terapia cu Lupron sau deslorelin poate ajuta la scăderea nivelului de hormoni în stadiul acut.
Sănătatea animalelor: Micotoxine
Zearalenonă
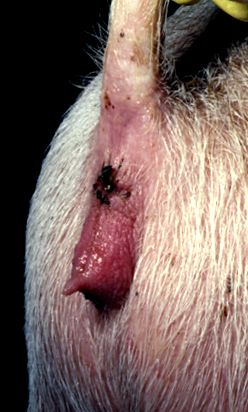
Zearalenona a fost detectată pentru prima dată după apariția simptomelor de hiperestrogenism la porumbul mucegăit hrănit cu porcine. Acestea includ estrus prelungit, anestru, modificări ale libidoului, infertilitate, incidența crescută a pseudo sarcinii, creșterea dezvoltării ugerului sau a glandei mamare și lactația anormală. Toxina este, de asemenea, legată de următoarele complicații secundare: nașteri mortale, avorturi, mastite, vulvovaginite și prolapsuri rectale sau vaginale (Figura 14).
Figura 14. Hiperestrogenism la o femeie porcină cu vulvovaginită și prolaps vaginal
(Amabilitatea doctorului David Ledoux, Universitatea din Missouri, SUA).
Perturbarea endocrină legată de zearalenonă este atribuită atât efectelor genomice, cât și celor non-genomice. În primul rând, zearalenona concurează eficient cu estrogeni endogeni steroizi, cum ar fi 17β-estradiol pentru siturile de legare specifice ale receptorilor de estrogen, fără preferință între cei doi izomeri, receptorul de estrogen-α și receptorul de estrogen-β. Receptorii de estrogen se găsesc în multe organe diferite, cum ar fi uterul, glandele mamare, oasele, ficatul și creierul, unde zearalenona poate avea, prin urmare, un impact. Afinitățile de legare relativă ale principalilor metaboliți sunt următoarele: α-zearalanol> α-zeralenol> β-zearalanol> zearalenonă> β-zearalenol. Izomerii a sunt aproximativ de 10 ori mai activi decât restul datorită poziției grupării hidroxil. Diferențele în producția de izomeri α sau β explică diferențele de sensibilitate între specii. De exemplu, porcii produc mai mult α-ZEL, în timp ce speciile de păsări de curte produc mai mult β-zearalenol.
Potența estrogenică a zearalenonei prezintă diferențe specifice speciilor, iar porcii, în special scrofițele, sunt considerate a fi cele mai susceptibile specii de animale, în timp ce păsările de curte și rumegătoarele prezintă o toleranță mai mare la furajele contaminate cu zearalenona. Studiile mecaniciste au arătat că zearalenona interacționează nu numai cu receptorii de estrogen, ci influențează și activitatea enzimelor implicate în steroidogeneza în ficat și în organele de reproducere. Experimentele in vivo și ex vivo arată că zearalenona și metaboliții săi afectează maturarea ovocitelor și dezvoltarea embrionară, dar nu provoacă efecte teratogene majore. Experimentele in vitro au indicat faptul că zearalenona nu este mutagenă, iar studiile pe termen lung la rozătoare au furnizat dovezi neconcludente pentru carcinogenitate.
Biomarkeri patologici în toxicologie
Meliton N. Novilla,. Stewart B. Jacobson, în Biomarkers in Toxicology, 2014
Alopecie endocrină
Alopecia endocrină poate apărea din hiperadrenocorticism iatrogen sau hiperestrogenism la câini, prin administrarea de glucocorticoizi sau respectiv estrogeni. Alte cauze raportate sunt hiperplazia bilaterală adrenocorticală secundară unei tumori hipofizare, nodulul hiperplazic adrenocortical funcțional sau neoplasma pentru hiperadrenocorticism și pentru hiperestrogenism, chisturile ovariene la femei și tumora funcțională a celulelor Sertoli a testiculului la bărbați (Hargis și Ginn, 2006). Câinii cu hiperadrenocorticism au alopecie truncală, scutind capul și membrele, abdomenul distins și pielea subțire.
În hipestrogenism, descoperirile brute includ alopecie simetrică și hiperpigmentare peste trunchiul și membrele posterioare (Figura 54.2). În plus, câinii masculi pot dezvolta prepuciul pendulant, mărirea mameloanelor și a prostatei, în timp ce femelele au vulva mărită și ciclu anormal de estru. Histologic, epiderma, dermul și foliculii de păr sunt atrofici cu hiperkeratoză foliculară și calcinoză cutisă în hiperadrenocorticism, în timp ce hiperkeratoza epidermică și foliculară și atrofia foliculară sunt observate în hiperestrogenism. Un istoric de expunere iatrogenă la glucocorticoizi sau estrogeni împreună cu constatări clinice și morfologice susține un diagnostic de alopecie endocrină.
Figura 54.2. Hiperestrogenism, dietilstilbestrol iatrogen, câine.
(Reprodus din baza patologică a bolilor veterinare, edn 4, Fig. 17-69, p. 1223. Academic Press/Elsevier).
- Hydrothorax - o prezentare generală Subiecte ScienceDirect
- Anemia hipocromă - o prezentare generală Subiecte ScienceDirect
- Leukoaraioza - o prezentare generală Subiecte ScienceDirect
- Hipofosfatemia - o prezentare generală a subiectelor ScienceDirect
- Hidrodensitometrie - o prezentare generală Subiecte ScienceDirect