Abstract
fundal
S-a raportat că profilurile de aminoacizi fără plasmă se corelează cu obezitatea și metabolismul glucozei și au fost studiate ca biomarkeri potențial utili ai bolilor legate de stilul de viață care afectează metabolismul la vârsta adultă. Cu toate acestea, cunoștințele acestor relații lipsesc la copii, în ciuda problemei tot mai mari de sănătate publică pe care o pune obezitatea infantilă.
Scopul acestui studiu a fost de a evalua dacă profilurile de aminoacizi fără plasmă pot servi ca biomarkeri utili ai bolilor legate de stilul de viață la copiii cu obezitate.
Metode
Acest studiu retrospectiv a utilizat evidența medicală a 26 de pacienți (15 bărbați, 11 femei) cu vârsta de 9 sau 10 ani care prezentau obezitate moderată până la severă și hiperlipidemie între aprilie 2015 și martie 2017. Un grad de obezitate de 30% sau mai mult a fost definit ca moderat sau severă. Nivelurile de aminoacizi au fost comparate între copiii obezi cu sau fără toleranță la glucoză afectată folosind un test t sau un test Mann-Whitney U. În plus, influența unor factori precum grosimea mediului intim, colesterolul lipoproteic cu densitate scăzută, colesterolul lipoproteic cu densitate ridicată, aminoacizii și evaluarea modelului homeostaziei - rezistența la insulină (HOMA-IR) au fost analizate în perechi utilizând corelația Pearson sau corelația rangului Spearman.
Rezultate
HOMA-IR a fost corelat pozitiv cu valină, leucină (Leu), izoleucină, fenilalanină, triptofan, metionină, treonină, lizină, alanină, tirozină, glutamat (Glu), prolină, arginină, ornitină, aminoacizi liberi total (toți P
fundal
Profilurile de aminoacizi (AA) au fost utilizate ca biomarker al obezității și DM. Am raportat anterior că concentrațiile plasmatice de valină (Val), leucină (Leu) și izoleucină (Ile), precum și aminoacizii cu lanț ramificat total (BCAA), alanină (Ala), citrulină (Cit) și prolină ( Pro), au fost semnificativ mai mari la șoarecii diabetici decât la șoarecii normali [5]. Wang și colab. [6] a raportat un studiu de urmărire de 12 ani care a arătat că nivelurile plasmatice de BCAA, tirozină (Tyr) și fenilalanină (Phe) ar putea fi predictori ai dezvoltării viitoare a diabetului la subiecții nediabetici. Alte studii au raportat asocieri semnificative între nivelurile plasmatice ale AA specifice și indicele de masă corporală (IMC) [7], AA și reglarea glucozei [8]. Într-un studiu asupra obezității japoneze, Takashina și colab. [9] au raportat asociații specifice între AA specifice, inclusiv Val, Leu, Ala și Cit, tipul/gradul de obezitate și indicii de reglare a glucozei/insulinei la adulții japonezi cu metabolism normal al glucozei.
În acest studiu, am analizat corelația aminoacizilor din sânge și a stărilor metabolice obeze pentru a evalua dacă profilurile de aminoacizi fără plasmă pot deveni biomarkeri utili ai bolilor legate de stilul de viață la copiii cu obezitate. Mai mult, am discutat despre rolul metabolic al aminoacizilor la copiii cu obezitate. Acest studiu a inclus o examinare clinică bazată pe laborator și măsurarea grosimii mediului intima (IMT) a arterei carotide interne ca marker al stării metabolice.
Metode
Design de studiu
Am studiat retrospectiv dosarele medicale a 26 de pacienți (bărbați: 15, femei: 11), cu vârsta de 9 sau 10 ani, care au prezentat la Departamentul de Pediatrie, Spitalul Universitar Kumamoto cu obezitate moderată până la severă (definită ca un grad de obezitate ≥30 %) la prima și a doua (după 6 luni) proiecții efectuate în orașul Kumamoto între aprilie 2014 și martie 2016. Gradul de obezitate a fost calculat conform formulei: [[greutatea corporală reală - greutatea corporală standard în funcție de vârstă] ÷ standardul greutate × 100), așa cum este definit de Societatea Japoneză pentru Endocrinologie Pediatrică [10].
Evaluarea clinică
Informațiile clinice, inclusiv vârsta, sexul, simptomele, starea actuală, istoricul medical, utilizarea medicamentelor și istoricul familial, au fost înregistrate pe un formular de date standardizat de către personalul medical examinator în timpul vizitelor pacienților. Gradul de obezitate, indicele de masă corporală (IMC), tensiunea arterială, acidul uric din sânge (UA), funcția ficatului [alanină aminotransferază (ALT), aspartat aminotransferază (AST), lactat dehidrogenază (LDH) și γ-glutamiltransferază (γ- GTP)], toleranța la glucoză [glucoza din sânge, insulina, peptida C și evaluarea modelului homeostaziei-rezistență la insulină (HOMA - IR)] și nivelurile de lipide din sânge [colesterol total (T-CHO), colesterol lipoproteic cu densitate mică LDL -CHO), colesterolul cu lipoproteine de înaltă densitate (HDL-CHO) și trigliceridele (TG)] au fost evaluate. Probele de sânge ale copiilor obezi au fost recoltate după post timp de 12 ore.
Testarea nivelurilor de aminoacizi și măsurarea grosimii mediului intim
Aminoacizii din plasmă au fost analizați folosind un spectrometru de masă cromatograf lichid (SRL, Inc., Tokyo, Japonia). IMT-urile arterelor carotide interne stângi și drepte au fost măsurate folosind un aparat cu ultrasunete Aplio XG (Toshiba Medical System Corporation, Tochigi, Japonia) și au fost verificate de două tehnicieni. IMT-urile au fost măsurate în trei puncte ale ambelor artere carotide interne și mediat (fișier suplimentar 1).
Analiza calității datelor
Doi cercetători, care nu au participat la diagnosticul medical, ultrasonografia, analiza sângelui sau evaluarea dosarului medical, au efectuat datele și analizele statistice în acest studiu.
analize statistice
Am comparat nivelurile de aminoacizi între copiii obezi cu sau fără toleranță la glucoză afectată folosind un test t sau un test Mann-Whitney U. Factorii IMT, LDL- și HDL-CHO (raportul LDL/HDL), aminoacizii, HOMA-IR și UA au fost analizați în perechi utilizând corelația Pearson sau corelația Spearman a rangului în IBM SPSS Statistics ver. 25. HOMA-IR și UA au fost variabile dependente pentru prezicerea valorilor aminoacizilor din sânge, cum ar fi Val, Leu și Ile, care sunt variabile independente. Raportul IMT și LDL/HDL nu au fost variabile dependente de valorile aminoacizilor din sânge. O valoare de probabilitate față-verso de P
Rezultate
Observații clinice
În acest studiu, am evaluat 15 copii obezi de sex masculin (vârstă: 122,2 ± 4,2 luni) și 11 femei (vârstă: 122,9 ± 4,1 luni). Înălțimile, greutățile și IMC-urile lor au fost de 140,4 ± 6,4 și 140,0 ± 4,2 cm, 46,6 ± 7,6 și 45,8 ± 6,9 kg și respectiv 23,5 ± 2,5 și 23,3 ± 2,4 (fișier suplimentar 1).
19 procente (5/26) dintre copiii obezi din acest studiu au dezvoltat obezitate simplă, fără anomalii în datele sanguine, 58% (15/26) au dezvoltat hipercolesterolemie (LDL-CHO ≥ 140 mg/dL), 19% (5/26) a dezvoltat hipertrigliceridemie (TG ≥ 120 mg/dL), 8% (2/26) a dezvoltat hipoHDLemie (HDL-CHO 30 UI/L). Niciunul dintre copii nu a prezentat leziuni arteriosclerotice semnificative în niciuna dintre arterele carotide interne. IMT-urile medii au fost de 0,54 ± 0,06 mm (stânga: 0,55 ± 0,07 mm; dreapta: 0,54 ± 0,07 mm).
Corelații care implică niveluri de lipide
Nivelurile de T-CHO și LDL-CHO au fost corelate negativ cu nivelurile de IMC, HOMA-IR, insulină din sânge și nivelurile γ-GTP (Tabelul 1). Nivelurile HDL au fost corelate negativ cu IMT (N = 26; P = 0,039), iar raporturile LDL/HDL au fost corelate pozitiv cu IMTN = 26; P = 0,023) (Tabelul 1). De asemenea, am observat o corelație negativă între raportul LDL/HDL și nivelurile de Tyr din sânge. Fișierul suplimentar 1 detaliază comparațiile datelor metabolice de laborator între copiii obezi cu raport LDL/HDL ≤ 2,0 și raport LDL/HDL> 2,0. Nu au existat asociații semnificative între raportul LDL/HDL și raportul HOMA-IR sau LDL/HDL și aminoacizi (tabelele 1 și 2, fișierul suplimentar 1). Cu toate acestea, raportul LDL/HDL a fost corelat pozitiv cu IMT (fișier suplimentar 1).
Corelații care implică rezistența la insulină
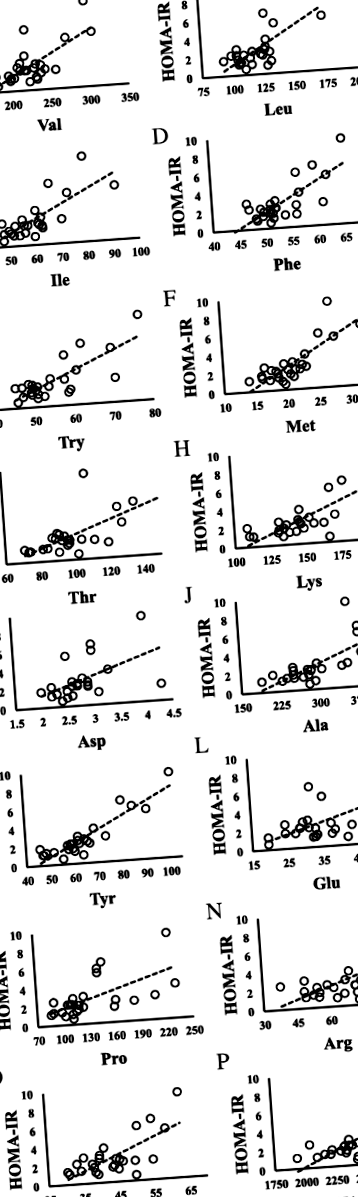
Figura 1 prezintă diagrame de dispersie care demonstrează corelații între nivelurile HOMA-IR și aminoacizi. HOMA-IR a fost corelat pozitiv cu Val, Leu, Ile, Phe, triptofan (Trp), metionină (Met), treonină (Thr), lizină (Lys), Ala, Tyr, glutamat (Glu), Pro, arginină (Arg), ornitină (Orn) și aminoacizi liberi totali (TFAA) (toate P FIG. 1
Relația dintre HOMA-IR și aminoacizi la copiii cu toleranță redusă la glucoză (HOMA-IR ≥2,5). A HOMA-IR vs Valine; N = 9, y = 0,0434x - 5,9926, R 2 = 0,5007, P = 0,033. b HOMA-IR vs Leucina; N = 9, y = 0,0776x - 5,6865, R 2 = 0,5482, P = 0,023. c HOMA-IR vs Fenilalanină; N = 9, y = 0,2707x - 10,711, R 2 = 0,4843, P = 0,037. d HOMA-IR vs Triptofan; N = 9, y = 0,1725x - 6,0928, R 2 = 0.4479, P = 0,049. e HOMA-IR vs Metionină; N = 9, y = 0.3807x - 4.4448, R 2 = 0,5995, P = 0,014. f HOMA-IR vs Lizină; N = 9, y = 0,0787x - 8,4333, R 2 = 0,6733, P = 0,007. g HOMA-IR vs Tirozină; N = 9, y = 0.151x - 6.9265, R 2 = 0,843, P = 0,000. h HOMA-IR vs Arginină; N = 9, y = 0,0899x - 1,7275, R 2 = 0,4625, P = 0,044. eu HOMA-IR vs Ornitină; N = 9, y = 0,2148x - 5,5718, R 2 = 0,8164, P = 0,001. j HOMA-IR vs Total aminoacizi; N = 9, y = 0,0056x - 10,198, R 2 = 0,4655, P = 0,043
Date metabolice de la copii obezi cu HOMA-IR ≤1,6, 1,6 Tabelul 3 Valorile testelor de sânge la copii cu sau fără toleranță la glucoză afectată
La copiii obezi cu HOMA-IR scăzut după 6 luni de intervenție fără medicamente, cum ar fi ghidarea nutrițională și exercițiile fizice, nivelurile de Val, Leu, Ile, Asp, Ala, Tyr, Glu și Pro au scăzut, dar cele de Gly și Ser mărită (fișier suplimentar 1). În schimb, la copiii obezi cu HOMA-IR crescut după intervenție, toți acești aminoacizi au avut tendința de a crește (fișa suplimentară 1).
Corelații care implică UA
Interesant este că UA a fost corelată pozitiv cu Leu (P = 0,005) și GluP = 0,019) și corelat negativ cu serina (Ser), glicina (Gly) și asparagina (Asn)P = 0,007, P = 0,003 și P = 0,013, respectiv) (Tabelul 2). Figura 3 prezintă diagramele de împrăștiere care descriu aceste corelații. Nu s-au corelat aminoacizi cu IMT (Tabelul 2).
Relațiile dintre UA și aminoacizi la toți copiii. A UA vs Leucine; N = 26, y = 0,032x + 1,1692, R 2 = 0,2925, P = 0,005. b UA vs Glutamat; N = 26, y = 0,048x + 3,3752, R 2 = 0,2183, P = 0,019. c UA vs Serine; N = 26, y = - 0,0307x + 8,4566, R 2 = 0,2769, P = 0,007. d UA vs Glicină; N = 26, y = - 0,0238x + 9,0036, R 2 = 0,328, P = 0,003. e UA vs Asparagine; N = 26, y = - 0,1028x + 8,826, R 2 = 0,2375, P = 0,013
Discuţie
Tabelul 5 rezumă relația dintre aminoacizii din sânge și HOMA-IR, UA, LDL/HDL și IMT. Obezitatea se transferă adesea din copilărie timpurie până la vârsta școlară și se extinde la maturitate în aproximativ 50% din cazuri. Există unele rapoarte că obezitatea, hiperlipidemia și hiperglicemia la adulți sunt corelate semnificativ cu IMT și sunt factori de risc pentru IMT sever crescută [11, 12]. Această corelație a fost observată și la copii [13, 14]. Deși arterioscleroza nu este frecventă la copiii obezi, IMT-ul lor tinde să fie mai mare decât la copiii non-obezi [14, 15]. În acest studiu, am constatat că IMT s-a corelat negativ cu HDL-CHO și pozitiv cu raportul LDL/HDL, deși nu a existat o corelație pozitivă cu LDL-CHO. Aceste descoperiri sugerează că obezitatea determină modificările arteriosclerotice chiar și în copilărie. Factorii de risc pentru ateroscleroză includ hipertensiunea, hiperglicemia și hiperlipidemia; cu toate acestea, puțini copii obezi dezvoltă hipertensiune. Hiperlipidemia și hiperglicemia sunt considerate a fi cei mai importanți factori de risc pentru ateroscleroză. În grupul nostru de copii obezi, glicemia și rezistența la insulină nu au afectat semnificativ IMT, dar parametrul metabolic al lipidelor s-a corelat semnificativ cu IMT.
Prezența în copilărie a unui număr mai mare de factori de risc pentru dezvoltarea bolilor legate de stilul de viață este asociată cu IMT mai mare la adulți [16, 17]. Raitakari și colab. [16] a raportat că un număr de factori de risc pentru ateroscleroză măsurați la adolescenții cu vârste cuprinse între 12 și 18 ani, inclusiv niveluri ridicate de LDL-CHO, IMC și tensiune arterială sistolică, au fost direct legate de IMT carotidă la adulți. Prezența acestor factori de risc la vârste mici și școlare a afectat, de asemenea, IMT la adulți. Prin urmare, ar trebui să luăm în considerare tratarea copiilor cu obezitate ca un grup de boli, mai degrabă decât ca un grup cu factori de risc legați de stilul de viață pentru boli viitoare.
Niveluri ridicate de aminoacizi, cum ar fi BCAA, Ala, Glu, Asp și Tyr, care sunt legate de diabetul de tip II, s-au arătat anterior la copiii obezi cu HOMA-IR ≥ 2,5 [7]. Am arătat corelații pozitive între HOMA-IR și mai mulți aminoacizi, inclusiv TFAA, la copiii cu toleranță la glucoză afectată (HOMA-IR ≥2,5). La acești copii, TFAA a fost, de asemenea, corelată semnificativ cu glicemia și insulina. Când se dezvoltă hiper-nutriția și se dezvoltă o toleranță redusă la glucoză, se acumulează atât glucoză, cât și aminoacizi. Celulele precum hepatocitele și celulele musculare scheletice devin saturate și se consideră că acest lucru duce la hiperaminoacidemie.
Au fost, de asemenea, documentate asocieri relevante între nivelurile de aminoacizi din plasmă și alți câțiva factori. Insulina, hormonul de creștere, glucagonul și IGF-1 joacă roluri importante în reglarea metabolismului energetic în corpul viu [18,19,20] și, așa cum sa demonstrat în acest studiu, insulina afectează nivelurile de aminoacizi din plasmă. Unele rapoarte au demonstrat o relație între IMT și aminoacizi [21, 22]. Cu toate acestea, aminoacizii din sânge nu au fost corelați semnificativ cu IMT în studiul nostru. Acest fenomen poate fi explicat printr-o modificare a metabolismului aminoacizilor și a sensibilității la insulină la copiii cu obezitate moderată, deoarece IMT a fost asociat cu LDL/HDL, dar nu și cu nivelurile de insulină din sânge sau HOMA-IR.
S-au arătat asociații între BCAA și sindromul metabolic, obezitatea, diabetul de tip II și/sau rezistența la insulină [7, 23, 24], iar BCAA sunt un marker de risc cardiometabolic independent de categoria IMC [25]. Creșterea BCAA și lipidelor plasmatice poate duce la dezvoltarea disfuncției celulelor β, care poate accelera trecerea de la o stare obeză, rezistentă la insulină, la sindromul metabolic și diabetul de tip II [24]. Pozefsky și colab. [26] a sugerat că afectarea activității insulinei și scăderea utilizării aminoacizilor în mușchi au crescut nivelurile plasmatice de BCAA din cauza absorbției reduse a BCAA în mușchi în bolile legate de stilul de viață. Mai mult, Newgard [24] a argumentat că creșterea BCAA din sânge circulant la subiecții obezi și rezistenți la insulină rezultă parțial dintr-o scădere a catabolismului AA în țesutul lor adipos. Substraturile de glucoză și lipide ușor de utilizat sunt considerate a elimina necesitatea catabolismului AA în țesutul adipos prin reglarea în jos a enzimelor catabolice BCAA prin suprimarea semnalizării receptorului-γ activat de proliferatorul peroxizomului în astfel de adaptări metabolice.
Un alt aminoacid deosebit de relevant este Ala. Würtz și colab. [27] a raportat că substraturile gluconeogenezei, inclusiv Ala, au crescut la adulți cu toleranță la glucoză afectată. Mai mult, Shimizu și colab. [28] a raportat că depleția de plasmă Ala servește drept indiciu pentru a crește valorile factorului de creștere a fibroblastelor plasmatice 21 și pentru a spori comunicarea ficat-grăsime, rezultând în activarea genelor lipolitice în țesuturile adipoase.
Aminoacizii nu sunt doar nutrienți esențiali care servesc ca sursă de energie pentru corpul uman, ci sunt implicați și în multe procese biochimice, inclusiv în biosinteza purinelor și producția de UA. În ultimii ani, s-a constatat că mulți factori, inclusiv IMC, consumul de alcool, hiperlipidemia și diabetul, contribuie la creșterea nivelului de UA din sânge [29]. Studiul nostru a indicat că la copiii obezi, UA poate fi afectată mai degrabă de metabolismul aminoacizilor decât de hiperglicemie și hiperinsulinemie. Am constatat scăderea nivelului de Gly și Ser cu niveluri crescute de UA în sânge. Scăderea nivelului de Gly și Ser din sânge s-a arătat anterior la pacienții adulți cu hiperuricemie asimptomatică sau gută, comparativ cu martorii sănătoși pentru adulți [30]. Același studiu a constatat niveluri crescute de sânge de Ala, Val, Ile și Orn la pacienții adulți cu hiperuricemie asimptomatică, dar acești aminoacizi nu au fost corelați cu UA în studiul nostru. Se pare că Gly și Ser sunt legate de procesul metabolic de creștere a nivelului UA în sânge [31]. Deși Ser nu are o legătură relevantă cunoscută cu sinteza UA, Gly este necesar pentru sinteza de novo a purinei [32], care este precursorul biosintetic al UA. Se poate consuma mai mult Gly pentru biosinteza purinei la copiii cu obezitate sub hiperinsulinemie.
Acest studiu are o serie de limitări notabile. În principal, dimensiunea eșantionului nostru a fost relativ mică, în special în ceea ce privește comparațiile între copiii cu și fără toleranță la glucoză afectată. Acest lucru a limitat puterea statistică de a trage concluzii ferme. În cele din urmă, nu am evaluat impactul factorilor dietetici și ai stilului de viață, sau al factorilor genetici, inclusiv istoricul familial de obezitate asupra modelelor de aminoacizi.
În ultimii ani, este necesară prevenirea obezității timpurii în copilărie, deoarece prevalența supraponderabilității și obezității la copiii cu vârsta de 5 ani și mai puțin a crescut în întreaga lume [33]. În Japonia, au fost efectuate examinări ale dezvoltării fizice și mentale la copiii mici cu vârsta de 1,5 și 3 ani. Geserick și colab. a raportat că majoritatea copiilor cu obezitate între 2 și 6 ani erau obezi în adolescență [34]. În viitor, trebuie să efectuăm screening și intervenție pentru obezitate la vârsta de 3 și 6 ani, înainte de intrarea lor la grădiniță și, respectiv, la școala primară. Aceasta ar trebui să implice o evaluare a stării lor metabolice. De asemenea, ar fi de dorit să studieze elevii de liceu cu obezitate. Analiza profilelor metabolice, inclusiv aminoacizii, la copii și adolescenți obezi din diferite grupe de vârstă poate dezvălui probleme și remedii suplimentare relevante pentru obezitatea infantilă.
Concluzii
Datele noastre susțin potențialul profilurilor de aminoacizi ca un marker util pentru intervenția timpurie în obezitatea infantilă. Important, aceste profiluri reflectă toleranța la glucoză afectată și hiperuricemia într-un stadiu obez precoce. Mai mult, o stare de aminoacizi dezechilibrați sau crescuți asociați cu obezitatea, cum ar fi BCAA în sânge, poate exacerba obezitatea și sensibilitatea la insulină. Prin urmare, rezultatele noastre susțin, de asemenea, opinia că o dietă cu un echilibru nutrițional bun și o terapie de efort care normalizează echilibrul aminoacizilor din sânge este importantă în tratamentul obezității.
Disponibilitatea datelor și a materialelor
Seturile de date utilizate și/sau analizate în timpul studiului curent sunt disponibile de la autorul relevant la o cerere rezonabilă.
- Aminoacizii cu lanț ramificat exacerbează tulburările metabolice ale glucozei și lipidelor hepatice legate de obezitate
- Asocieri între nivelurile de aminoacizi cu lanț ramificat, obezitate și complicații cardiometabolice
- Efectele benefice ale afinei în prevenirea obezității și a complicațiilor metabolice aferente
- Efectele benefice ale ghimbirului Zingiber officinale Roscoe asupra obezității și sindromului metabolic o recenzie
- Nașterea prin cezariană, travaliul prelungit influențează bacteriile intestinale ale sugarului, riscul de obezitate infantilă și