Rachel Marion-Letellier
1 unitate INSERM 1073, Universitatea Normandie, UNIROUEN, 22 Boulevard Gambetta, F-76183 Rouen, Franța; [email protected] (A.A.); [email protected] (G.S.)
2 Institutul de Cercetare și Inovare în Biomedicină (IRIB), Universitatea Normandie, UNIROUEN, F-76183 Rouen, Franța
Asma Amamou
1 unitate INSERM 1073, Universitatea Normandie, UNIROUEN, 22 Boulevard Gambetta, F-76183 Rouen, Franța; [email protected] (A.A.); [email protected] (G.S.)
2 Institutul de Cercetare și Inovare în Biomedicină (IRIB), Universitatea Normandie, UNIROUEN, F-76183 Rouen, Franța
Guillaume Savoye
1 unitate INSERM 1073, Universitatea Normandie, UNIROUEN, 22 Boulevard Gambetta, F-76183 Rouen, Franța; [email protected] (A.A.); [email protected] (G.S.)
2 Institutul de Cercetare și Inovare în Biomedicină (IRIB), Universitatea Normandie, UNIROUEN, F-76183 Rouen, Franța
3 Departamentul de Gastroenterologie, Spitalul Universitar din Rouen, 1 rue de Germont, F-76031 Rouen, Franța
Subrata Ghosh
4 Institutul de Medicină Translațională, Universitatea din Birmingham, Birmingham B15 2TT, Marea Britanie; moc.liamy@hsohgus
Abstract
1. Introducere
Cele mai frecvente tipuri de boli inflamatorii intestinale (IBD) sunt boala Crohn (CD) și colita ulcerativă (UC). Etiologia IBD este necunoscută, dar IBD se dezvoltă la indivizii predispuși genetic ca răspuns la factorii de mediu și rezultatul unui răspuns imun al mucoasei exacerbat la microbiota intestinală. IBD sunt condiții concomitente ale societăților industrializate [1]. Într-adevăr, prevalența IBD a continuat să crească în țările occidentale, iar țările nou industrializate din Asia, Orientul Mijlociu, Africa și America de Sud au prezentat o creștere rapidă a prevalenței IBD [1].
Se presupune că factorii de mediu joacă un rol decisiv în patogeneza IBD. Dieta este considerată a fi un potențial vinovat și am analizat anterior efectul potențial al nutrienților specifici în IBD [2]. Cu acest studiu, ne-am propus să ne concentrăm pe un alt potențial vinovat din dietă: aditivii alimentari.
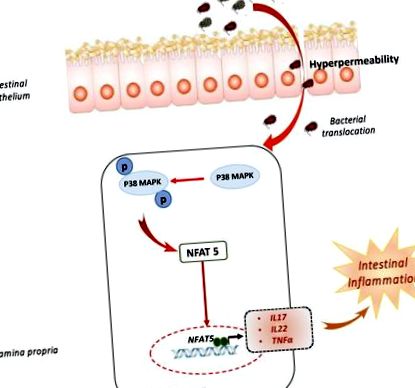
Consumul de alimente ultraprelucrate (UPF) a crescut în ultimul deceniu, în special în societățile industrializate [3,4,5], iar studiile din cohorta franceză NutriNet-Santé au găsit o asociere între consumul de UPF și cronic boli, cum ar fi un risc mai mare de cancer [6]. UPF reprezintă acum o parte importantă a dietei indivizilor francezi: UPF a reprezentat 16% din alimentele consumate în greutate, ceea ce corespunde cu 33% din aportul total de energie [7]. În plus, autorii au raportat, de asemenea, o asociere între aceste tipare dietetice și un risc mai mare de sindrom de colon iritabil (OR Q4 vs. Q1 [95% CI]: 1,25 [1,12-1,39], p-trend Figura 1). Tubbs și colab. au calculat conținutul de NaCl al unei serii de alimente disponibile în alimentele și restaurantele de tip fast-food folosind baza de date SELF Nutrition și au raportat că aceste alimente conțin aproximativ 4% g/g NaCl [13]. Creșterea concentrației de NaCl de la 10 la 80 mM a indus producerea de citokine inflamatorii, cum ar fi calea IL (interleukină) -23/IL-17 în celulele mononucleare ale laminei proprii intestinale normale [14]. Dieta bogată în sare (HSD) a exacerbat colita indusă chimic, în timp ce inhibarea farmacologică a p38/MAPK a abrogat efectul acesteia în ambele modele [14]. Tubbs și colab. a demonstrat efectul dăunător al HSD în numeroase modele de colită, cum ar fi IL-10 -/- sau colita infecțioasă [13]. Interesant este că Aguiar și colab. a raportat că sarea dietetică a exacerbat colita, dar de la sine poate declanșa inflamația intestinului prin creșterea permeabilității intestinale și a scorului histologic inflamator [15]. Mai recent, HSD sa dovedit a avea un efect dăunător asupra microbiotei intestinale prin scăderea nivelului de Lactobaccilus și producția de acizi grași cu lanț scurt [16].
Dieta bogată în sare favorizează inflamația intestinală. Expunerea la dietă bogată în sare a dus la o permeabilitate intestinală mai mare și la disbioză. Fosforilarea p38 MAPK indusă de dietă bogată în săruri și NFAT5 în activarea celulelor mononucleare ale laminei proprii cu o expresie ulterioară a expresiei citokinelor inflamatorii precum IL17, IL22 și TNFα.
Aceste studii au ridicat rolul potențial al sării dietetice ca factor declanșator de mediu pentru dezvoltarea IBD, creând un mediu dăunător, care este mai vulnerabil la insultele inflamatorii.
Fosfatul alimentar a fost mai puțin studiat decât sarea alimentară. Cu toate acestea, fosfatul anorganic alimentar este abundent în alimentele procesate ca aditivi alimentari, în special în alimentele rapide și carnea procesată. Aportul de fosfat este de două sau trei ori mai mare [17]: 1655 mg/zi pentru bărbați și 1190 mg/zi pentru femei în SUA, comparativ cu aportul de referință dietetic la 700 mg/zi în țările industrializate. Efectul său dăunător asupra inflamației intestinale a fost, de asemenea, demonstrat. Sugihara și colab. șobolani Sprague - Dawley hrăniți cu o dietă conținând 0,5% până la 1,5% fosfat timp de 7 zile înainte de inducerea colitei [18]. Deoarece dieta standard pentru animale conține aproximativ 5000 mg/kg de fosfat, adică 0,5%, intervalul de fosfat de la 0,5% la 1,5% utilizat în studiu imită intervalul de expunere la om de la 1 la 3 ori din aportul alimentar recomandat. Fosfatul alimentar agravează colita prin accentuarea pierderii în greutate corporală prin creșterea indicelui de activitate a bolii și prin activarea NF (factorul nuclear) -κB [18]. Autorii studiului au descoperit, de asemenea, un răspuns inflamator crescut in vitro cu 2 mM fosfat în celulele RAW264 tratate cu liposacaride (LPS) [18].
Din câte știm, doar un studiu a raportat date clinice referitoare la consumul de sare și IBD [19]. Într-o cohortă din SUA din 194.711 femei, autorii acestui studiu au raportat că aportul dietetic de potasiu (Ptrend = 0,005), dar nu sodiu (Ptrend = 0,440) a fost invers asociat cu riscul de CD [19]. Autorii nu au observat nicio asociere semnificativă între potasiu și sodiu din dietă și riscul de UC [19].
4. Luați Bitterul cu dulceața
O treime din pacientul cu IBD a suferit simptome asemănătoare sindromului intestinului iritabil [39] și o metaanaliză recentă a confirmat că restricția dietetică a oligozaharidelor fermentabile, dizaharidelor, monozaharidelor și poliolului (FODMAP) a redus simptomele funcționale gastro-intestinale, cum ar fi balonarea [40]. La voluntarii sănătoși, mecanismele din spatele dietei cu conținut scăzut de FODMAP au implicat scăderea Bifidobacteriei și reducerea hidrogenului respirației [41].
5. Puneți pedala pe metal
6. Pentru a adăuga sau a nu adăuga
Bisfenolul oral este o substanță chimică utilizată în pachetele alimentare. Bisfenolul A oral, la o doză mai mică decât aportul zilnic tolerabil, a putut induce hiperpermeabilitatea intestinală la șobolani, iar acest efect apare într-o manieră dependentă de doză [53]. În colita indusă de acidul trinitrobenzen sulfonic (TNBS), expunerea perinatală a bisfenolului alimentar A a crescut activitatea mieloperoxidazei la șobolani femele, dar nu și la șobolani masculi [53].
Hipersensibilitatea viscerală indusă de bisfenol A dietetic ca răspuns la distensia colorectală [53]. Un studiu recent a evidențiat efectul bisfenolului A în colita indusă chimic la șoarecii femele ovariectomizați, iar autorii au demonstrat că expunerea la bisfenol A a dus la o colită agravată prin metaboliți ai microbiotei intestinale, cum ar fi un nivel scăzut de triptofan [54].
Tratamentul termic alimentar duce la compuși neoformați, cum ar fi produsele de reacție Maillard. Expunerea la acești produse de reacție Maillard a atenuat răspunsul inflamator [55] și disbioza la modelele de colită [56].
7. Dietele de excludere
Dietele de excludere sunt frecvent urmate de pacienții cu IBD [57]. Aceste diete de excludere au raționamente științifice slabe sau deloc, dar expun pacienții cu IBD la deficiențe nutriționale. Ultimele linii directoare ale Societății Europene pentru Nutriție Clinică și Metabolism (ESPEN) privind nutriția clinică la pacienții cu IBD au declarat că nu există o dietă IBD în boala activă (consens puternic - acord de 96%) [58]. Vom limita secțiunea noastră la câteva diete de excludere care ar putea explica unele beneficii pentru a limita expunerea la aditivii alimentari.
Se recomandă nutriția enterală exclusivă (EEN) ca tratament de primă intenție pentru a induce remisia la copii sau adolescenți cu CD [58], deși EEN nu este recomandat la pacienții adulți. Mecanismele din spatele EEN nu sunt pe deplin înțelese, dar pot implica corecția disbiozei sau menținerea barierei intestinale [59]. Mecanismele EEN pot implica, de asemenea, absența unor componente alimentare dăunătoare specifice, cum ar fi expunerea la aditivi alimentari.
Există, de asemenea, îngrijorare cu privire la prezența pesticidelor în lanțul alimentar, deși încă nu există dovezi care să lege pesticidele de IBD [60]. Un studiu recent realizat de cohorta franceză NutriNet a constatat că un consum mai frecvent de alimente organice a scăzut riscul de cancer [61].
Am menționat anterior efectul nanoparticulelor în disfuncția barierei intestinale în modelele preclinice și două studii clinice au investigat impactul dietei scăzute sau fără microparticule la pacienții cu IBD. Primul a fost un studiu foarte mic la 20 de pacienți cu CD care a arătat un efect benefic al dietei scăzute sau fără microparticule la pacienții cu CD ileală, cum ar fi scăderea aportului de corticosteroizi [62].
Al doilea studiu a inclus 84 de pacienți cu CD activ timp de 16 săptămâni [63], iar autorii nu au găsit niciun beneficiu al excluderii microparticulelor asupra indicelui activității bolii inflamatorii, calprotectina fecală sau permeabilității intestinale [63]. Am raportat anterior efectele caragenanului asupra barierei intestinale la modelele preclinice. Un mic studiu pilot a investigat efectul dietei fără caragenan la 12 pacienți cu UC [32]. Trei din zece pacienți UC care au urmat dieta fără caragenan timp de 12 luni au recidivat comparativ cu trei din cinci pacienți din grupul de control (RR (risc relativ) 0,50, IÎ 95% 0,15-1,64), dar poate fi dificil să concluzionează că există efecte benefice din cauza dimensiunii foarte mici a studiului.
Dietele fără lactoză sunt frecvente la pacienții cu IBD. Într-un mic studiu recent efectuat pe 78 de pacienți cu IBD din Islanda, 60% (47 de pacienți) au raportat limitarea consumului de lactate sau chiar excluderea acestuia, dar doar opt dintre aceștia au utilizat suplimente de calciu [64]. Deficiența de lactază dobândită este raportată frecvent la pacienții cu CD, în special la CD-ul proximal. Într-un studiu clinic efectuat la 77 de pacienți cu UC, publicat în 1965, dietele fără lapte au avut doar un beneficiu pentru unul din cinci pacienți [65] și nu au justificat dietele cu restricții lactate la toți pacienții cu IBD. La 29 de pacienți pediatrici cu UC, excluderea proteinelor din laptele de vacă nu a avut nicio influență asupra inducerii și/sau menținerii remisiunii [66].
Dieta paleolitică este o altă dietă de excludere fără raționament științific. Principiile sale sunt că sistemul nostru gastro-intestinal nu a evoluat alături de dieta noastră modernizată și poate explica numeroase boli inflamatorii. Această dietă exclude o mulțime de alimente, cum ar fi alimentele ultra-prelucrate sau cerealele, și se limitează la carnea sălbatică și la o dietă necereală, pe bază de plante. Din câte știm, singurele date publicate despre dieta paleo și IBD sunt un raport de caz maghiar despre un pacient adolescent cu CD refractar la tratamente. Acest pacient cu CD a avut o remisie clinică după 2 săptămâni pe o dietă paleo și a fost încă în remisie 15 luni mai târziu [67]. Extrapolarea dintr-un studiu unic de control al cazurilor nu este permisă, iar excluderea a atât de multe alimente poate fi asociată cu numeroase deficiențe nutriționale.
O treime dintre pacienții cu IBD au suferit simptome asemănătoare IBS, iar excluderea parțială a unor componente fermentabile poate fi asociată cu beneficii ale simptomelor funcționale. De exemplu, într-un studiu mic cu 16 pacienți cu CD în remisie, o dietă strictă de excludere a grâului și a produselor lactate timp de 2 săptămâni a redus semnificativ simptomele funcționale, cum ar fi durerea abdominală [68]. Într-un studiu prospectiv cu 89 de pacienți cu IBD în remisie, o dietă cu conținut scăzut de FODMAP timp de 6 săptămâni a redus simptomele asemănătoare IBS, în timp ce a crescut calitatea vieții la pacienți [69].
Dietele de excludere nu sunt recomandate și pot expune pacienții la numeroase deficiențe nutriționale. În plus, sunt adesea observați factori de cofondare, ceea ce duce la excluderea alimentară nejustificată. Recent, un studiu clinic dublu-orb a identificat faptul că compoziția fructanului, în loc de gluten, a indus simptome funcționale la pacienții cu sensibilitate la gluten non-celiacă auto-raportată [69]. Rezultate similare au fost raportate anterior cu privire la intoleranța la lactoză [70]. Evitarea unor alimente a fost identificată ca un factor de risc pentru malnutriție la pacienții cu IBD într-o cohortă spaniolă [71]. De remarcat, malnutriția a crescut alte complicații, cum ar fi rate mai mari de intervenții chirurgicale și spitalizare, iar malnutriția este asociată cu calitatea vieții modificate la pacienții cu IBD [11,72]. În plus, dietele de excludere pot limita socializarea și masa, deoarece mulți pacienți cu IBD ar fi refuzat să ia masa, deoarece acest lucru nu ar fi conform cu dieta lor de excludere [11]. Excluderea produselor lactate, cum ar fi într-o dietă fără lactoză sau dietă paleo, poate crește riscul de osteoporoză la pacienții cu IBD, în timp ce dietele fără gluten sunt asociate cu scăderea diversității microbiotei.
8. Concluzii
Dieta este un factor de risc de mediu modificabil, iar aditivii alimentari pot acționa ca potențiatori ai bolii. Dieta este un punct crucial pentru pacienții cu IBD, iar dietele de excludere par să ofere o alternativă care să permită un control relativ al dezvoltării bolii. Cu toate acestea, ultimele linii directoare ESPEN nu au recomandat nicio dietă de excludere pentru inducerea sau menținerea remisiunii la pacienții cu IBD, dar au recomandat pacienților cu IBD să fie consiliați de un dietetician pentru a evita malnutriția. În plus, sa raportat recent că pacienții cu IBD în remisie au un profil alimentar dezechilibrat pentru nutrienții esențiali [73]. Mai degrabă decât dietele de excludere, alimentele de casă pot fi prioritizate pentru a reduce cantitățile de aditivi alimentari și pentru a permite pacienților să-și controleze expunerea la multe ingrediente ascunse, cum ar fi sare adăugată sau zaharuri. Alimentele făcute în casă sunt deja recomandate în ultimele linii directoare nutriționale din Franța și, spre deosebire de dietele de excludere, gătitul poate reprezenta o formă de timp convivial, permițând o calitate mai bună a vieții cu o socializare sporită. În plus, obezitatea este din ce în ce mai frecventă la pacienții cu IBD [74], iar prepararea alimentelor de la zero poate fi asociată cu un risc redus de obezitate [75] sau cu o cantitate scăzută de energie dietetică din alimentele ultraprocesate [76].
Abrevieri
| AIEC | Escherichia coli aderentă-invazivă |
| CD | Boala Crohn |
| CMC | carboximetilceluloza |
| EEN | nutriție enterală exclusivă |
| ESPEN | Societatea Europeană pentru Nutriție Clinică și Metabolism |
| FODMAP | oligozaharide fermentabile, monozaharide dizaharide și poliol |
| HSD | Dieta bogată în sare |
| IBD | boli inflamatorii intestinale |
| LPS | lipozaharidă |
| NFAT5 | factorul nuclear al celulelor T activate 5 |
| NLRP | Receptor de pirină asemănător cu NOD |
| P80 | polisorbat-80 |
| SCFA | acid gras cu lanț scurt |
| SMAD | mame mici împotriva decapentaplegicului |
| TNBS | acid trinitrobenzen sulfonic |
| TiO2 | dioxid de titan |
| UC | colită ulcerativă |
| UPF | alimente ultraprocesate |
Finanțarea
Această cercetare nu a primit finanțare externă.
- Un nou medicament IntestoGuard testat pentru câinii cu boală inflamatorie intestinală Iowa State University
- Boli inflamatorii intestinale (IBD) și pancreatită - veterinari SASH
- Boala inflamatorie a intestinului (IBD) American Gastroenterological Association
- Cum să-ți mănânci toate întrebările referitoare la alimentație și dietă Răspuns - Inițiativă adevărată pentru sănătate
- Munca grea îmbunătățește gustul mâncării, arată studiul - ScienceDaily