Descărcați în format PDF
Despre această pagină
International Review of Cell and Molecular Biology
3.1.2 CASK și Caskin
Familia Caskin, compusă din doi membri, Caskin-1 și -2 (ckn în Drosophila) mediază transducția semnalului LAR-RPTP în timpul ghidării axonului motor printr-o interacțiune mediată de domeniu SAM N-terminală care este competitivă cu legarea liprin-α (Weng și colab., 2011). În plus, Caskin-1 se leagă de proteina adaptor SH2/SH3 Dock/Nck și de proteinele EphB1 prin domenii distincte pentru a coordona căile de semnalizare implicate în creșterea și ghidarea axonilor (Pesti și colab., 2012). Cu toate acestea, rolurile sale presinaptice în neuronii mamiferelor, în special funcția interacțiunilor CASK - Caskin, nu au fost încă explorate.
Cerebelul: tulburări și tratament
Ginevra Zanni, Enrico Bertini și Manualul de neurologie clinică, 2018
Microcefalie cu hipoplazie pontină și cerebeloasă (MICPCH) sau sindrom CASK (MIM # 300749)
Sindromul CASK a fost descris pentru prima dată la o fată de 4 ani, purtătoare a unei inversiuni paracentrice aparent noi 46X, inv (X) (p11.4p22.3), perturbând gena serin protein kinazei (CASK) dependentă de calciu/calmodulină, situat la Xp11.4, care codifică o proteină de schelă multidominială care aparține familiei de proteine guanilat kinază asociată cu membrană găsită la sinapsele neuronale implicate în traficul, direcționarea și semnalizarea canalelor ionice (Stevenson și colab., 2000; Hsueh, 2009) . Pacientul a prezentat microcefalie congenitală și postnatală marcată, întârziere severă a dezvoltării, convulsii și pierderea auzului senzorial neural. Avea anomalii faciale minore: frunte scăzută, hipertelorism, punte nazală largă, filtru neted, urechi mari și micrognatie. De asemenea, a avut hiperpnee episodică și paloare de disc optic cu anisocorie. RMN cerebral a arătat hipoplazie cerebeloasă predominantă în vermis, un pons mic cu baza pontis aplatizată, al patrulea ventricul ușor mărit și numărul redus și complexitatea gyri corticale.
Prin screening-ul unei serii de pacienți cu microcefalie, întârziere a dezvoltării și hipoplazie pontină și cerebeloasă, s-au găsit două deleții heterozigote identificate prin array-CGH și o mutație missense în exonul 21 care duc la un codon oprit prematur la trei fete cu fenotip clinic și neuroradiologic. foarte asemănător cu primul pacient descris. De asemenea, a fost găsită o mutație hemizigotă, care afectează parțial îmbinarea exonului 9 la un băiat grav afectat care a murit la 2 săptămâni (Najm și colab., 2008). Hipoplazia mediană a creierului posterior a fost mai severă, corpul calos a fost subțire și nemelinizat, iar cortexul a prezentat o zonă de pachygyria. Examenul neuropatologic al cerebelului a arătat folii slab formate și neramificate, un strat granular intern practic absent și un strat granular extern anormal de gros. Stratul molecular a fost hipercelular și dezorganizat.
Trei mutații noi de sens și o mutație a situsului de îmbinare a CASK au fost găsite în patru familii cu dizabilități intelectuale ușoare până la moderate legate de X și nistagmus congenital. Indivizii afectați, în majoritate bărbați, aveau circumferința normală a capului sau o macrocefalie relativă. Imagistica creierului a fost efectuată numai în două din cele patru familii; în propunerea unei familii, RMN a prezentat pachygria și hipoplazia cerebeloasă, în timp ce în cealaltă familie, în care jumătate dintre persoanele afectate au avut o dezvoltare cognitivă normală, RMN a fost raportat ca fiind normal. Constatările oculare au inclus strabism, cataractă, miopie sau acuitate vizuală redusă. Mersul instabil și convulsiile au fost prezente la unii, dar nu la toți, indivizii afectați.
În două familii suplimentare cu întârziere mintală aparent nesindromică legată de X, au fost identificate mutații noi de sens în exonii 8 și 27 ai genei CASK (Hackett și colab., 2010). Astfel, fenotipurile asociate cu mutațiile CASK variază de la o întârziere ușoară a dezvoltării, cu sau fără nistagmus congenital, până la afectarea cognitivă severă asociată cu hipoplazie cerebelară și pontină și anomalii ale dezvoltării corticale.
Moog și colab. (2011) au identificat 20 de paciente de sex feminin cu variații ale numărului de copii submicroscopice, inclusiv nouă deleții și două duplicări care acoperă CASK și diferite mutații inactivante ale genei și au analizat spectrul fenotipic asociat cu mutațiile CASK de pierdere a funcției.
Burglen și colab. (2012) au identificat mutații care inactivează CASK la doi băieți (unul dintre aceștia era un mozaic) și opt fete cu hipoplazie pontocerebelară, întârziere psihomotorie, dizabilitate intelectuală severă, microcefalie progresivă, distonie, dismorfism ușor și scolioză. Alte semne au fost frecvent asociate: întârzierea creșterii, anomalii oftalmologice (glaucom, megalocornea și atrofie optică), surditate și epilepsie. La 3 paciente de sex feminin suplimentare au fost detectate deleții submicroscopice Xp11.4, inclusiv gena CASK.
Moog și colab. (2015) au identificat mutații CASK la 8 pacienți de sex masculin, inclusiv o prostie, o deleție de 5 bp, o mutație a codonului de start și cinci deleții și duplicări parțiale ale genelor; șapte au fost de novo, inclusiv trei mozaicisme somatice. A fost propusă o clasificare fenotipică pentru sindromul CASK: (1) MICPCH cu encefalopatie epileptică severă cauzată de mutații hemizigote de funcție; (2) MICPCH asociat cu modificări inactivante în starea mozaicului sau cu o mutație parțial penetrantă; și (3) sindrom/nonsindromic cu dizabilități intelectuale ușoare până la severe, cu sau fără nistagmus cauzate de miscații CASK și mutații de splice care lasă proteina CASK intactă, dar probabil își modifică funcția sau reduc cantitatea de proteină normală.
Reglare presinaptică de către liprine
K. Miller, D. Van Vactor, în Enciclopedia Neuroștiinței, 2009
Liprin-α și CASK
CASK (CAKI sau CAMGUK în muște) este o proteină asociată cu membrană guanilat kinază (MAGUK) care are un domeniu CaM-kinază N-terminal inactiv catalitic care interacționează cu Veli și Mint-1, un domeniu SH3 care leagă tipul N Canalele Ca 2+ și un domeniu PDZ central care interacționează cu alte proteine de membrană, cum ar fi glicoforine, neurexine și sindecan. Observarea unei interacțiuni între CASK și sindecan este deosebit de interesantă în lumina demonstrației recente că o altă proteină care interacționează cu liprina-α, LAR, se leagă și de sindecan. În plus, LAR și CASK leagă ambele liprin-α în aceeași regiune (vezi figura 1 ). Am ridicat posibilitatea ca interacțiunea dintre aceste trei proteine să fie relevantă pentru funcția lor, dar stabilirea modului în care aceste proteine interacționează va necesita o investigație suplimentară.
Întreruperea caki are ca rezultat o creștere a eliberării spontane a neurotransmițătorului și o afectare a răspunsului căii gigantice de fibre la stimularea continuă. Aceste defecte par să implice pierderea controlului presinaptic al exocitozei, care este similar cu defectul observat la mutanții liprin-α. Defectul neurotransmisiei observat la mutanții caki este una dintre multele posibilități de a explica modul în care întreruperea liprinei-α duce la defecte ale neurotransmisiei.
Glicobiologie și dezvoltare celulară; Sănătate și boli în glicedicină
4.17.3.5 Formarea sinapselor
Syndecan-2 este localizat în mod specific în sinapsele din creierul matur și în coloanele dendritice ale neuronilor cultivați pe termen lung. 231 Acest PG poate interacționa cu proteinele din domeniul PDZ, inclusiv proteina postsinaptică CASK/LIN-2 prin motivul său tetrapeptidic EFYA COOH-terminal și sindecan-2 și CASK co-localizează în sinapse. 232 Expresia excesivă a sindecanului-2 în neuronii hipocampici cultivați pe termen scurt accelerează maturarea coloanelor dendritice, dar nu afectează numărul sinapselor sau coloanei vertebrale. 231 În schimb, versicanul pare a fi implicat în maturizarea presinaptică. În tectul embrionar al puiului optic, versicanul este exprimat selectiv prin subseturi de interneuroni limitați la lamina retinorecipientă, în care axonii retinieni se arborizează și formează sinapse. 233 In vitro, versican promovează mărirea varicozităților presinaptice în axonii retinieni. Epuizarea versicanului in ovo de interferența ARN are ca rezultat arborii retinieni cu varicozități mai mici decât cele normale, indicând faptul că acest CSPG oferă un indiciu specific laminei pentru maturarea presinaptică.
Neuroligine și Neurexine
35.8.2 Mecanisme biologice celulare ale funcțiilor NRX și NL
Liprin-α și Asamblarea Citomatrixului sinaptic ☆
Parteneri suplimentari ai Liprin-α
Interacțiuni ale liprinei-α cu proteinele pre-sinaptice
Structura AZ pre-sinaptică este alcătuită dintr-un nucleu de cinci proteine: Liprin-α, RIM, UNC-13/mUnc-13, RIM-BP și ELKS (cu omologi numiți Rab6IP2, CAST, Brp și ERC). Dintre acestea, RIM și ELKS se leagă de regiunea spiralată a liprinului-α. La șoareci, RIM reglează dimensiunea grupului ușor de eliberat de SV și sunt esențiale pentru reglarea probabilității normale de eliberare a neurotransmițătorului, precum și eliberarea în timpul plasticității sinaptice pe termen scurt. RIM promovează, de asemenea, acumularea de canale de calciu atât la șoareci, cât și la Drosophila. În C. elegans, întreruperea atât a RIM, cât și a Liprin-α reduce apariția proiecțiilor dense la AZ, despre care se crede că joacă un rol în ancorarea SV la AZ. Mai mult, Liprin-α de mamifer reglează cifra de afaceri a RIM, precum și proteina CASK asociată cu AZ, sugerând un mecanism prin care Liprin-α poate regla dinamic AZ.
Proteinele ELKS au o localizare foarte specifică la AZ, sunt necesare pentru dezvoltarea sinaptică și morfogeneza AZ și s-a demonstrat în Drosophila că controlează dimensiunea bazei de SV-uri ușor de eliberat. În C. elegans, izoforma ELKS/CAST2 este necesară pentru funcția Liprin-α la sinapsă; în plus, câștigul funcției Liprin-α la viermi crește recrutarea acestei izoforme ELKS la proiecții dense. În plus, se crede că izoforma ERC2/CAST1 în C. elegans modulează nivelurile de Liprin-α.
Pe lângă interacțiunile sale cu proteinele AZ de bază, Liprin-α interacționează și cu proteina GIT1 asociată cu AZ, un interactiv al receptorului kinazei cuplate cu proteina G. GIT1 are un rol în reciclarea SV și a fost observat că reglează puterea și probabilitatea de eliberare a neurotransmițătorului. Mai mult, interacțiunea dintre GIT1 și Liprin-α este necesară pentru traficul intracelular al receptorilor AMPA. Este tentant să speculăm că aceeași interacțiune GIT1-Liprin-α poate juca roluri specifice contextului în traficul trans-Golgi, transport axonal, trafic dendritic și trafic SV.
Liprin-α 1-4 a fost, de asemenea, observat ca fiind o componentă în complexul pre-sinaptic MALS/Veli-CASK-Mint-1 al proteinelor PDZ, o asociere care apare între domeniile SAM ale Liprin-α și N-terminal regiunea CASK. Întreruperea tuturor celor trei izoforme MALS la șoareci a fost letală în decurs de o oră de la naștere și a afectat transmisia sinaptică excitativă. În concordanță cu defectele de transmisie, șoarecii knockout MALS au prezentat epuizare în bazinul eliberabil de SV, posibil din cauza reaprovizionării defectuoase a veziculelor din bazinul de rezervă, indicând importanța complexului MALS/Veli-CASK-Mint-1/Liprin-α.
Sindromul X fragil și dizabilitatea intelectuală legată de X
107.3.7.4 Gene suplimentare
CASK codifică proteina kinază serină dependentă de calciu-calmodulin. Mutațiile din CASK au fost descrise inițial la fetele cu ID severă, microcefalie și hipoplazie cerebeloasă și la un băiat care a murit la vârsta de 2 săptămâni, ducând la ideea că mutațiile CASK sunt dominante, cu o viabilitate redusă la băieți (165). Cercetările ulterioare indică faptul că acest lucru poate fi adevărat pentru mutațiile severe, cu pierderea funcției în CASK, dar că mutațiile funcționale reduse se găsesc la băieții cu ID. Tarpey și colab. (7) au găsit mutații la băieți din patru din 358 de familii XLID (1,1%) în eșantionul consorțiului GOLD. Nistagmusul congenital a fost prezent la indivizii afectați din două dintre familiile originale, ceea ce i-a determinat pe cercetători să caute ulterior mutații în CASK în 45 de probanzi suplimentari cu ID și fie nistagmus, fie microcefalie; 2 din cei 45 de probanzi (4,4%) au prezentat mutații în CASK (166). Astfel, prezența nistagmusului la un băiat cu ID poate fi considerată un indicator pentru analiza secvenței CASK.
Consorțiul GOLD a furnizat, de asemenea, dovezi că CUL4B ar putea fi o cauză semnificativă a XLID (167). Ei au identificat mutații în 8 din 250 de familii XLID (3%). CUL4B codifică o ubiquitină E3 ligază. În plus față de ID, băieții cu mutații tind să aibă macrocefalie, statură scurtă, convulsii și izbucniri agresive (167) .
Gena IQSEC2 este o altă genă identificată prin secvențierea extinsă în familiile GOLD (168). Au fost identificate patru mutații fără sens în 208 familii XLID (1,9%). Mutațiile par a fi asociate cu întârzierea limbajului, convulsii și caracteristici autiste.
S-a constatat că mutațiile din OPHN1 cauzează ID în eșantionul EuroMRX. OPHN1 codifică oligofrenina 1 și proteina care activează Rho-GTPaza. Mutații au fost găsite la probandii din familii considerate a avea NS-XLID, dar RMN-urile persoanelor afectate au documentat hipoplazia cerebelară și displazia vermisului (169). Acest lucru a condus Zanni și colab. să sugereze că investigația neuroradiologică a indivizilor cu ID să fie utilizată pentru a detecta anomalii subtile ale creierului care ar putea fi utilizate pentru a direcționa diagnosticul molecular (169) În setul EuroMRX, trei din 63 de familii cu purtători obligați de sex feminin (4,8%) au mutații în OPHN1 și o fracțiune similară a familiilor cu perechi de frați afectați în eșantion (3 din 65; 4,6%) au mutații în această genă ) .
Mutațiile în PQBP1 au fost găsite atât în formele sindromice, cât și în cele nesindromice ale XLID. Aceasta include sindromul Renpenning, un sindrom XLID care include microcefalie, testicule mici și statură scurtă (170). Există un spectru clinic larg asociat cu mutații în PQBP1 și acest lucru poate include, de asemenea, defecte congenitale ale inimii și anomalii cranio-faciale (171) și microftalmie (172). Din 111 familii XLID cu femele purtătoare obligate în eșantionul EuroMRX, de Brouwer și colab. s-au găsit cinci cu mutații în PQBP1 (4,5%); pe de altă parte, nu s-au găsit mutații la 73 de familii cu perechi de frați afectați sau la 465 cazuri sporadice masculine de ID (6). Un studiu realizat de Jensen și colab. din nou a constatat o frecvență mai mică a mutațiilor (0,7%) la familiile cu mai puțini băieți afectați; una dintre cele 135 de familii cu cel mult doi frați afectați sa dovedit a avea o mutație PQBP1 (160) .
Mutațiile din JARID1C au fost găsite inițial în 5 din 179 de familii din eșantionul EuroMRX (2,8%) (173). O analiză suplimentară a 144 de familii NS-XLID, de asemenea, colectate prin EuroMRX a identificat cinci mutații JARID1C, o frecvență de 3,5% (174). Această frecvență nu s-a menținut în toate eșantioanele; Abidi și colab. a găsit o mutație din 172 probandi XLID generale (0,6%) (175). Utilizarea staturii scurte ca criteriu de selecție ar putea crește această frecvență; 1 din 92 probanzi cu ID și statură scurtă (1,6%) s-a dovedit a avea o mutație JARID1C (175). În cele din urmă, 2 din 208 familii XLID (1%) din eșantionul GOLD au prezentat o mutație în JARID1C (176). Colectarea datelor de la toți indivizii publicați cu mutație în JARID1C indică faptul că au un ID care variază de la ușoară la severă, precum și un tablou clinic care poate include statură scurtă, convulsii, hiperreflexie și microcefalie (176). Femelele purtătoare pot fi ușor afectate.
SynCAM
Interacțiuni intracelulare ale proteinelor SynCAM
Comparativ cu analiza extracelulară a legării SynCAM, interacțiunile domeniilor citoplasmatice ale proteinelor SynCAM sunt mai puțin bine caracterizate. În parte, promiscuitatea secvenței de interacțiune PDZ de tip II, pe care proteinele SynCAM o prezintă în termeni C extremi, poate media interacțiuni in vitro cu un număr de parteneri care pot să apară sau nu sau să fie semnificativi in vivo. Studiile de cromatografie a afinității au demonstrat că coada citoplasmatică a SynCAM 1 este capabilă să interacționeze cu moleculele adaptoare exprimate de creier CASK, Mint1 și sintenină, toate acestea fiind proteine care conțin domeniu PDZ, care se găsesc în diferite măsuri la sinapsele centrale. Semnalizarea SynCAM 1 în sistemul nervos este mediată plauzibil prin intermediul acestor proteine adaptoare, deoarece acestea sunt, de asemenea, îmbogățite sinaptic. Este probabil ca acești parteneri de interacțiuni ai SynCAM 1 să lege și secvențele citoplasmatice ale celorlalți membri ai familiei SynCAM, dar acest lucru rămâne de confirmat. Așa cum era de așteptat, SynCAM 1 nu interacționează cu proteine care conțin domeniu PDZ de tip I, cum ar fi PSD-95. Mai mult, SynCAM 1 nu leagă proteina afadină care conține domeniu PDZ care interacționează cu nectină.
Interacțiunile secvențelor citoplasmatice SynCAM 1 au fost, de asemenea, studiate în afara SNC. SynCAM 1 interacționează cu DAL1, un membru al familiei de proteine 4.1 exprimat în plămâni. Această interacțiune a fost confirmată atât cu tehnici biochimice, cât și cu tehnici biologice celulare. În plus, proteina care conține domeniul PDZ numită „proteină asociată cu Lin7-2” a fost identificată din testicule ca fiind o proteină capabilă să interacționeze cu SynCAM 1 într-un ecran cu două hibrizi de drojdie.
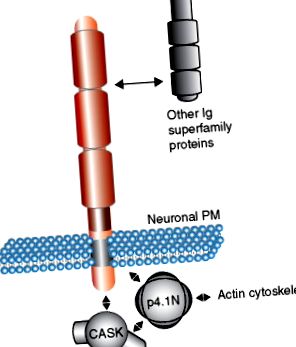
Similitudinea secvenței domeniilor citoplasmatice ale SynCAM și neurexinelor ( Figura 1 (b) ) sugerează că acestea funcționează prin angajarea unor molecule adaptoare similare pe partea presinaptică. SynCAM-urile și neurexinele împărtășesc o secvență de interacțiune cu proteina 4.1 și un motiv de interacțiune PDZ tip II. În special, proteina 4.1 este, de asemenea, capabilă de interacțiune cu molecula de schele CASK, asigurând formarea potențial preferată a unui complex trimeric de SynCAM, proteina 4.1 și CASK ( Figura 2 ). Un complex similar a fost descris pentru proteinele neurexinei. Domeniile citoplasmatice SynCAM pot fi, prin urmare, imaginate ca site-uri de nucleație multivalente pentru schele și molecule citoscheletice, care, atunci când sunt grupate, asamblează complexe moleculare, cum ar fi mașinile de eliberare a veziculelor. Acest mecanism de grupare oferă o ipoteză atractivă pentru modul în care moleculele de adeziune celulară mediază asamblarea complexelor de membrane sinaptice.
Figura 2. Model de interacțiuni proteină - proteină a familiei moleculei de adeziune a celulelor sinaptice (SynCAM). SynCAM 1 interacționează cu diferiți membri ai superfamiliei imunoglobulinei (Ig) prin domeniile sale extracelulare. Intracelular, SynCAM 1 interacționează cu molecule adaptor care conțin domeniu PDZ, cum ar fi CASK și formează un complex trimeric cu p4.1N care ar putea nuclea structurile citoscheletale la sinapsă. PM, membrana plasmatică.
- Biscuit - o prezentare generală Subiecte ScienceDirect
- Acetonă - o prezentare generală Subiecte ScienceDirect
- ASTALT Ratio - o prezentare generală Subiecte ScienceDirect
- Braising - o prezentare generală Subiecte ScienceDirect
- Acanthosis Nigricans - o prezentare generală Subiecte ScienceDirect