Abstract
Regenerarea pancreatică (PR) este un fenomen interesant care ar putea oferi indicii cu privire la modul în care ar putea fi atins controlul diabetului zaharat. Datorită diferitelor abilități regenerative ale pancreasului și ficatului, mecanismul molecular responsabil de PR este în mare parte necunoscut. În această recenzie, descriem cinci modele murine reprezentative de PR și treisprezece mitogeni umorali care stimulează proliferarea celulelor β. De asemenea, descriem ontogeneza pancreatică, inclusiv diferențele transcripționale moleculare dintre celulele α și celulele β. Mai mult, analizăm 14 modele murine care prezintă defecte ale genelor legate de factorii cheie de transcripție pentru ontogeneza pancreatică pentru a obține o perspectivă suplimentară asupra dezvoltării pancreatice.
Aceasta este o previzualizare a conținutului abonamentului, conectați-vă pentru a verifica accesul.
Opțiuni de acces
Cumpărați un singur articol
Acces instant la PDF-ul complet al articolului.
Calculul impozitului va fi finalizat în timpul plății.
Abonați-vă la jurnal
Acces online imediat la toate numerele începând cu 2019. Abonamentul se va reînnoi automat anual.
Calculul impozitului va fi finalizat în timpul plății.
Referințe
Yagi H, Soto-Gutierrez A, Kitagawa Y. Reorganizarea întregului organ: o abordare a medicinei regenerative în chirurgia digestivă pentru înlocuirea organelor. Surg Today. 2013; 43: 587-94.
Takahashi K, Murata S, Ohkohchi N. Terapie nouă pentru regenerarea ficatului prin creșterea numărului de trombocite. Surg Today. 2013; 43: 1081-7.
Peng HS, Xu XH, Zhang R, He XY, Wang XX, Wang WH și colab. Dozele multiple multiple de eritropoietină întârzie proliferarea hepatocitelor, dar promovează funcția hepatică într-un model de șobolan de hepatectomie subtotală. Surg Today. 2014; 44: 1109-15.
Menge BA, Tannapfel A, Belyaev O, Drescher R, Muller C, Uhl W, și colab. Pancreatectomia parțială la omul adult nu provoacă regenerarea celulelor beta. Diabet. 2008; 57: 142-9.
Scow RO. Pancreatectomia totală la șobolan: operație, efecte și îngrijire postoperatorie. Endocrinologie. 1957; 60: 359-67.
Houry S, Huguier M. Splenopancreatectomie totală la șobolan. Raportul tehnic. Eur Surg Res. 1983; 15: 328-31.
Migliorini RH. Procedură în două etape pentru pancreatectomia totală la șobolan. Diabet. 1970; 19: 694-7.
Wenger JM, Meyer P, Morel DR, Costabella PM, Rohner A. Splenopancreatectomie radicală cu conservare a buclei duodenale la șobolani. J Surg Res. 1990; 49: 361-5.
Richards C, Fitzgerald PJ, Carol B, Rosenstock L, Lipkin L. Diviziunea segmentară a pancreasului de șobolan pentru proceduri experimentale. Laboratorul Invest. 1964; 13: 1303-21.
Pearson KW, Scott D, Torrance B. Efectele pancreatectomiei parțiale chirurgicale la șobolani. I. Regenerarea pancreatică. Gastroenterologie. 1977; 72: 469–73.
Cavelti-Weder C, Shtessel M, Reuss JE, Jermendy A, Yamada T, Caballero F și colab. Ligarea canalului pancreatic după pierderea aproape completă a celulelor beta: regenerare exocrină, dar nu există dovezi ale regenerării celulelor beta. Endocrinologie. 2013; 154: 4493-502.
Xu X, D’Hoker J, Stange G, Bonne S, De Leu N, Xiao X și colab. Celulele beta pot fi generate de progenitori endogeni în pancreasul șoarece adult rănit. Celulă. 2008; 132: 197–207.
Inada A, Nienaber C, Katsuta H, Fujitani Y, Levine J, Morita R, și colab. Celulele pancreatice pozitive anhidrază carbonică II sunt progenitori atât pentru pancreasul endocrin cât și pentru cel exocrin după naștere. Proc Natl Acad Sci. 2008; 105: 19915-9.
Pan FC, Bankaitis ED, Boyer D, Xu X, Van de Casteele M, Magnuson MA, și colab. Modele spațiotemporale de multipotențialitate în celulele care exprimă Ptf1a în timpul organogenezei pancreasului și a restaurării facultative induse de leziuni. Dezvoltare. 2013; 140: 751-64.
Shing Y, Christofori G, Hanahan D, Ono Y, Sasada R, Igarashi K, și colab. Betacelulină: un mitogen din tumorile celulelor beta pancreatice. Ştiinţă. 1993; 259: 1604-7.
Yamamoto K, Miyagawa J, Waguri M, Sasada R, Igarashi K, Li M, și colab. Betacelulina umană recombinantă promovează neogeneza celulelor beta și ameliorează intoleranța la glucoză la șoareci cu diabet indus de perfuzie selectivă de aloxan. Diabet. 2000; 49: 2021–7.
Cras-Meneur C, Elghazi L, Czernichow P, Scharfmann R. Factorul de creștere epidermică crește celulele embrionare pancreatice nediferențiate in vitro: un echilibru între proliferare și diferențiere. Diabet. 2001; 50: 1571-9.
Song SY, Gannon M, Washington MK, Scoggins CR, Meszoely IM, Goldenring JR și colab. Extinderea epiteliului pancreatic care exprimă Pdx1 și neogeneza insulelor la șoareci transgenici care supraexprimă factorul de creștere alfa transformator. Gastroenterologie. 1999; 117: 1416–26.
Krakowski ML, Kritzik MR, Jones EM, Krahl T, Lee J, Arnush M, și colab. Expresia transgenică a factorului de creștere epidermică și a factorului de creștere a cheratinocitelor în celulele beta are ca rezultat modificări morfologice substanțiale. J Endocrinol. 1999; 162: 167-75.
Alvarez-Perez JC, Ernst S, Demirci C, Casinelli GP, Mellado-Gil JM, Rausell-Palamos F și colab. Semnalizarea factorului de creștere a hepatocitelor/c-Met este necesară pentru regenerarea celulelor beta. Diabet. 2014; 63: 216-23.
Xu G, Stoffers DA, Habener JF, Bonner-Weir S. Exendin-4 stimulează atât replicarea celulelor beta, cât și neogeneza, rezultând o creștere a masei celule beta și o toleranță îmbunătățită la glucoză la șobolanii diabetici. Diabet. 1999; 48: 2270-6.
Greig NH, Holloway HW, De Ore KA, Jani D, Wang Y, Zhou J, și colab. O dată pe zi, injecția cu exendin-4 la șoareci diabetici obține efecte benefice pe termen lung asupra concentrațiilor de glucoză din sânge. Diabetologie. 1999; 42: 45-50.
DJ Drucker. Acțiunea incretinei în pancreas: promisiuni potențiale, pericole posibile și capcane patologice. Diabet. 2013; 62: 3316–23.
Garber AJ. Agoniști ai receptorilor peptidului 1 cu acțiune îndelungată de tip glucagon: o revizuire a eficacității și tolerabilității acestora. Îngrijirea diabetului. 2011; 34 (Supliment 2): S279-84.
Rooman I, Lardon J, Bouwens L. Gastrin stimulează neogeneza celulelor beta și crește masa insulelor din țesutul pancreatic exocrin normal, dar nu din cel normal. Diabet. 2002; 51: 686-90.
Suarez-Pinzon WL, Power RF, Yan Y, Wasserfall C, Atkinson M, Rabinovitch A. Terapia combinată cu peptida-1 asemănătoare glucagonului și gastrina restabilește normoglicemia la șoarecii diabetici NOD. Diabet. 2008; 57: 3281-8.
Pittenger GL, Vinik AI, Rosenberg L. Izolarea parțială și caracterizarea ilotropinei, un nou factor de creștere specific insulelor. Adv Exp Med Biol. 1992; 321: 123-130 (discuție 131-122).
Dungan KM, Buse JB, Ratner RE. Efectele terapiei în diabetul zaharat de tip 1 și tip 2 cu o peptidă derivată din proteina asociată neogenezei insulelor (INGAP). Diabet Metab Res Rev. 2009; 25: 558-65.
Shah KA, Patel MB, Patel RJ, Parmar PK. Mangifera indica (mango). Pharmacogn Rev. 2010; 4: 42-8.
Tyutyulkova N, Tuneva S, Gorantcheva U, Tanev G, Zhivkov V, Chelibonova-Lorer H, și colab. Efectul hepatoprotector al silimarinei (carsil) asupra ficatului șobolanilor tratați cu D-galactozamină. Investigații biochimice și morfologice. Metode Găsiți Exp Clin Pharmacol. 1981; 3: 71-7.
Vargas-Mendoza N, Madrigal-Santillan E, Morales-Gonzalez A, Esquivel-Soto J, Esquivel-Chirino C, Garcia-Luna YG-RM, și colab. Efectul hepatoprotector al silimarinei. World J Hepatol. 2014; 6: 144-9.
Soto C, Raya L, Perez J, Gonzalez I, Perez S. Silimarina induce expresia factorului de transcripție pancreatică Nkx6.1 și neogeneza celulelor beta într-un model de pancreatectomie. Molecule. 2014; 19: 4654-68.
Quagliarini F, Wang Y, Kozlitina J, Grishin NV, Hyde R, Boerwinkle E, și colab. Proteină asemănătoare angiopoietinei care reglează ANGPTL3. Proc Natl Acad Sci. 2012; 109: 19751–6.
Yi P, Park JS, Melton DA. Betatrofină: un hormon care controlează proliferarea celulelor beta pancreatice. Celulă. 2013; 153: 747-58.
Wang Y, Quagliarini F, Gusarova V, Gromada J, Valenzuela DM, Cohen JC și colab. Șoarecii lipsiți de ANGPTL8 (betatrofină) manifestă perturbarea metabolismului trigliceridelor fără o homeostazie a glucozei afectată. Proc Natl Acad Sci. 2013; 110: 16109-14.
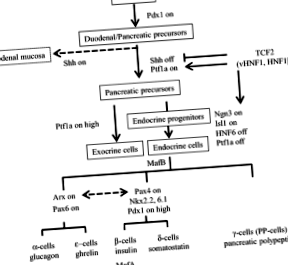
Guney MA, Gannon M. Soarta celulei pancreasului. Defecte congenitale Res C embrion astăzi. 2009; 87: 232-48.
Kim SK, Hebrok M, Melton DA. Notocordul pentru semnalizarea endodermului este necesar pentru dezvoltarea pancreasului. Dezvoltare. 1997; 124: 4243-52.
Hebrok M, Kim SK, Melton DA. Represia notocordică a ariciului sonic endodermic permite dezvoltarea pancreasului. Gene Dev. 1998; 12: 1705-13.
Gradwohl G, Dierich A, LeMeur M, Guillemot F. neurogenin3 este necesară pentru dezvoltarea celor patru linii de celule endocrine ale pancreasului. Proc Natl Acad Sci. 2000; 97: 1607–11.
Haumaitre C, Barbacci E, Jenny M, Ott MO, Gradwohl G, Cereghini S. Lipsa TCF2/vHNF1 la șoareci duce la agenezie pancreasică. Proc Natl Acad Sci. 2005; 102: 1490–5.
Artner I, Blanchi B, Raum JC, Guo M, Kaneko T, Cordes S și colab. MafB este necesar pentru maturarea celulelor beta ale insulelor. Proc Natl Acad Sci. 2007; 104: 3853-8.
Slack JM. Biologia dezvoltării pancreasului. Dezvoltare. 1995; 121: 1569–80.
Jonsson J, Carlsson L, Edlund T, Edlund H. Factorul promotor de insulină 1 este necesar pentru dezvoltarea pancreasului la șoareci. Natură. 1994; 371: 606-9.
Dutta S, Bonner-Weir S, Montminy M, Wright C. Factor de reglementare legat de diabetul cu debut tardiv? Natură. 1998; 392: 560.
Rose SD, Swift GH, Peyton MJ, Hammer RE, MacDonald RJ. Rolul PTF1-P48 în expresia genei acinar pancreatice. J Biol Chem. 2001; 276: 44018-26.
Kawaguchi Y, Cooper B, Gannon M, Ray M, MacDonald RJ, Wright CV. Rolul regulatorului transcripțional Ptf1a în conversia progenitorilor intestinali în pancreatici. Nat Genet. 2002; 32: 128-34.
Krapp A, Knofler M, Ledermann B, Burki K, Berney C, Zoerkler N și colab. Proteina bHLH PTF1-p48 este esențială pentru formarea exocrinului și organizarea spațială corectă a pancreasului endocrin. Gene Dev. 1998; 12: 3752–63.
Chuang PT, TB Kornberg. Pe gama de semnalizare arici. Curr Opin Genet Dev. 2000; 10: 515-22.
Ramalho-Santos M, Melton DA, McMahon AP. Semnalele arici reglează multiple aspecte ale dezvoltării gastrointestinale. Dezvoltare. 2000; 127: 2763-72.
van Tuyl M, Groenman F, Wang J, Kuliszewski M, Liu J, Tibboel D, și colab. Factorii angiogenici stimulează morfogeneza ramificării tubulare a plămânilor cu deficit de arici sonic. Dev Biol. 2007; 303: 514-26.
Hebrok M, Kim SK, St Jacques B, McMahon AP, Melton DA. Reglarea dezvoltării pancreasului prin semnalizare arici. Dezvoltare. 2000; 127: 4905-13.
Horikawa Y, Iwasaki N, Hara M, Furuta H, Hinokio Y, Cockburn BN, și colab. Mutație în gena beta factor hepatocitar-1 beta (TCF2) asociată cu MODY. Nat Genet. 1997; 17: 384–5.
Ravassard P, Chatail F, Mallet J, Icard-Liepkalns C. Relax, un regulator transcripțional bHLH de șobolan nou exprimat tranzitoriu în zona de proliferare ventriculară a sistemului nervos central în curs de dezvoltare. J Neurosci Res. 1997; 48: 146–58.
Naya FJ, Huang HP, Qiu Y, Mutoh H, DeMayo FJ, Leiter AB și colab. Diabet, morfogeneză pancreatică defectă și diferențiere enteroendocrină anormală la șoareci cu deficit de BETA2/neuroD. Gene Dev. 1997; 11: 2323–34.
Stoffers DA, Zinkin NT, Stanojevic V, Clarke WL, Habener JF. Agenezie pancreatică atribuibilă unei deleții de nucleotide unice în secvența codificatoare a genei IPF1 umane. Nat Genet. 1997; 15: 106-10.
Balderes DA, Magnuson MA, Sussel L. Nkx2.2: Cre knock-in mouse line: un instrument nou pentru eliminarea genelor specifice pancreasului și SNC. Geneză. 2013; 51: 844-51.
Sussel L, Kalamaras J, Hartigan-O’Connor DJ, Meneses JJ, Pedersen RA, Rubenstein JL și colab. Șoarecii lipsiți de factorul de transcripție homeodominiu Nkx2.2 au diabet datorită diferențierii arestate a celulelor beta pancreatice. Dezvoltare. 1998; 125: 2213-21.
Dahl E, Koseki H, Balling R. Pax gene și organogeneză. Bioessays. 1997; 19: 755-65.
Sosa-Pineda B, Chowdhury K, Torres M, Oliver G, Gruss P. Gena Pax4 este esențială pentru diferențierea celulelor beta producătoare de insulină în pancreasul mamiferelor. Natură. 1997; 386: 399-402.
Mai CL. Rolul Insulei-1 în pancreasul endocrin: Lecții de la șoareci cu insuficiență specifică Insulei-1 pentru pancreas. Insulele. 2010; 2: 121-3.
Pfaff SL, Mendelsohn M, Stewart CL, Edlund T, Jessell ™. Cerința pentru gena homeoboxă LIM Isl1 în generarea neuronilor motori relevă o etapă dependentă de neuronul motor în diferențierea interneuronică. Celulă. 1996; 84: 309-20.
Ahlgren U, Pfaff SL, JessellTM, Edlund T, Edlund H. Cerință independentă pentru ISL1 în formarea mezenchimului pancreatic și a celulelor insulelor. Natură. 1997; 385: 257-60.
Lemaigre FP, Durviaux SM, Truong O, Lannoy VJ, Hsuan JJ, Rousseau GG. Factorul nuclear 6 al hepatocitelor, un factor de transcripție care conține un nou tip de homeodominiu și un singur domeniu tăiat. Proc Natl Acad Sci. 1996; 93: 9460-4.
Jacquemin P, Durviaux SM, Jensen J, Godfraind C, Gradwohl G, Guillemot F și colab. Factorul nuclear al factorului de transcripție hepatocit 6 reglează diferențierea celulelor endocrine pancreatice și controlează expresia genei proendocrine ngn3. Mol Cell Biol. 2000; 20: 4445-54.
Blanchi B, Kelly LM, Viemari JC, Lafon I, Burnet H, Bevengut M, și colab. Deficitul de MafB cauzează ritmogeneză respiratorie defectă și apnee centrală fatală la naștere. Nat Neurosci. 2003; 6: 1091-100.
Sosa-Pineda B. Gena Pax4 este un regulator esențial al dezvoltării celulelor beta pancreatice. Mol Cells. 2004; 18: 289-94.
Kordowich S, Collombat P, Mansouri A, Serup P. Arx și deficitul de compus Nkx2.2 redirecționează diferențierea celulelor alfa și beta pancreatice către o linie de celule co-exprimând somatostatină/grelină. BMC Dev Biol. 2011; 11:52.
Collombat P, Hecksher-Sorensen J, Broccoli V, Krull J, Ponte I, Mundiger T și colab. Pierderea simultană a genelor Arx și Pax4 promovează o specificație a destinului celulei producătoare de somatostatină în detrimentul liniilor celulare alfa și beta din pancreasul endocrin al șoarecelui. Dezvoltare. 2005; 132: 2969-80.
Preț M, Lazzaro D, Pohl T, Mattei MG, Ruther U, Olivo JC și colab. Expresia regională a genei homeobox Nkx-2.2 în creierul anterior al mamiferelor în curs de dezvoltare. Neuron. 1992; 8: 241-55.
Sander M, Sussel L, Conners J, Scheel D, Kalamaras J, Dela Cruz F și colab. Gena Homeobox Nkx6.1 se află în aval de Nkx2.2 în calea principală de formare a celulelor beta în pancreas. Dezvoltare. 2000; 127: 5533–40.
Henseleit KD, Nelson SB, Kuhlbrodt K, Hennings JC, Ericson J, Sander M. Activitatea factorului de transcripție NKX6 este necesară pentru dezvoltarea celulelor alfa și beta în pancreas. Dezvoltare. 2005; 132: 3139–49.
Simpson TI, DJ Price. Pax6; un jucător pleiotrop în dezvoltare. BioEssays. 2002; 24: 1041-51.
St-Onge L, Sosa-Pineda B, Chowdhury K, Mansouri A, Gruss P. Pax6 este necesară pentru diferențierea celulelor alfa producătoare de glucagon în pancreasul de șoarece. Natură. 1997; 387: 406-9.
Vanderford NL. Reglarea expresiei MafA specifice celulelor beta și dependente de glucoză. Insulele. 2011; 3: 35-7.
Zhang C, Moriguchi T, Kajihara M, Esaki R, Harada A, Shimohata H, și colab. MafA este un regulator cheie al secreției de insulină stimulată de glucoză. Mol Cell Biol. 2005; 25: 4969-76.
Mulțumiri
O parte din acest studiu a fost susținută de un grant în ajutor pentru cercetare științifică de la Ministerul Educației, Culturii, Sportului, Științei și Tehnologiei (nr. 24659592) către T. Mizuguchi, T. Torigoe, N. Sato și K .Hirata. O parte a acestui studiu a fost, de asemenea, susținută de o subvenție de cercetare în domeniul științei muncii, acordată de Ministerul Sănătății, Muncii și Bunăstării (nr. 2601023) către T. Mizuguchi, T. Torigoe, K. Hirata și N. Sato.
Informatia autorului
Afilieri
Departamentul de Chirurgie, Oncologie Chirurgicală, Universitatea de Medicină Sapporo, Sapporo, Hokkaido, 060-8543, Japonia
Kenji Okita, Toru Mizuguchi, Ota Shigenori, Masayuki Ishii, Toshihiko Nishidate, Tomomi Ueki, Makoto Meguro și Yasutoshi Kimura
Departamentul de Patologie I, Universitatea de Medicină Sapporo, Sapporo, Hokkaido, 060-8556, Japonia
Toshihiko Torigoe și Noriyuki Sato
Departamentul de Dezvoltare și Regenerare a Țesuturilor, Institutul de Cercetare pentru Medicina de Frontieră, Universitatea de Medicină Sapporo, Sapporo, Hokkaido, 060-8556, Japonia
Naoki Tanimizu, Norihisa Ichinohe și Toshihiro Mitaka
Departamentul de Științe Celulare, Institutul de Cercetare pentru Medicina de Frontieră, Universitatea de Medicină Sapporo, Sapporo, Hokkaido, 060-8556, Japonia
Departamentul de Patologie Chirurgicală II, Universitatea de Medicină Sapporo, Sapporo, Hokkaido, 060-8556, Japonia
Departamentul de Chirurgie, Spitalul JR Sapporo, N-3, E-1, Chuo-Ku, Sapporo, Hokkaido, 060-0033, Japonia
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
- Cu privire la reglarea patului vascular terminal în obezitate și diabet SpringerLink
- Analiza transcriptomică cu o singură celulă a insulelor pancreatice în sănătatea și diabetul de tip 2 SpringerLink
- Nivelurile serice ale enzimelor pancreatice la subiecții slabi și obezi SpringerLink
- Flegmon pancreatic SpringerLink
- Cercetările obezității sarcopenice avansează în patogeneză și în criteriile de diagnostic SpringerLink