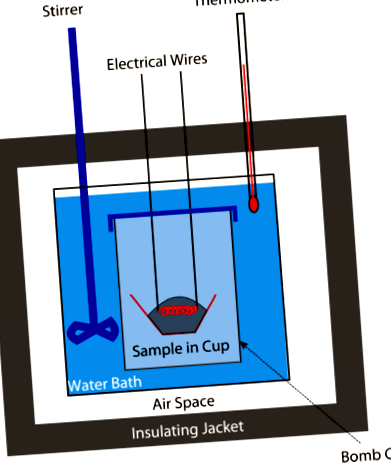
Câte calorii sunt în mâncarea ta?
La un moment dat, caloriile din alimente au fost măsurate cu un calorimetru bombă (a se vedea figura de mai sus). O cantitate cântărită de alimente ar fi plasată în calorimetru și sistemul a fost apoi sigilat și umplut cu oxigen. O scânteie electrică a aprins amestecul alimentar-oxigen. Cantitatea de căldură degajată atunci când alimentele arse ar da o idee despre caloriile alimentare prezente. Astăzi, caloriile sunt calculate din conținutul de proteine, carbohidrați și grăsimi din alimente (toate sunt determinate de analize chimice). Nu mai sunt necesare bombe.
Calorimetre
Calorimetre este măsurarea transferului de căldură în sau în afara unui sistem în timpul unei reacții chimice sau a unui proces fizic. A calorimetru este un recipient izolat care este utilizat pentru măsurarea schimbărilor de căldură. Majoritatea reacțiilor care pot fi analizate într-un experiment de calorimetrie sunt fie lichide, fie soluții apoase. Un calorimetru folosit frecvent și ieftin este un set de cupe din spumă imbricate prevăzute cu un capac pentru a limita schimbul de căldură între lichidul din cupă și aerul din împrejurimi (vezi Figura de mai jos). Într-un experiment tipic de calorimetrie, volumele specifice de reactanți sunt distribuite în recipiente separate și temperatura fiecăruia este măsurată. Acestea sunt apoi amestecate în calorimetru, care începe reacția. Amestecul reactant este agitat până când reacția este completă, în timp ce temperatura reacției este monitorizată continuu.
Figura 17.6
Un calorimetru simplu cu presiune constantă.
Cheia tuturor experimentelor de calorimetrie este presupunerea că nu există un schimb de căldură între calorimetrul izolat și cameră. Luați în considerare cazul unei reacții care are loc între reactanții apoși. Apa în care solidele au fost dizolvate este împrejurimile, în timp ce substanțele dizolvate sunt sistemul. Schimbarea de temperatură măsurată este schimbarea de temperatură care se produce în împrejurimi. Dacă temperatura apei crește pe măsură ce apare reacția, reacția este exotermă. Căldura a fost eliberată de sistem în apa din jur. O reacție endotermă absoarbe căldura din împrejurimi, astfel încât temperatura apei scade pe măsură ce căldura părăsește mediul înconjurător pentru a intra în sistem.
Schimbarea temperaturii apei este măsurată în experiment și căldura specifică a apei poate fi utilizată pentru a calcula căldura absorbită de împrejurimi .
În ecuație, este masa apei, este căldura specifică a apei și este. Căldura absorbită de împrejurimi este egală, dar opusă în semn, cu căldura eliberată de sistem. Deoarece schimbarea de căldură este determinată la presiune constantă, căldura eliberată de sistem este egală cu schimbarea de entalpie .
Semnul lui este pozitiv pentru o reacție endotermă și negativ pentru o reacție exotermă.
Eșantion de problemă: Calorimetrie și modificări ale entalpiei
Într-un experiment, s-au adăugat 25,0 ml de HCI 1,00 M la 25,0 ° C la 25,0 ml de NaOH 1,00 M la 25,0 ° C într-un calorimetru cu cupă de spumă. Se produce o reacție și temperatura crește la 32,0 ° C. Calculați modificarea entalpiei în kJ pentru această reacție. Să presupunem că densitățile soluțiilor sunt de 1,00 g/ml și că căldura lor specifică este aceeași cu cea a apei.
Pasul 1: enumerați cantitățile cunoscute și planificați problema .
- Densitate = 1,00 g/ml
Volumul și densitatea pot fi utilizate pentru a găsi masa soluției după amestecare. Apoi calculați modificarea entalpiei utilizând .
Pasul 3: Gândiți-vă la rezultat .
Modificarea entalpiei este negativă deoarece reacția eliberează căldură în împrejurimi, rezultând o creștere a temperaturii apei.
rezumat
- Este descris procesul de calorimetrie.
- Sunt ilustrate calculele care implică modificări ale entalpiei.
Practică
Rezolvați problemele la linkul de mai jos:
Revizuire
- Ce fel de reacții sunt de obicei analizate într-un calorimetru?
- Ce este un calorimetru cu presiune constantă?
- De ce se folosesc cupele de spumă într-un calorimetru?
- Chimia alimentară - Pâinea coaptă are aceeași cantitate de calorii ca și ingredientele sale Chimia
- Ghid de studiu chimic -5
- Selectarea alimentelor de către căprioarele europene (Capreolus capreolus) efectele chimiei plantelor și
- Reactivi excesivi și limitativi - chimie LibreTexts
- Teoria generală a separării - chimie LibreTexts