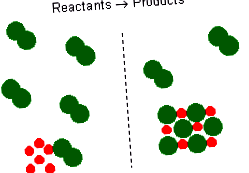
- Amestec stoichiometric
- Excesul de reactiv
- Reactiv limitativ
Abilități de dezvoltat
- Folosiți calculul stoichiometric pentru a determina reactivii excesivi și limitativi într-o reacție chimică și explicați de ce.
- Calculați randamentele teoretice ale produselor formate în reacții care implică reactivi limitativi.
Ecuațiile reacției chimice oferă relația stoichiometrică ideală între reactanți și produse. Cu toate acestea, reactanții pentru o reacție dintr-un experiment nu sunt neapărat un amestec stoichiometric. Într-o reacție chimică, se apelează reactanții care nu sunt epuizați când reacția este terminată exces de reactivi. Reactivul care este complet epuizat sau reacționat se numește reactiv limitativ, deoarece cantitatea sa limitează cantitatea de produse formate.
Să luăm în considerare reacția dintre sodiu solid și gaz clor. Reacția poate fi reprezentată de ecuația:
Reprezintă o reacție a unui metal și a unui gaz clor diatomic. Această ecuație de reacție echilibrată indică faptul că doi \ (\ ce \) atomi ar reacționa cu doi \ (\ ce \) atomi sau o moleculă \ (\ ce \). Astfel, dacă aveți 6 atomi \ (\ ce \), vor fi necesare 3 \ (\ ce \) molecule. Dacă există un număr excesiv de molecule \ (\ ce \), acestea vor rămâne nereacționate. De asemenea, putem afirma că 6 moli de sodiu vor necesita 3 moli de gaz \ (\ ce \). Dacă există mai mult de 3 moli de gaz \ (\ ce \), unii vor rămâne ca exces de reactiv, iar sodiul este un reactiv limitativ. Limită cantitatea de produs care poate fi formată.
Reacțiile chimice cu cantități stoichiometrice de reactanți au Nu reactivi limitativi sau în exces.
Calculați numărul de moli de \ (\ ce \) formați în arderea etanului \ (\ ce \) într-un proces când se consumă 35,0 moli de \ (\ ce \).
ALUZIE
Reacția este
DISCUŢIE
O ecuație echilibrată pentru reacție este o cerință de bază pentru identificarea reactivului limitativ, chiar dacă sunt cunoscute cantități de reactanți.
Două moli de \ (\ ce \) și cinci moli de \ (\ ce \) sunt plasate într-un vas de reacție, iar apoi \ (\ ce \) se aprinde conform reacției
Identificați reactivul limitativ în acest experiment.
ALUZIE
Înainte de identificarea unui reactiv limitativ, reacția trebuie echilibrată. Reacția echilibrată este
Astfel, doi moli de \ (\ ce \) necesită doar UN MOL de \ (\ ce \). Patru moli de oxigen vor rămâne nereacționați. Prin urmare, oxigenul este reactivul în exces și \ (\ ce \) este reactivul limitativ.
DISCUŢIE
Raspunde la aceste intrebari:
Câți moli de \ (\ ce \) sunt formați?
Care este greutatea formatului \ (\ ce \)?
Probleme de dezvoltare a abilităților
- La temperatura camerei (25 ° C) care este starea sodiului: solid, gazos sau lichid?
Indicație: Sodiu metalic
- Greutăți egale de \ (\ ce
\) și \ (\ ce \) sunt plasate într-un balon și apoi aprinse. Presupunând că reacția se finalizează, care gaz este reactivul în exces?
Indicație: oxid de fier
Discuţie -
Un amestec stoichiometric are un raport de masă de 54: 160 (aproape 1: 3) pentru \ (\ ce \).
Colaboratori și atribuții
Chung (Peter) Chieh (profesor emerit, chimie @ Universitatea din Waterloo)
- Excesul de greutate legat de alte opt tipuri de cancer Limitarea creșterii în greutate poate ajuta la reducerea riscului de apariție
- Teoria generală a separării - chimie LibreTexts
- Energia în 100 m Sprint - ChemTime LibreTexts
- Zborul în Brazilia, în cazul în care excesul de bagaje nu costă suplimentar
- Chimia alimentară - Pâinea coaptă are aceeași cantitate de calorii ca și ingredientele sale Chimia