Fliza Valiullina
1 OpenLab de Neurobiologie, Universitatea Federală din Kazan, Kazan, Rusia
Yulia Zakharova
1 OpenLab de Neurobiologie, Universitatea Federală din Kazan, Kazan, Rusia
Marat Mukhtarov
1 OpenLab de Neurobiologie, Universitatea Federală din Kazan, Kazan, Rusia
Andreas Draguhn
2 Departamentul de Fiziologie și Fiziopatologie, Universitatea din Heidelberg, Heidelberg, Germania
Unghii Burnashev
3 INMED, Institutul de Neurobiologie al Mediteranei UMR901, Universitatea Aix-Marseille, Marsilia, Franța
4 INSERM U901, Marsilia, Franța
Andrei Rozov
1 OpenLab de Neurobiologie, Universitatea Federală din Kazan, Kazan, Rusia
2 Departamentul de Fiziologie și Fiziopatologie, Universitatea din Heidelberg, Heidelberg, Germania
Abstract
Introducere
Raportăm că manipularea capacității de tampon Ca 2+ a neuronilor piramidali hipocampici CA1 afectează puternic amplitudinea EPSP-urilor medii NMDAR unice, sub prag. Mai mult, la stimularea aferentă de înaltă frecvență, ameliorarea simultană a blocului Mg 2+ și CIIN a crescut contribuția NMDAR-urilor la EPSP-uri postsinaptice și a prelungit semnificativ timpul lor de decădere. Descoperirile noastre sugerează că fluxul de Ca 2+ indus în timpul evenimentelor sinaptice unitare este suficient pentru a produce inhibarea detectabilă a NMDAR. Activarea repetitivă a sinapselor excitative are ca rezultat o prelungire semnificativă a ferestrei de integrare pentru potențialele de acțiune evocate sinaptic (AP).
Materiale și metode
Toate protocoalele experimentale au fost realizate în conformitate cu reglementările Universității Federale Kazan privind utilizarea animalelor de laborator (aprobare etică de către Comitetul instituțional de îngrijire și utilizare a animalelor din cadrul Universității medicale de stat Kazan N9-2013) sau de către guvernul de stat din Baden-Württemberg, Germania . S-au făcut toate eforturile pentru a reduce la minimum suferința animalelor și pentru a reduce numărul animalelor utilizate.
Felii de hipocampal transversale de 250 μm au fost preparate din creierul șoarecilor în vârstă de 14-21 de zile (C57 BL/6J), uciși de luxația cervicală. Camera de feliere conținea o soluție oxigenată răcită cu gheață (modificată din Dugue și colab., 2005) compusă din (în mM): K-Gluconat, 140; Acid N- (2-hidroxietil) piperazin-N'-etansulfonic (HEPES), 10; Na-Gluconat, 15; etilen glicol-bis (2-aminoetil) -N, N, N ', acid N'-tetraacetic (EGTA), 0,2; și NaCI, 4 (pH 7,2). Feliile au fost incubate timp de 30 min la 35 ° C înainte de a fi depozitate la temperatura camerei (22-24 ° C) în CSF artificial (ACSF) conținând (în mM): NaCI, 125; NaHCO3, 25; KCI, 2,5; NaH2PO4, 1,25; MgCI2, 1; CaCI2, 2; și glucoză, 25; barbotat cu 95% O2 și 5% CO2. ACSF fără Mg 2+ a avut 0 mM MgCl2 și 0,2 mM EDTA.
Electrozii de patch-uri au fost scoși din sticlă capilară dură de borosilicat (extractor de micropipete flacără/maro Sutter Instruments). În experimentele efectuate în modul tensiune-clamp, soluția intracelulară a constat din (în mM): Cs-gluconat, 100; CsCI, 40; HEPES, 10; NaCI, 8; MgATP, 4; MgGTP, 0,3; fosfocreatină, 10 (pH 7,3 cu CsOH). În experimentele cu cleme curente, Cs + a fost substituit cu K + în soluția de pipetă.
În timpul înregistrărilor, rezistența membranei a fost monitorizată și datele din celule în care rezistența membranei a variat cu> 15% au fost eliminate din analiză. De-a lungul articolului n se referă la numărul de experimente din grup.
Pentru analiza statistică, a fost utilizat testul Mann-Whitney, iar datele sunt prezentate ca medie ± SD, dacă nu se specifică altfel.
Rezultate
Intrarea Ca 2+ în timpul răspunsurilor sinaptice unitare sub-prag este suficientă pentru a declanșa CIIN
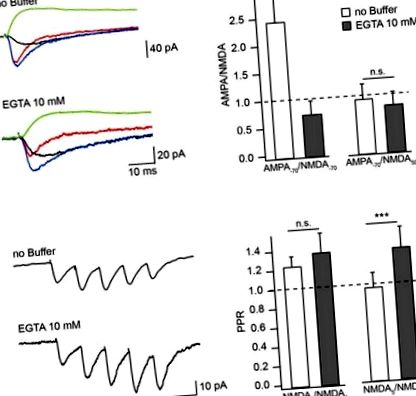
Efectul tampoanelor Ca 2+ asupra amplitudinii EPSC mediată de NMDAR în soluția extracelulară fără Mg 2+. (A) Compusul evocat mediu EPSC (albastru), aEPSC (roșu), nEPSC (negru) la -70 mV și nEPSC (verde) la 50 mV înregistrat cu soluții intracelulare fără tampon și conținând EGTA. Histogramele cu bare compară efectul încărcării tamponului asupra raporturilor de amplitudine ale aEPSC-urilor măsurate la -70 mV la nEPSC-uri măsurate la -70 mV (stânga) și 50 mV (dreapta). (B) Trenuri medii de EPSC mediate de NMDAR înregistrate cu soluții fără EGTA și conținând EGTA. Histogramele cu bare arată efectul încărcării EGTA asupra raporturilor de amplitudine (PPR) ale celui de-al doilea (stânga) și al cincilea (dreapta) nEPSC la amplitudinea primului răspuns. Asteriscurile indică o diferență semnificativă.
Pentru a testa dacă gradul CIIN poate fi crescut prin stimulare sinaptică prelungită sub prag, am măsurat și comparat raporturile de amplitudine ale celui de-al doilea (NMDA2) și al cincilea (NMDA5) nEPSCs cu primul nEPSC (NMDA1), utilizând un protocol de stimulare cu cinci impulsuri (10 Hz) în neuronii încărcați cu soluții intracelulare fără tampon sau conținând EGTA (Figura (Figura 1B). 1B). Raportul mediu NMDA2/NMDA1 a crescut ușor, dar nu semnificativ, prin încărcarea tamponului (fără EGTA: 1,23 ± 0,11, n = 6; conținând EGTA: 1,36 ± 0,21, n = 5; p = 0,662). Răspunsurile ulterioare, cu toate acestea, au fost clar îmbunătățite prin tamponarea Ca 2+: raportul NMDA5/NMDA1 a fost de 0,9 ± 0,15 în neuronii corecți cu soluție fără EGTA (n = 6) și 1,28 ± 0,21 în neuronii care conțin EGTA (n = 5; p = 0,009). Aceste date indică faptul că CIIN modifică contribuția NMDAR la răspunsurile unitare, cu un impact mai puternic asupra curenților mediați de NMDAR în timpul activității repetitive prelungite.
În prezența Mg 2+ CIIN afectează curenții mediați de NMDAR într-un mod independent de tensiune
CIIN reduce puternic amplitudinile nEPSC-urilor la potențiale negative, dar nu modifică dependența de tensiune a blocului Mg 2+. (A) Răspunsuri mediate de NMDAR evocate sinaptic (50 mV) înregistrate la -70, -35, 0, 35 și 50 mV din celule piramidale CA1 dializate cu soluții intracelulare fără tampon, EGTA sau BAPTA. (B, C) Relațiile de tensiune curente ale nEPSC-urilor s-au normalizat la amplitudini la 50 mV (B) și -70 mV (C) obținut cu soluții intracelulare fără tampon (roșu), EGTA- (negru) și conținând BAPTA (verde).
Contribuția relativă a NMDAR la răspunsurile postsinaptice este puternic controlată de CIIN
Pentru a fundamenta în continuare rolul modulator al CIIN în condiții fiziologice și pentru a estima impactul acestuia asupra amplitudinii compușilor EPSC, am comparat răspunsurile mediate de AMPAR și NMDAR măsurate la -70 și -35 mV în neuroni, cu patch-uri fără tampon și pipetă care conține tampon. soluții. La ambele potențiale de reținere, amplitudinile relative ale nEPSC-urilor înregistrate din celulele dializate cu soluție intracelulară fără tampon au fost semnificativ mai mici comparativ cu cele măsurate cu EGTA (10 mM) sau BAPTA (1 mM), după cum se indică prin rapoarte AMPA/NMDA mult mai mici (Figurile 3A, B).
Efectul CIIN asupra contribuției NMDAR la EPSC compuse. (A) Răspunsurile mediate de AMPAR- (roșu) și NMDAR- (negru) înregistrate la -70 și -35 mV de la neuroni cu soluție de pipetă fără tampon sau conținând tampon. (B) Histogramele cu bare compară efectele încărcării EGTA sau BAPTA asupra raporturilor AMPA/NMDA obținute la −70 (stânga) și −35 mV (dreapta). (C) IV ponderate ale aEPSC-urilor sinaptice (cercuri) și nEPSC-urilor (triunghiuri) măsurate din neuroni dializați cu soluții intracelulare fără tampon (roșu), EGTA- (negru) sau BAPTA-care conțin (albastru). (D) Dependența de tensiune a contribuției relative NMDAR la EPSC sinaptic în prezența sau absența bufferelor Ca 2+. Etichetarea este la fel ca pe (C). Asteriscurile indică o diferență semnificativă.
Pentru a evalua efectul CIIN asupra contribuției relative a NMDAR la răspunsul compus, am reconstituit curbele sinaptice ponderate ale aEPSC și nEPSC înregistrate cu soluții fără tampon și soluții care conțin tampon. Ambele răspunsuri mediate de AMPAR și NMDAR au fost normalizate la amplitudinea medie aEPSC măsurată la -70 mV (Figura (Figura 3C). 3C). Așa cum era de așteptat, amplitudinile aEPSC nu depindeau de conținutul tampon intracelular și IV-urile aEPCS erau aproape liniare. Cu toate acestea, greutatea contribuției NMDAR la compușii EPSC a depins puternic de prezența tampoanelor Ca2+. În celulele dializate cu soluție fără tampon la -70 mV, contribuția nEPSC a fost de 6 ± 1% din răspunsul compus. Impactul NMDAR-urilor a crescut la -35 mV (24 ± 8%), dar a fost încă semnificativ mai mic decât cel al AMPAR (n = 8; p Figura3D). 3D). În neuronii încărcați cu tampoane, contribuția canalelor NMDAR a fost puternic îmbunătățită la -70 mV (10 mM EGTA: 18 ± 6%, n = 6; 1 mM BAPTA 21 ± 4%, n = 5), în plus, la -35 Amplitudinile nEPSC ponderate în mV au fost semnificativ mai mari decât aEPSC (59 ± 10% și 56 ± 5%, p 0,05; Figura Figura 4A). 4A). Cu toate acestea, în neuronii încărcați cu BAPTA, activarea NMDAR-urilor sinaptice a avut un efect drastic asupra decăderii EPSP. La 50 Hz, valorile tau au fost, în control 74 ± 23, și au scăzut la 36 ± 14 ms în prezența APV (n = 5; p = 0,008; Figura Figura 4B). 4B). La 20 Hz, accelerația constantelor de dezintegrare EPSP de către APV a fost încă semnificativă (58,4 ± 21 vs. 34 ± 12 ms; p = 0,029), în timp ce la 10 Hz, blocul NMDAR-urilor nu a provocat o reducere semnificativă a tau (51 ± 9,2 vs. 36,1 ± 6,24 ms; p = 0,2). Rețineți că constantele de timp măsurate în prezența APV au fost foarte asemănătoare cu cele din neuronii corecți cu soluții fără tampon și conținând BAPTA.
CIIN accelerează semnificativ decăderea EPSP și scurtează intervalul de timp pentru generarea potențialului de acțiune (AP). (A) EPSP-urile evocate de 10, 20 și 50 Hz se antrenează în celule patch-uri cu soluție intracelulară fără tampon în prezența (negru) și absența (roșu) de 50 μM APV. Graficul arată efectul blocării NMDAR asupra constantei de timp de decădere a ultimului răspuns la diferite frecvențe de stimulare. (B) La fel ca în (A), obținut din neuronii încărcați cu 1 mM BAPTA. (C) AP evocate sinaptic înregistrate cu soluții de pipetă fără tampon (negru) și conținând BAPTA (roșu). Graficul reprezintă dependența întârzierilor AP (latențe) de conținutul tamponului celular.
În conformitate cu prelungirea decăderii EPSP, întârzierile AP (latența), măsurate ca intervalul dintre cel de-al treilea artefact stimul și vârful AP, au fost semnificativ mai lungi în neuronii încărcați cu BAPTA. Figura Figura 4C 4C prezintă urmele suprapuse înregistrate de la neuroni înregistrați cu soluții de pipetă fără tampon (negru) și conținând BAPTA (roșu). Graficele de probabilitate cumulată (dreapta) arată schimbarea către întârzieri AP mai lungi în prezența BAPTA (date grupate de la cinci celule din fiecare grup; p 2+, care conferă NMDAR-urilor un rol central atât în plasticitatea sinaptică, cât și în supraviețuirea neuronală în condiții fiziologice și moarte neuronală în condiții patologice excitotoxice (Paoletti și colab., 2013).
Consecințele funcționale ale modulației NMDAR-urilor de către diverse molecule de semnalizare și cascade biochimice în condiții fiziologice au fost studiate pe larg în ultimele două decenii. Cu toate acestea, rolul funcțional al CIIN rămâne slab înțeles.
CIIN ca mecanism de autoreglare a NMDAR în condiții fiziologice
Fenomenul inhibării induse de Ca 2+ a NMDAR-urilor a fost bine documentat și explorat la nivelul mecanismelor moleculare intracelulare (Legendre și colab., 1993; Medina și colab., 1994; Rosenmund și colab., 1995; Ehlers și colab., 1996; Wang și Wang, 2012; Paoletti și colab., 2013; Bajaj și colab., 2014; Yang și colab., 2014). Cu toate acestea, a rămas deschisă o întrebare importantă, și anume dacă intrarea Ca 2+ asociată cu evenimente sinaptice mediate de NMDAR unic în condiții fiziologice este suficientă pentru autoinhibarea răspunsurilor mediate de NMDAR. Cu alte cuvinte, funcționează mecanismele de guvernare CIIN pe scara de timp EPSC (milisecunde)?
Aceste aspecte ale CIIN nu au fost abordate în studiile anterioare, în care CIIN a fost declanșat fie prin intrarea cu Ca2+ prin canale de calciu cu tensiune sau prin activarea prelungită a NMDAR (Medina și colab., 1994, 1995, 1996). De asemenea, aceste studii nu au cuantificat strict magnitudinea „autoinhibiției” NMDAR, în special în condiții fiziologice. Cu toate acestea, Ehlers și colab. (1996) au furnizat dovezi convingătoare că 50 μM [Ca 2+] i în prezența calmodulinei provoacă o
Reducerea de 4 ori a probabilității de deschidere și scurtează la jumătate timpul de deschidere al canalului NMDAR.
Am constatat că intrarea Ca 2+ prin NMDAR în timpul unui eveniment sinaptic unitar poate atenua puternic amplitudinea nEPSC-urilor indicând faptul că CIIN funcționează pe o scară rapidă de timp de câteva milisecunde. Aceste date sunt în concordanță cu constatările noastre anterioare privind canalele recombinante, unde în patch-uri în afara, influxul de Ca 2+ declanșat prin activarea scurtă (1 ms) a AMPAR permeabile la Ca 2+ a fost suficient pentru a reduce amplitudinea curentă a mutant NMDAR impermeabil activat Ca 2+ (Rozov și colab., 1997). Mai mult, în concentrații fiziologice de Mg 2+, chiar și în jurul potențialului de membrană în repaus, unde puterea blocului Mg 2+ este aproape maximă, NMDAR-urile pot conduce în continuare o cantitate suficientă de Ca 2+, pentru a produce o reducere de aproape patru ori a funcției canalului . Într-adevăr, potrivit lui Kovalchuk și colab. (2000) în aceste condiții, stimularea aferentă sub prag dă naștere la detectarea [Ca 2+] i în coloanele vertebrale ale celulelor piramidale CA1, care este mediată aproape exclusiv de NMDAR. Împreună cu faptul că influxul de Ca 2+ prin NMDAR este detectabil până la cel puțin +20 până la +40 mV (Burnashev și colab., 1995; Kovalchuk și colab., 2000), acest lucru sugerează că CIIN este operativ în condiții fiziologice.
Datele noastre sugerează cu tărie că această creștere în [Ca 2+] este suficientă pentru a declanșa CIIN și debutul inhibiției este suficient de rapid pentru a modela răspunsurile post-sinaptice individuale. Această constatare este în perfectă concordanță cu datele privind magnitudinea CIIN la nivelul unui singur canal (Ehlers și colab., 1996). Astfel, oferim primele dovezi că, în condiții fiziologice, NMDAR-urile sinaptice din celulele cu capacitate tampon redusă sunt drastic auto-inhibate de influxul de Ca 2+ mediat de NMDAR.
Rolul posibil al CIIN în timpul îmbătrânirii și în tulburările neuropsihiatrice
Modificările funcției NMDAR au fost, de asemenea, implicate în dezvoltarea simptomelor psihotice în numărul bolilor neuropsihiatrice (Lakhan și colab., 2013). Odată cu aceasta, expresia tampoanelor endogene Ca 2+ se modifică în timpul îmbătrânirii și a unor tulburări neurologice (Bu și colab., 2003; Riascos și colab., 2011). Astfel, vulnerabilitatea selectivă a neuronilor colinergici ai creierului bazal la degenerescența bolii Alzheimer a fost atribuită pierderii legate de vârstă a CB din acești neuroni și o creștere a Ca 2+ intracelulară (Riascos și colab., 2011). În aceste condiții CIIN poate juca un rol compensatoriu intrinsec contracarând creșterea intracelulară a Ca 2+ prin reducerea intrării de Ca 2+ mediată de NMDAR.
Interesant este faptul că modificarea expresiei tampoanelor Ca 2+ se aliniază adesea cu modificarea funcției NMDAR. De exemplu, reducerea dependentă de vârstă a expresiei CR în celulele granulare hipocampice a coincis cu reglarea descendentă a imunoreactivității GluN1 (Gazzaley și colab., 1996). În cele din urmă, o serie de tulburări neurologice sunt asociate cu dereglarea atât a funcției NMDAR, cât și a sintezei endogene de tampon Ca 2+ (Heizmann și Braun, 1992; Paoletti și colab., 2013; Kook și colab., 2014). S-a sugerat că modificările PV în schizofrenie pot duce, în consecință, la hipofuncția NMDAR. Schizofrenia este adesea atribuibilă hipofuncției NMDAR, aceasta ar putea reflecta mai degrabă nereglementarea receptorului decât un deficit al numărului de NMDAR (Kantrowitz și Javitt, 2010; Gonzalez-Burgos și Lewis, 2012). În plus, variația concentrației extracelulare de Ca 2+ în anumite condiții poate atenua și impactul CIIN. De exemplu, măsurătorile in vivo ale concentrației extracelulare de Ca 2+ la primate în timpul convulsiilor au arătat că nivelul de Ca 2+ scade în intervalul de 100 μM (Pumain și colab., 1985). În acest caz, CIIN redus poate crește fereastra pentru integrarea sinaptică datorită prelungirii răspunsului mediat de NMDAR și poate duce la supraexcitabilitate neuronală.
În concluzie, constatările noastre sugerează că inactivarea indusă de Ca 2+ a NMDAR-urilor care operează pe scara de timp a EPSC-urilor poate contribui la reglarea fină specifică celulei a transmisiei sinaptice excitatorii în condiții normale și patologice.
Contribuțiile autorului
Studiază concepția și proiectarea: AD, NB și AR. Achiziționarea datelor: FV, YZ și AR. Analiza și interpretarea datelor: FV și AR. Analiza datelor: MM. Redactarea manuscrisului: AD, NB și AR. Revizuire critică: NB și AR.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi construite ca un potențial conflict de interese. Editorul de recenzii Dr. Cinzia Costa declară că, în ciuda faptului că este afiliată aceleiași instituții ca editorul asociat, Dr. Maria Cristina D’Adamo, procesul de revizuire a fost gestionat în mod obiectiv.
Mulțumiri
Această lucrare a fost susținută de programul de creștere competitivă a Universității Kazan, subvenția alocată pentru atribuirea statului în sfera activităților științifice, grantul RFBR (14-04-01457), Bundesministerium für Bildung und Forschung (Centrul Bernstein pentru calcul Neurosciences 01GQ1003A) și prin sprijinul proiectului A * MIDEX (nr. A * M-AAP-TR-14-02-140522-13.02-BURNASHEV-HLS) finanțat prin programul Guvernului francez „Investissements d ′ Avenir”, gestionat de către Agenția Națională de Cercetare a Franței (ANR). Îi mulțumim lui David Jappy pentru comentarii utile asupra manuscrisului.
- Proiectul Healthy Start este o intervenție randomizată, controlată, pentru a preveni supraponderalitatea în rândul normalului
- Sfaturi despre o nutriție adecvată pentru a îmbunătăți copilul; cu sistemul imunitar
- De ce acum NU este momentul să te învingi despre dietele de nuntă
- Băutura lungă finlandeză
- Sfaturi despre nutriția prânzului școlar - Vorbiți astăzi la ora 13:00 ET - Mamă roșcată