Abstract
Preeclapsia (EP) este o tulburare severă care apare în timpul sarcinii, ducând la morbiditate și mortalitate maternă și fetală. EP afectează aproximativ 3-8% din toate sarcinile. În acest studiu, am efectuat cromatografie lichidă spectrometrie de masă/spectrometrie de masă (LC-MS/MS) pentru a analiza probele de ser epuizate din cele șase proteine cele mai abundente din sarcinile normale și afectate de PE pentru a profila proteinele serice. Un total de 237 de proteine au fost identificate cu încredere cu
Introducere
Preeclampsia (PE) este o tulburare definită de hipertensiune cu debut nou și proteinurie după 20 de săptămâni de gestație care poate fi prezentă până la 4-6 săptămâni după naștere. EP afectează 3-8% din toate sarcinile și este o cauză majoră a morbidității și mortalității materne (Noris și colab., 2005). Cu toate acestea, patogeneza subiacentă a preeclampsiei rămâne necunoscută, iar dezvoltarea biomarkerilor adecvați pentru diagnosticul și prognosticul acesteia nu au fost încă dezvoltate (Jauniaux et al., 2006). PE se caracterizează, în general, după cum urmează: 1) în perioada timpurie a sarcinii, placenta eliberează mai mulți factori de creștere în circulația maternă, producând inflamații sistemice excesive ca răspuns la hipoxia ischemică și la stresul oxidativ (Borzychowski și colab., 2006). 2), disfuncția endotelială generalizată duce la simptome caracteristice materne ale preeclampsiei, cum ar fi hipertensiunea și proteinuria în perioada târzie a sarcinii (Taylor, 1997). Deși PE a fost studiat de multă vreme, în prezent nu există biomarkeri fiabili care să prevadă PE în timpul sarcinii timpurii.
Recent, multor grupuri li s-a acordat o atenție specială proteinelor serice legate de obezitate, inflamații de nivel scăzut și hipertriacilglicerolemie, care sunt simptome frecvente în PE (Smets și colab., 2006). Se consideră că diverse proteine serice contribuie la simptomele PE, cum ar fi factorul de creștere placentară (PlGF), factorul de creștere endotelial vascular (VEGF), factorul de creștere endotelial vascular solubil receptor-1 (sVEGFR-1), tirozin kinaza solubilă de tip fms -1 (sFlt-1), proteina placentară 13 (PP-13), proteina plasmatică asociată sarcinii (PAPP-A), gonadotrofina corionică umană (HCG), endoglinul solubil (sEng), alfa fetoproteina (AFP), insulină factorul de creștere-1 și proteina de legare a IGF-1 (IGFBP-1) (Muller și colab., 1996; Bersinger și Odegard, 2004; Audibert și colab., 2005; Venkatesha și colab., 2006; Baumann și colab., 2007 Spencer și colab., 2008; Teixeira și colab., 2008).
Diverse studii au arătat că nivelurile de expresie ale acestor proteine cresc sau scad în funcție de tulburare și gradul acesteia în PE (Baumann și colab., 2007). Cu toate acestea, nu este sigur dacă aceste proteine ar servi ca noi proteine marker pentru diagnosticul PE în practica clinică. Datorită acestor proteine specificități relativ scăzute pentru boală, este necesară o dezvoltare ulterioară pentru aplicarea sa de utilizare clinică.
Pentru a permite utilizarea comercială, este necesar să depășim provocări precum validarea, reproductibilitatea și specificitatea față de proteinele marker noi. În plus, analiza fluidului biologic care are o complexitate ridicată și o gamă dinamică necesită pregătiri elaborate înainte și tehnici mai sensibile (Hu și colab., 2006).
Din aceste motive, în acest studiu, am comparat sistematic proteomul seric matern la femeile cu PE și sarcina normală utilizând tehnologii proteomice bazate pe LC-MS după epuizarea proteinelor serice foarte abundente, cum ar fi albumina, imunoglobulina și transferul etc. Un total de 237 proteine serice au fost identificate cu încredere din probele de ser ale femeilor cu PE și normale de la 1% căutări ale ratei de detectare falsă (FDR). Dintre acestea, 97 de proteine având multiple peptide unice au fost reținute pentru compararea grupului. Nivelurile de expresie diferențiale ale proteinelor selectate au fost validate folosind o metodă spectrometrică de masă cantitativă, monitorizarea reacției selective (SRM) (Ji și colab., 2003) și testul imunitar legat de enzime (ELISA).
Rezultate
Exploatarea de noi biomarkeri din fluide biologice umane pune multe provocări care trebuie depășite printr-o abordare proteomică, cum ar fi gama dinamică largă în abundență și complexitate a componentelor proteinelor. În consecință, s-au făcut diverse încercări de a descoperi noi proteine biomarkere cu valori clinice (Whiteaker și colab., 2007). Aici ne-am străduit să identificăm noi proteine marker pentru PE utilizând LC-MS/MS dependent de date atât pentru identificare cât și pentru semicuantificare. Nivelul de expresie al proteinelor exprimate diferențial a fost validat în continuare prin metoda de cuantificare spectrometrică de masă, SRM și ELISA.
Am analizat probe individuale de ser de la cinci pacienți per grup în duplicat prin LC-MS/MS pentru a identifica proteinele serice (Tabelul 1). În această analiză, probele de ser colectate au fost tratate folosind o coloană de îndepărtare a afinității multiple (MARS) care conține șase anticorpi împotriva albuminei, IgG, IgA, transferină, haptoglobină și alfa-1-antitripsină (Ryu și colab., 2010). După epuizarea abundentă a proteinelor, probele de ser au fost digerate folosind o tripsină de grad de secvență pentru analiza LC-MS/MS pentru a compara proteomii serici de la femeile cu PE și cei de la femeile care suferă o sarcină normală.
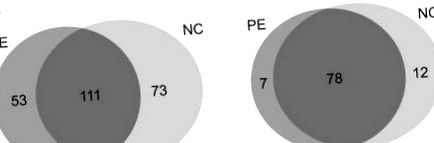
Spectrele MS/MS rezultate au fost căutate cu algoritmi SEQUEST folosind o strategie de bază de date de compoziție țintă pentru a evalua încrederea peptidei (Ballif și colab., 2005). Am achiziționat 5984 și 5744 de spectre MS/MS din grupul PE (n = 5) și respectiv din grupul normal (n = 5). Un total de 237 proteine cu 1% FDR au fost atribuite din acele spectre (Figura 1A). Am limitat setul de proteine pozitive la proteine identificate de mai multe peptide. Dintre acestea, 97 de proteine au fost potrivite cu 2 ≤ peptide unice (Figura 1B) (Tabelul 2), iar acestea au fost supuse adnotării și validării ulterioare. În consecință, am identificat 85 de proteine și 90 de proteine care formează probe de ser de PE și, respectiv, probe de ser de sarcini normale. Dintre cele 85 de proteine identificate în grupurile PE, au fost identificate 49 de proteine la toți cei cinci pacienți. Mai mult, 49 de proteine au fost identificate la toți cei cinci pacienți dintre cele 90 de proteine identificate în grupul normal.
Diagrama Venn a proteinelor identificate din ambele grupuri; (A) prezintă proteinele identificate cu un singur peptid lovit. Total de 111 proteine împărțite între grupul PE și NC. (B) reprezintă proteinele care au multiple peptide unice. Șaptezeci și opt de proteine au fost împărțite în ambele grupuri.
Dintre cele 97 de proteine identificate confidențial, 78 au fost identificate în ambele grupuri. Pentru a selecta potențialii biomarkeri specifici fiecărui grup, nivelurile relative de expresie ale proteinelor identificate au fost comparate printr-o analiză semicantitativă bazată pe numărarea spectrală (Choi și colab., 2008; Little și colab., 2010). În cele din urmă, 62 de proteine au prezentat diferențe de peste 1,2 ori în nivelurile de expresie, dintre care 27 au fost reglate în sus și 35 din care au fost reglate în jos în funcție de numărul lor spectral (Tabelul 3).
Acele proteine identificate prin procedura de profilare cu 1% FDR au fost adnotate în continuare pe baza funcției lor moleculare și a procesului biologic în conformitate cu termenii ontologiei genetice (GO) în comparație cu proteomul seric de control dobândit din proiectul proteomului plasmatic HUPO (Adamski și colab.)., 2005; Omenn și colab., 2005) folosind instrumentul de adnotare funcțională panther (Thomas și colab., 2003).
Proteinele modificate în mod specific PE au fost îmbogățite în principal în termeni ontologici genetici ale proceselor biologice de metabolism/modificare a proteinelor, iar aderența celulară a fost îmbogățită în principal în grupul normal de sarcină (Figura 2). Pentru selectarea proteinelor țintă SRM, am ales proteinele țintă pentru analiza SRM conform criteriilor după cum urmează: i) proteinele țintă ar trebui să fie modificate diferențial nivelurile de expresie comparativ cu grupul normal. ii) Funcțiile lor fiziopatologice ar trebui să fie legate de patologia EP pe baza rapoartelor anterioare. iii) Peptidele proteinelor țintă trebuie să aibă vârfuri ridicate ale semnalului SRM în modul de scanare SRM, ceea ce garantează o bună reproductibilitate analitică cu probabilitate mare.
Clusterarea funcțională a genelor, determinată de instrumentul de adnotare funcțională Panther; Am comparat proteinele serice din ambele grupuri cu 889 proteine HUPO proteom plasmatic de înaltă încredere (HPPP) proteine prin gruparea funcțională a genei la încredere de 95%. Clusterarea funcțională genică a arătat că procesele biologice asociate cu transportul, homeostazia factorului de creștere, aderența celulară și metabolismul/modificarea proteinelor au fost modificate semnificativ în comparație cu proteinele HPPP (A). În cazul funcțiilor moleculare (B), proteinele legate de aderența celulară au fost modificate în Preeclampsie.
Conform acestor criterii, am selectat patru candidați ca proteine țintă pentru SRM ulterior; glicoproteina alfa2-HS (AHSG), proteina de legare a factorului de creștere insulinoasă, subunitatea acidă labilă (IGFBP-ALS), proteina de legare a retinolului 4 (RBP4) și alfa-1-microglobulina/bikunina (AMBP). Aceste proteine țintă au fost apoi validate prin rulări SRM cu tranziții bine stabilite (secvențe peptidice, ioni precursori și ioni de produs) (Tabelul 4).
Pentru cuantificarea proteinelor, au fost comparate zonele de vârf ale tranzițiilor SRM individuale. În consecință, am putea determina nivelurile relative de expresie ale proteinelor țintă între grupul PE (n = 8) și grupul normal (n = 5). Așa cum se arată în Figura 3, nivelurile de expresie ale IGFBP-ALS, AMBP și AHSG au fost mai mari în probele de ser colectate din grupul PE. Nivelul de expresie al RBP4 în grupul PE a fost redus în comparație cu grupul normal.
Analiza LC-SRM a patru proteine candidate, RBP4, AMBP, IGFBP-ALS și AHSG; Am analizat probe de ser ale pacienților cu PE și sarcină normală. După monitorizarea peptidelor selectate, am calculat suprafețele relative de vârf ale tranzițiilor pentru proteinele țintă. Nivelurile de proteine ale AMBP, IGFBP-ALS și AHSG au fost crescute la pacienții cu PE (* P-valoare # P-valoare = 0,08).
În studiile anterioare, AHSG, care este sintetizat în ficat și secretat în fluxul sanguin, s-a dovedit a fi legat de angiogeneză și rezistența la insulină. De asemenea, s-a demonstrat că nivelurile serice de AHSG sunt crescute la pacienții cu obezitate sau diabet (Danzer și colab., 1980; Thomas și colab., 2003). Acesta este un indicator important al faptului că AHSG este implicat în calea de semnalizare a insulinei. Mai mult, se pare că crește probabilitatea de a dezvolta diabet gestațional în timpul sarcinii (Srinivas și colab., 1993; Kalabay și colab., 2002; Swallow și colab., 2004; Stefan și colab., 2006; Briana și colab., 2008) . De fapt, rezultatele noastre arată că nivelurile serice de AHSG au fost crescute în grupul PE, determinat atât de testul SRM (Figura 3), cât și de testul ELISA (Figura 4).
O creștere semnificativă a AHSG a fost observată în probele de ser cu PE utilizând un test SRM (2,5 ori, P
Discuţie
Realizările recente în proteomică au deschis un nou capitol în descoperirea biomarkerului de proteine, contribuind la diagnosticarea în practica clinică. Cu toate acestea, proteinele marker noi sunt încă rareori utilizate clinic din cauza reproductibilității și specificității lor limitate.
În acest studiu, am dezvoltat o tehnică analitică utilizând SRM bazat pe spectrometru de masă pentru cuantificarea proteinelor biomarkere în serul gravidelor cu PE severă. Rezultatele sugerează că cuantificarea bazată pe spectrometrie de masă poate fi utilă pentru identificarea și cuantificarea proteinelor exprimate diferențial în practica clinică.
Deși are limitări, este nevoie de un anticorp specific împotriva proteinelor țintă. Cu toate acestea, este nevoie de mult timp pentru a dezvolta astfel de teste; prin urmare, imunoanalizele pe bază de anticorpi au fost utilizate ca un instrument puternic în analiza cantitativă a fluidelor biologice. Mai mult, nu este posibil să se dezvolte teste ELISA pentru toate proteinele din fluidele biologice în care concentrațiile de proteine au un domeniu și o complexitate dinamică inerent de mari. Prin urmare, testele bazate pe spectrometrie de masă au fost introduse recent în acest domeniu (Aebersold și Mann, 2003).
În acest studiu, am identificat mai multe proteine ca potențiali biomarkeri diagnostici pentru PE, IGFBP-ALS, AHSG și AMBP folosind tehnologii proteomice. În studiile anterioare, unele grupuri au raportat că factorii de creștere asemănători insulinei ar putea fi corelați cu fiziopatologia PE datorită abilităților lor în creșterea fetală (Chard, 1994).
Prin urmare, acești candidați sunt corelați cu creșterea fetală și fiziopatologia PE, chiar dacă nu vor fi acceptați toți ca proteine marker noi, din cauza numărului limitat de pacienți și normal. În consecință, au fost necesare studii suplimentare pentru a investiga expresia diferențială a proteinelor marker candidate prin analiza sistematică a unui număr mare de pacienți pentru aplicarea lor clinică.
În plus, cauzele acestei boli și modul de vindecare a PE fără naștere prematură încă nu sunt sigure. În consecință, în cele din urmă va fi necesar să se investigheze patogeneza și diagnosticul acestei boli pentru a preveni moartea fetală și maternă. Din acest aspect, SRM bazat pe spectrometru de masă descris aici va fi util în descoperirea proteinelor biomarkere.
Metode
Materiale
O coloană cu sistem de eliminare a afinității multiple (MARS) a fost achiziționată de la Agilent Technologies (Santa Clara, CA). Tripsina modificată de grad de secvențiere a fost obținută de la Promega (Madison, WI). Acetonitrilul (clasa HPLC), apa (clasa HPLC) și acidul formic (clasa ACS regent) au fost achiziționate de la Aldrich (Milwaukee, WI). Reactivul de testare a proteinei BCA a fost achiziționat de la PIERCE (Rockford, IL). Un set uman Fetuin-A ELISA (BioVendor, Heidelberg, Germania) a fost utilizat pentru a determina concentrația serică de AHSG.
Studiați populația și pregătirea eșantionului
Am recrutat opt femei însărcinate cu EP severă și cinci cu sarcini necomplicate. Cinci femei însărcinate din fiecare grup au fost vizate pentru profilarea proteinelor serice globale și toate femeile au fost utilizate pentru analiza cantitativă, SRM și ELISA pentru validare. Fenotipul populației studiate este prezentat în Tabelul 1. Am selectat femeile care au fost supuse nașterii prin cezariană electivă pentru a elimina efectele asupra travaliului asupra expresiilor genetice. Înainte de livrare, 10 ofl de sânge venos au fost prelevate din antebraț și colectate într-un tub vacutainer. Preeclampsia severă a fost definită ca o tensiune arterială (TA) de cel puțin 160 mmHg (sistolică) și/sau 110 mmHg (diastolică), cu proteinurie ≥ 2+, determinată printr-un test cu joja, măsurată în cel puțin două ocazii, la șase ore distanță după a 20-a săptămână de gestație. Au fost excluse femeile cu hipertensiune cronică preexistentă, boli renale, lupus eritematos, diabet și hipertensiune gestațională fără proteinurie. Acest studiu a fost aprobat de Consiliul de revizuire instituțională de la Gangnam CHA Medical Center, College of Medicine, CHA University și a fost obținut consimțământul scris în scris de la fiecare pacient.
Epuizarea proteinelor serice abundente
Pentru a reduce complexitatea proteinei serice, am eliminat cele șase proteine cele mai abundente din probele de ser de către MARS (Agilent Technologies, Santa Clara, CA) conform instrucțiunilor producătorului. Acest lucru a dus la epuizarea albuminei, transferinei, IgF, IgA, anti-tripsină și haptoglobină din serul uman. Probele de ser epuizate au fost apoi desalinizate folosind o coloană de centrifugare PepClean C18 (termo, Rockford, IL) pentru a schimba tamponul (50 mM NH4HCO3), după care au fost supuse digestiei triptice în soluție după cum urmează: 10 µg de probe de ser epuizate și 10 mM de ditiotreitol au fost combinate și incubate timp de 45 de minute la 60 ° C pentru reducerea proteinelor. Apoi, s-a adăugat iodoacetamidă 5 mM și probele au fost incubate timp de 30 min în întuneric la temperatura camerei pentru a induce alchilarea. Amestecul preparat a fost apoi supus digestiei cu 125 ng de tripsină timp de cel puțin 4 ore la 37 ° C, după care probele digerate au fost liofilizate folosind un Speed-Vac și apoi resuspendate în 10 ofl de 0,1% TFA în apă HPLC urmată prin desalinizare cu o coloană ZipTip C-18 (Millipore Co., Billerica, MA) pentru a îndepărta detergentul și sarea din amestecul peptidic.
Identificarea proteinelor serice prin LC-MS/MS
Test de monitorizare a reacției selective (SRM)
Test ELISA
Cantități egale de seruri au fost analizate folosind un kit ELISA AHSG uman (BioVendor, Heidelberg, Germania). Sandwich ELISA a fost realizat conform instrucțiunilor producătorului. Apoi, 100 ofl de standarde diluate au fost adăugate la fiecare godeu al controlului calității și probelor și placa a fost incubată pe un agitator orbital de microplacă la temperatura camerei timp de 1 oră. După spălarea godeului de trei ori, s-au adăugat 100 ofl de soluție conjugată și placa a fost apoi incubată timp de 1 oră la temperatura camerei în timp ce se agita la 300 rpm. Placa a fost spălată apoi spălată de trei ori cu soluție de spălare, după care s-au adăugat 100 ofl de soluție de substrat în fiecare godeu și placa a fost incubată timp de aproximativ 10 minute pentru a permite dezvoltarea reacției. În cele din urmă, absorbanța la 450 nm a fost măsurată folosind un cititor de plăci ELISA.
analize statistice
Semnificația statistică a măsurătorilor a fost comparată folosind cea a unui student t-test prin programul MedCalc (software MedCalc, Mariakerke, Belgia, versiunea 11.3.3.0).
- Deteriorarea valorii nutriționale a proteinelor vegetale prin reacții chimice în timpul depozitării și prelucrării
- Articolul complet Abordări actuale de afinitate pentru purificarea proteinelor recombinante
- Ser de curățare incolor, 150 ml Shani Darden NET-A-PORTER
- Detectarea grâului moale în griș și pâine de grâu dur prin analiza microsateliților ADN
- Carbohidrați, proteine și grăsimi - Tulburări de nutriție - MSD Manual Consumer Version