Departamentul de Biochimie Clinică și Farmacologie, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel;
Departamentul de Biochimie Clinică și Farmacologie, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel;
Institutul Național de Biotehnologie din Negev, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel; și
Institutul Național de Biotehnologie din Negev, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel; și
Departamentul de Microbiologie și Imunologie, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel
Departamentul de Biochimie Clinică și Farmacologie, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel;
Institutul Național de Biotehnologie din Negev, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel; și
Departamentul de Biochimie Clinică și Farmacologie, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel;
Departamentul de Biochimie Clinică și Farmacologie, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel;
Departamentul de Biochimie Clinică și Farmacologie, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel;
Institutul Național de Biotehnologie din Negev, Universitatea Ben-Gurion din Negev, Beer-Sheva, Israel; și
Abstract
Există un interes tot mai mare în înțelegerea modului în care autofagia neregulată poate contribui la patogeneza bolii. Cel mai frecvent, stările de boală sunt asociate cu autofagia diminuată, atribuită în principal variației genetice a genelor autofagice și/sau mecanismelor posttranscripționale disfuncționale. În țesutul adipos uman (AT), în obezitate, expresia genelor autofagice este reglată în sus, iar autofagia este probabil activată, asociată cu disfuncția adipoasă. Această revizuire explorează rolul emergent al mecanismelor transcripționale care reglementează autofagia AT în obezitate.
Autofagia este un proces celular conservat evolutiv care vizează componentele intracelulare pentru degradarea lizozomală. Principalele sale scopuri sunt reciclarea substanțelor nutritive din componentele celulare existente cu deficit de nutrienți și eliminarea organelor și proteinelor deteriorate sau inutile. Astfel, autofagia servește ca mecanism de menaj și este implicată în cea mai mare parte în stările de boală atunci când activitatea sa este scăzută. Cu toate acestea, un consum exagerat de componente celulare prin autofagie supraactivată poate perturba funcțiile celulare și poate contribui la patogenie. Într-adevăr, autofagia poate susține ambivalent fie moartea celulară, fie supraviețuirea, în funcție de o reglementare delicată, dependentă de context (8). Astfel, homeostazia celulară depinde de o reglare atentă a autofagiei și atât atenuarea, cât și supraactivarea acesteia pot contribui la patogeneza diferitelor boli.
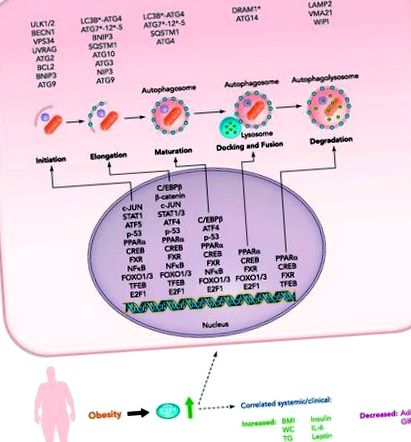
FIGURA 1.Reglarea transcripțională a autofagiei țesutului adipos prin factori de transcripție putativi și confirmați (E2F1) în obezitate
Dovezile acumulate recent sugerează că autofagia reglează metabolismul lipidic, completând implicarea acestuia în degradarea glicogenului și a proteinelor (31, 32, 38, 61, 63). S-a demonstrat că lipofagia, absorbția autofagică și hidroliza picăturilor de lipide citosolice, funcționează ca o cale metabolică pentru descompunerea picăturilor de lipide și mobilizarea lipidelor, constituind astfel o cale alternativă/complementară la „lipoliza clasică” de lipazele citosolice (70 ). Cu toate acestea, acest lucru a fost studiat în principal la non-adipocite, lăsând în mare parte neexplorat rolul autofagiei în celulele majore responsabile de stocarea și eliberarea lipidelor din corpul întreg, în special în condiții de modificări grave ale stocării lipidelor, ca și în cazul obezității. Dezvoltarea și diferențierea țesutului adipos (AT) au fost acum realizate pentru a depinde de autofagia intactă: abordările genetice pentru a interfera cu procesul (cum ar fi eliminarea genelor de autofagie ATG5 în pre-adipocite sau ștergerea specifică adipocitelor ATG5 sau ATG7) a dus la eșecul completării diferențierii adipocitelor și cu AT care seamănă cu grăsimea brună (1, 11, 64).
Până de curând, se credea în mod obișnuit că autofagia este reglementată în primul rând de interacțiunile proteine-proteine ale ATG-urilor și de modificările lor post-traducere, în special de fosforilare (21, 28). Cu toate acestea, acum se înțelege că controlul transcripțional al genelor autofagice este, de asemenea, strâns reglementat de un număr tot mai mare de factori de transcripție, dintre care se știe, de asemenea, că reglează genele implicate în alte căi celulare, inclusiv metabolismul, răspunsul la stres și ciclul celular (13)., 15). Ca și în cazul altor aspecte ale autofagiei, astfel de mecanisme pot fi foarte dependente de tipul celulei și de context, specificitate care poate sta la baza unor rapoarte conflictuale din literatură. În AT la obezitate, mai multe considerații/note de avertizare sunt deosebit de demne de menționat.
1) Obezitatea este o stare cronică de exces de nutrienți. Clasic, ca cale degradativă/catabolică, se știe că autofagia este activată în principal de căi care mediază deficiența de nutrienți/starea de energie scăzută. Acestea includ activitate scăzută a țintei mamiferelor de rapamicină complexul 1 (mTORC1) și proteina kinază activată AMP activată (AMPK). În schimb, autofagia este inhibată de semnale de abundență de nutrienți (cum ar fi insulina). Într-adevăr, primul studiu care a raportat activarea autofagiei în adipocite a sugerat că mecanismul de bază este activitatea mTOR scăzută, rezultat al rezistenței la insulină (46). Reglarea nivelului transcripțional poate sugera o intrare pentru activarea autofagiei de către alți factori declanșatori, mai mult asociați cu supraîncărcarea de nutrienți, cum ar fi diferite căi de răspuns la stres/de reacție [stresul reticulului oxidativ și endoplasmatic (ER), inflamația etc.].
2) Deși mecanismele pentru originea dezvoltării obezității la adulți sunt de mare interes, obezitatea apare frecvent în starea post-dezvoltare. Astfel, sunt adipocite mature, mai degrabă decât diferențierea pre-adipocitelor, în care autofagia este activată în obezitate. Modelele actuale de șoareci genetici nu au oferit informații despre modul în care autofagia activată în adipocitele mature își modifică funcția. Cu toate acestea, reglarea transcripțională a autofagiei în astfel de celule implică probabil factori de transcripție exprimați în adipocite mature.
3) AT este compus dintr-o populație diversă de celule care include adipocite, celule vasculare și diverse celule imune, în special în obezitate. La modelele de șoarece, care pot exagera robustețea inflamației AT asociate obezității în comparație cu obezitatea umană, macrofagele au fost estimate să reprezinte până la 50% din populația celulară a țesutului. Specificitatea reglării autofagiei de tip celular necesită o analiză atentă atunci când vine vorba de AT la obezitate: După cum sa menționat mai devreme, modificările țesuturilor întregi pot ascunde reglarea unică a autofagiei într-o populație specifică de celule AT și/sau pot reflecta modificările asociate obezității la nivelul celulelor. compoziția țesutului.
Această revizuire ia în considerare mecanismele de reglare transcripționale ale autofagiei în adipocite și AT în obezitate prin rezumarea informațiilor recente pe această temă. În primul rând, raportăm pe scurt descoperirile care implică E2F1, în prezent singurul factor transcripțional implicat experimental în expresia genei de autofagie AT activată. Apoi, examinăm mai multe mecanisme de reglare a transcripției probabile ale autofagiei AT luând în considerare factorii de transcripție cunoscuți pentru a regla autofagia în alte țesuturi, dar care sunt, de asemenea, cunoscute a fi exprimate și reglează expresia genelor în adipocite și/sau celule non-adipocite prezente în AT. În cele din urmă, luăm în considerare mecanismele potențiale prin care autofagia AT neregulată poate duce la disfuncție adipă și poate contribui la morbiditatea cardio-metabolică asociată cu obezitatea.
La AT uman, am arătat recent că proteinele E2F1 și nivelurile de ARNm sunt reglate în mod crescut în obezitate, corelându-se cu expresia crescută a ATG5 și LC3B (19)FIGURA 1). Acest lucru a fost deosebit de evident în AT omental, mai degrabă decât subcutanat, la pacienții obezi la care obezitatea este asociată cu un risc ridicat de morbiditate cardio-metabolică. În continuare, confirmând această conexiune la nivel molecular, un test de cromatină-imunoprecipitare (ChIP) optimizat pentru utilizare cu explante AT umane proaspete întregi (20) a dezvăluit legarea crescută a E2F1 la un situs de legare supus E2F1 în promotorul LC3B la persoanele obeze (19, 20 ). Interesant, expresia AT E2F1 nu s-a corelat cu markeri de proliferare, cum ar fi markerul proliferării Ki-67 (Mki67), legarea E2F1 la ciclul său celular clasic E2F1 țintă (ciclină D1) nu a crescut în obezitate, iar expresia crescută a E2F1 a fost contribuită în principal de fracțiunea celulară adipocită (presupus neproliferantă).
FIGURA 2.Reglarea transcripțională mediată de E2F1 a MAP1LC3B (LC3) și a autofagiei
ARNm (A) și proteineB) exprimarea E2F1 și MAP1LC3B (LC3) în două depozite de țesut adipos uman asociat [subcutanat (Sc) și omental (Om)]. Datele provin din două cohorte descrise anterior (Leipzig, n = 437; Bere Sheva, n = 69) la subiecți nonobezi (IMC 2) și obezi (IMC ≥ 30 kg/m 2). Diferența semnificativă dintre Om vs. Sc în același grup IMC: **P ## P ### P ### Diferența semnificativă a Omului obez vs. Om de nonobezi (P # Diferența semnificativă a E2F1 TNF vs. E2F1 con (P
Următoarea secțiune descrie posibili regulatori selectați ai expresiei AT ATG. Considerăm implicarea lor plauzibilă în reglarea autofagiei AT pe baza a două criterii: 1) au publicat rolurile de autofagie-reglare ale acestor factori de transcripție în celulele țesutului neadipos; 2) funcțiile lor care nu sunt legate de autofagie în biologia AT. Reguli potențiali transcripționali suplimentari ai autofagiei AT care nu sunt detaliați în text sunt prezentați pe scurt în Tabelul 1.
- Rolurile fiziologice și fiziopatologice ale taurinei în țesutul adipos în raport cu obezitatea
- Transcriptomul specific tipului celulei în țesutul adipos uman și influența obezității asupra adipocitului
- Efectul ART vechi asupra redistribuirii țesutului adipos și riscul de BCV poate fi
- Pierderea în greutate și autofagia adipoasă concomitentă la șoarecii obezi restricționați cu metionină nu sunt dependente
- Rolul țesutului adipos visceral în patogeneza bolii hepatice grase nealcoolice