Keyu Chen
Kun Xie
Zhuying Liu
Yasushi Nakasone
Kozue Sakao
Md. Amzad Hossain
3 Facultatea de Agricultură, Universitatea Ryukyus, Okinawa 903-0213, Japonia
De-Xing Hou
4 Facultatea de Agricultură, Universitatea Kagoshima, Kagoshima 890-0065, Japonia
Abstract
1. Introducere
Usturoiul (Allium sativum L.) a fost folosit de mult timp în scopuri culinare și medicinale de multe culturi. Pe baza greutății proaspete, usturoiul conține apă (62-68%), carbohidrați (26-30%), proteine (1,5-2,1%), aminoacizi (1,0-0,5%), compuși organosulfurici (1,1-3,5%) și fibre (1,5%). Glucidele sunt cea mai abundentă clasă de compuși prezenți în bulbii de usturoi și reprezintă aproximativ 77% din greutatea uscată. Majoritatea materialului carbohidrat din usturoi este format din polimeri de fructoză solubili în apă numiți fructani [1], reprezentând aproximativ 65% din greutatea uscată [2]. Fructanii din usturoi sunt polizaharide polimerizate cu greutate moleculară mare variind de la l-cisteine (G-SAC), care sunt hidrolizate și oxidate pentru a produce sulfoxizi de S-alil-l-cisteină (alin) în timpul depozitării [11]. Zdrobirea sau tocarea sau mestecarea usturoiului eliberează aliinază, care catalizează alina în alicină și alți tiosulfați [12]. Alicina este considerată a fi responsabilă pentru cea mai mare parte a activității farmacologice a căței de usturoi crude zdrobite [13]. Se consideră că aceste OSC sunt principiile bioactive pentru numeroase beneficii pentru sănătate [14], în special pentru componentele de apărare cu activitate antimicrobiană largă.
Microbii intestinali joacă un rol important în menținerea unui corp sănătos [15]. S-a demonstrat că suplimentarea dietetică cu tărâțe de orez și fasole bleumarin [16], polifenoli dendrobium [17] și propolis [18] influențează compoziția și activitățile microbiotei intestinale [19]. Hrana cu diete bogate în grăsimi (HFD) modulează compoziția microbiomului intestinal prin scăderea prevalenței bacteriilor specifice care protejează bariera intestinului și creșterea prevalenței agenților patogeni oportunisti care pot elibera antigeni liberi, cum ar fi lipopolizaharidele. Acest dezechilibru poate fi asociat cu o permeabilitate intestinală mai mare, ducând la niveluri plasmatice mai ridicate de factori de endotoxină și inflamație și, în cele din urmă, la dezvoltarea tulburărilor metabolice [20,21].
Ingredientele complexe ale usturoiului par să aibă rezultate paradoxale asupra microbiomului intestinal. Experimentele cu compuși separați au arătat că fructanii funcționează ca prebiotice pentru microbiomul intestinal [22] în timp ce OSC-urile usturoiului, cum ar fi alicina, tiosulfinatele și ajoena, acționează ca agenți antibacterieni [23,24]. Prin urmare, este necesar să se clarifice influența aportului întreg de usturoi în viața de zi cu zi asupra microbiomului intestinal. În acest studiu, am folosit un model de șoarece cu dietă normală (ND) și HFD pentru a investiga influența și mecanismele usturoiului întreg asupra microbiomului intestinal. Dextrina a fost utilizată ca un control pozitiv, deoarece dextrina este o polizaharidă [25], similară cu fructanul, și poate stimula creșterea tulpinilor probiotice, cum ar fi Actinobacteria și Bacteroidetes [26], și un număr redus de bacterii patogene [27].
2. Materiale și metode
2.1. Produse chimice și reactivi
Usturoiul a fost recoltat dintr-un câmp de sol din prefectura Aomori, Japonia. După uscare cu aer fierbinte (conținut de umiditate 60%), usturoiul a fost depozitat la -2 ° C timp de 10 luni și apoi pulverizat sub formă de pulbere brută de usturoi (conținut de umiditate 4,8%). Cantitățile de OSC și fructan din pudra de usturoi au fost determinate prin HPLC sau set de testare a fructanului (Biocon Ltd., Nagoya, Japonia), respectiv (Anexa A, Tabelul A1).
Dextrina indigestibilă a fost obținută din amidon natural de porumb cu 95% dextrină și 5% apă. Uleiul de untură a fost obținut de la Sigma-Aldrich Japonia (Tokyo, Japonia). Compoziția nutritivă a dietelor este prezentată în apendicele A, tabelul A2. ND conținea 21% proteine, 6% grăsimi, 54% carbohidrați, 4% celuloză și aproximativ 370 kcal/100 g calorii totale. HFD conținea 21% proteine, 40% grăsimi, 10% carbohidrați, 4% celuloză și aproximativ 570 kcal/100 g calorii totale.
2.2. Modelul mouse-ului
Protocolul experimental animal a fost elaborat în conformitate cu liniile directoare ale Comitetului de îngrijire și utilizare a animalelor de la Universitatea Kagoshima (permisiunea nr. A12005). Șoareci masculi C57BL/6N (cu vârsta de 5 săptămâni) de la Japan SLC Inc. (Shizuoka, Japonia) au fost adăpostite separat în cuști cu așchii de lemn așternute sub lumină controlată (12 ore lumină/zile) și temperatură (25 ° C) și acces gratuit la apă și furaje. Greutatea corporală a șoarecilor a fost cântărită o dată pe săptămână. După aclimatizare timp de 7 zile (vârsta de 6 săptămâni), șoarecii au fost împărțiți aleatoriu în șase grupuri (n = 5) și hrăniți cu ND, NDG (5% usturoi în ND), NDD (4% dextrină în ND), HFD, HFDG (5% usturoi în HFD) sau HFDD (4% dextrină în HFD). După 12 săptămâni de hrănire (vârsta de 18 săptămâni), șoarecii au fost sacrificați după post peste noapte. Fecalele proaspete au fost colectate la începutul (6 săptămâni) și la sfârșitul experimentului (18 săptămâni) pentru investigarea microbiomului intestinal asociat cu diferite vârste sau diete.
2.3. Măsurarea indicatorilor biochimici serici
Serurile de sânge au fost obținute din globii oculari de șoareci și colectate într-un tub cu coagulant (microtuburi separate, FUCHIGAMI, 170720, Kyoto, Japonia) timp de 30 de minute la temperatura camerei pentru a se coagula corespunzător și au fost achiziționate prin centrifugare la 3000 rpm timp de 5 minute și depozitate la - 80 ° C până la utilizare. Nivelurile serice de transaminază glutamic-oxaloacetică (GOT), transaminază glutamică-piruvică (GPT), gamma-glutamil transferază (GGT), colesterol total (T-Cho), triacilglicerol total (TG), colesterol lipoproteic de înaltă densitate (HDL-c )) și glucoza au fost măsurate cu un analizor automat pentru chimie clinică (SPOTCHEM EZ SP-4430, Arkray, Kyoto, Japonia). Nivelul LDL (lipoproteine cu densitate mică) a fost calculat utilizând ecuația Friedewald (LDL = T-Cho - HDL-c - TG/5) [28]. Concentrația de insulină în ser a fost măsurată cu un kit ELISA (Thermo Fisher Scientific Inc., Rockford, IL, SUA) conform instrucțiunilor producătorului. Indicele de evaluare a modelului homeostatic pentru rezistența la insulină (HOMA-IR) a fost calculat cu funcția de glucoză de post × insulină de post/405 [29].
2.4. Histomorfologie
Țesutul ileon de șoareci a fost feliat cu un sistem de microtome înghețat (Yamato, Saitama, Japonia) conform instrucțiunilor producătorului. Felia (7 μm) obținută a fost apoi colorată cu colorare hematoxilin-eozină (H&E) și observată la microscopul cu fluorescență (Keyence, Tokyo, Japonia).
2.5. Analize ale acidului organic Cecal
Conținutul de Cecum și Cecum a fost izolat și cântărit. Fiecare probă de 0,3 g de conținut de cecum a fost transferată în 0,6 ml apă distilată și a stat pe gheață timp de 10 minute după adăugarea a 0,09 ml acid peroxidic 12%. Supernatantul a fost filtrat după centrifugare cu 15.000 × g la 4 ° C timp de 10 minute și apoi utilizat pentru analiza acidului organic folosind cromatografie lichidă de înaltă performanță cu excludere de ioni cu pompă LC-10AD (Shimadzu, Kyoto, Japonia) și conductivitate electrică (Waters431, Kyoto, Japonia). Identificarea componentelor a fost realizată de modulul de date CBM-20A (Shimadzu, Kyoto, Japonia) [30].
2.6. Caracterizarea microbiomului intestinal prin secvențierea genei ARNr 16S
Fecalele șoarecilor au fost colectate de la șoareci adăpostiți în cuști diferite la vârsta de 6 și 18 săptămâni și depozitate la -80 ° C până la utilizare. ADN-ul genomic fecal a fost extras cu kitul de rotire ADN rapid pentru fecale (MP BIOMEDICALS) conform instrucțiunilor producătorului și utilizat pentru a analiza compoziția comunităților bacteriene intestinale prin secvențierea genelor 16S rARN, așa cum este descris în lucrarea noastră anterioară [31].
2.7. Analize statistice
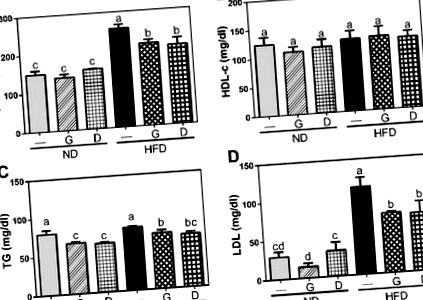
Rezultatele au fost exprimate ca medie ± SD sau mediană și interval. Toate datele au fost mai întâi evaluate cu testul Shapiro-Wilk pentru a evalua normalitatea distribuției. Datele care satisfac normalitatea au fost evaluate în continuare folosind testul lui Levene pentru variații egale pentru a testa egalitatea variațiilor între populații sau niveluri de factori. Datele varianțelor egale au fost analizate prin teste de analiză unidirecțională a varianței (ANOVA), urmate de testele cu intervale multiple ale lui Duncan cu programul statistic SPSS (versiunea 19.0, IBM Corp., Armonk, NY, SUA). O probabilitate de p Figura 1), deși nu a existat nicio diferență în greutatea corporală inițială și în aportul zilnic de alimente pe parcursul perioadei de intervenție de 12 săptămâni. Suplimentarea cu usturoi nu a avut niciun efect semnificativ asupra greutății corporale atât în grupurile ND, cât și în cele HFD, în timp ce suplimentarea cu dextrină a crescut greutatea corporală în grupul ND. Mai mult, nivelurile serice de GOT și GPT au fost semnificativ crescute (p Figura 2) în grupul HFD și au fost semnificativ reduse (p Figura 3). Mai mult, concentrația serică de insulină a fost, de asemenea, crescută în grupul HFD și redusă prin suplimentarea cu usturoi (p Figura 4). Deși nu a existat nicio diferență semnificativă în nivelurile serice de glucoză între toate grupurile, raportul HOMA-IR, un indicator al rezistenței la insulină, a crescut semnificativ în grupul HFD și a fost apoi redus prin suplimentarea cu usturoi (p Figura 4). Dextrina ca martor polizaharidic a arătat un efect similar asupra acestor markeri. Aceste date au indicat faptul că suplimentarea cu usturoi a atenuat dislipidemia indusă de HFD.
Influența suplimentării cu usturoi asupra nivelului seric al profilurilor lipidice, inclusiv a colesterolului total (T-Cho) (A), colesterol lipoproteic de înaltă densitate (HDL-c)B), triacilglicerol total (TG) (C) și lipoproteine cu densitate mică (LDL) (D). Datele reprezintă media ± SD a cinci șoareci pentru fiecare grup. Coloanele cu litere diferite diferă semnificativ (p Figura 5, HFD a scăzut raportul dintre înălțimea vilozității/adâncimea criptei comparativ cu cel din ND (p Figura 6 A). Pentru a elucida în continuare efectul asupra concentrației de acizi organici din caeca, am măsurat scurt -acizi grași cu lanț (SCFA) și acizi grași cu lanț ramificat (BCFA). Rezultatele au arătat că BCFA, inclusiv acidul izo-butiric, au fost crescute în grupul HFD și au fost reduse prin suplimentarea cu usturoi sau dextrină. Acid acetic, acid propionic, acidul n-butiric, acidul succinic, acidul lactic și acidul formic sunt SCFA. Dintre acestea, concentrațiile de acid butirat și acid acetat au fost crescute în grupul HFD și atenuate prin suplimentarea cu usturoi sau dextrină. Aceste date au indicat faptul că suplimentarea cu usturoi ar putea atenuează atât deteriorarea morfologiei intestinului subțire indusă de HFD, cât și concentrații mai mari induse de HFD de acid izo-butiric, acid n-butirat și acid acetat.
Morfologia ileonului terminal (A) și raportul dintre înălțimea vilozității și adâncimea criptei (B). Valorile sunt prezentate ca medii ± SD a 16 puncte histomorfologice ale fiecărui grup. Coloanele cu litere diferite diferă semnificativ (p Figura 7 a indicat faptul că suplimentarea cu usturoi a crescut valoarea Chao1 (A), speciile observate (B), diversitatea filogenetică (PD) indicele întregului arbore (C) și valoarea Shannon (D) de la 6 la 12 săptămâni atât în grupul ND, cât și în grupul HFD. Ca polizaharidă de control, dextrina a scăzut toate aceste patru valori din grupul HFD.
Efectele suplimentării cu usturoi asupra microbiomului intestinal. Bogăția taxonilor microbiomului intestinal a fost evaluată prin analize de α-diversitate folosind valoarea Chao1 (A), indicele speciilor observate (B), Indicele arborelui întreg PD (C) și indicele Shannon (D). Datele reprezintă mediana și intervalul a zece valori ale rarefacției alfa. Compozițiile de specii ale microbiomilor intestinali au fost evaluate prin analize de β-diversitate folosind analiza principală de coordonate (PCoA) a matricelor de distanță UniFrac neponderate, care este prezentată în PC1 vs. PC2 (E) și PC2 vs. PC3 (F). Fiecare punct din (E) și (F) reprezintă începutul (6 săptămâni) sau punctul final (18 săptămâni) al experimentului pentru fiecare grup (n = 8).
Mai mult, am folosit graficele principale de analiză de coordonate (PCoA) (β-diversitate: diversitate între habitat) pe baza matricelor de distanță UniFrac neponderate pentru a investiga asemănările în structura comunității microbiene intestinale între diferitele grupuri. Procentul de variabilitate a setului de date explicat de fiecare coordonată principală este prezentat în titlurile axei (PC1: 15,79%, PC2: 11,60%, PC3: 7,56%). PC1 și PC2 au fost cele două componente principale de coordonate. PC1 reprezintă componenta principală de coordonate care poate explica schimbările de date cât mai mult posibil; PC2 reprezintă componenta principală de coordonate care reprezintă cea mai mare proporție din modificările rămase (și așa mai departe pentru PC3). Graficul PCoA a indicat că structura microbiotei intestinale în grupul ND nu a fost evident modificată în timpul îmbătrânirii, dar a fost modificată de HFD. De asemenea, s-au observat modificări ale structurii microbiene atât pentru suplimentarea cu usturoi, cât și pentru cea de dextrină, cu toate acestea, nu a existat o grupare semnificativă în funcție de localizarea anatomică. Datele sugerează că mecanismele de reglare a microbiomului intestinal de către usturoi și dextrină sunt diferite.
Prin urmare, am investigat în continuare modificările speciilor microbiene individuale la nivelul filumului. Raportul p_Firmicutes/p_Bacteroidetes a crescut prin îmbătrânire de la 6 săptămâni la 18 săptămâni în grupul ND și a fost atenuat în grupurile NDG și NDD (Figura 8). În plus, suplimentarea cu usturoi a crescut abundența relativă a f_Lachnospiraceae și a scăzut abundența relativă a g_Prevotella la nivelul genului de specii. În plus, suplimentarea cu dextrină a crescut abundența relativă a g_Parabacteroides, g_Sutterella și f_Rikenellaceae (Figura 9).
Modularea microbiomului intestinal la nivelul filului. Microbiota intestinală a fost caracterizată prin secvențierea genei ARNr 16S. (A) Abundența relativă a bacteriilor la nivelul filumului. (B) Raportul dintre p_Firmicutes și p_Bacteroidetes pe baza abundenței lor relative.
Modularea microbiomului intestinal la nivel de gen. Microbiomul intestinal a fost caracterizat prin secvențierea genei ARNr 16S, iar datele reprezintă abundența relativă a fiecărui gen bacterian. p_, c_, o_, f_ și g_ reprezintă filum, clasă, ordine, familie și respectiv gen, iar un spațiu liber după literă înseamnă nedefinit. (A) Abundența relativă a mai mult de 1% a bacteriilor la nivel de gen. Mai exact, patru tipuri de bacterii (f_Lachnospiraceae (B), g_Prevotella (C), g_Akkermansia (D), f_ Streptococcaceae (E)) au fost reglementate prin suplimentarea cu usturoi.
4. Discutie
Mai multe linii de studii au afirmat că consumul moderat de usturoi a îmbunătățit o anumită funcție gastro-intestinală și a relevat efectul protector pentru apărarea mucoasei împotriva activității Helicobacter pylori și a dezvoltării ulcerelor [38,39]. În acest studiu, adâncimea criptei jejunale a fost adâncită semnificativ în grupul HFD, iar suplimentarea cu usturoi a atenuat această situație prin promovarea reînnoirii celulelor epiteliale și a ratei de maturare a enterocitelor. S-a raportat că suplimentarea cu L-glutamat a scăzut adâncimea criptelor adâncite și a îmbunătățit rata de maturare a celulelor și funcția secretorie a celulelor epiteliale [40]. Pe de altă parte, consumul excesiv de usturoi ar putea duce la pierderea celulelor epiteliale intestinale [41], ducând la inhibarea absorbției intestinale a acidului glutamic, zaharoză și glucoză [42], care ar putea fi motivul pentru care usturoiul scurtează înălțimea vilozităților într-o dietă normală.
Pentru a înțelege efectele și mecanismele extractului de usturoi întreg asupra microbiomului intestinal, am folosit un model de șoarece și am comparat datele cu dextrina, o polizaharidă pozitivă. Pentru aceasta, am folosit în continuare patru indici diferiți pentru a analiza în mod cuprinzător diversitatea α a microbiomului intestinal. Indicele Chao1 este un estimator al bogăției comunității pentru estimarea numărului de OTU (unități taxonomice operaționale) din eșantion. Indicele speciilor observate este un indice cantitativ al speciilor biologice, care se calculează în funcție de numărul de OTU confirmate [43,44]. Arborele întreg PD este un indice de diversitate filogenetică bazat pe valorile PD. Valorile PD sunt definite ca lungimea totală minimă a tuturor ramurilor filogenetice de pe arborele filogenetic [45]. Indicele Shannon este o prezentare mai cuprinzătoare a diversității care este calculată de OTU-uri la scară bazate pe uniformitatea comunității [46]. Rezultatele au arătat că grupul de diversități β de comunități microbiene la șoareci suplimentați cu usturoi sau dextrină au fost grupate în locații diferite, iar suplimentarea usturoiului ar putea spori bogăția speciei și uniformitatea speciilor microbiomului intestinal mai mult decât dextrina.
Am observat, de asemenea, efecte diferite asupra unor bacterii tipice ale microbiomului intestinal din suplimentarea cu usturoi și dextrină, deși ambele conțin polizaharide. Abundența g_Parabacteroides, g_Sutterella și f_Rikenellaceae a fost crescută prin suplimentarea cu dextrină. Numărul g_Parabacteroides este îmbogățit prin creșterea fibrelor alimentare [61], iar g_Parabacteroides poate digera amidonul care a fost modificat chimic [62]. S-a raportat că g_Parabacteroides și f_Rikenellaceae sunt asociate cu șoareci alergici alimentari [63,64]. g_Sutterella sunt comensale larg răspândite, cu aderență celulară epitelială intestinală și capacități proinflamatorii ușoare [65]. Aceste modificări ale microbiomului intestinal care rezultă din suplimentarea cu dextrină au fost diferite de cele cu usturoi și s-ar putea datora proprietăților chimice ale dextrinei.
Pe scurt, suplimentarea integrală a usturoiului ar putea atenua dislipidemia indusă de HFD și perturbarea microbiomului intestinal (Figura A1). Datele au arătat că usturoiul întreg poate fi un potențial prebiotic care poate preveni perturbarea microbiomului intestinal indusă de HFD.
- Efecte secundare dovedite și beneficii ale usturoiului ▷
- My Slimming World Adventure Homemade Dips Garlic & Herb, Houmous și Tomato & Basil Mayo
- Mylan-Metformin - Utilizări, efecte secundare, interacțiuni
- Fertilizarea cu N, tipul de sol și efectele soiurilor asupra eficienței utilizării N în tef Eragrostis tef (Zucc
- Rețetă slăbită din lume Supă de păstârnac condimentat cu iaurt de usturoi - Oglindă online