Slavko Komarnytsky
† Plantele pentru Institutul de Sănătate Umană, Campusul de Cercetare din Carolina de Nord, Universitatea de Stat din Carolina de Nord, 600 Laureate Way, Kannapolis, Carolina de Nord 28081, Statele Unite
‡ Departamentul de Științe Alimentare, Bioprocesare și Nutriție, North Carolina State University, 400 Dan Allen Drive, Raleigh, Carolina de Nord 27695, Statele Unite
§ Biotech Center, SEBS, Universitatea Rutgers, 59 Dudley Rd, New Brunswick, New Jersey 08901, Statele Unite
|| Institutul de biologie celulară și inginerie genetică, strada Zabolotnogo nr. 148, Kiev 03680, Ucraina
Debora Esposito
† Plantele pentru Institutul de Sănătate Umană, Campusul de Cercetare din Carolina de Nord, Universitatea de Stat din Carolina de Nord, 600 Laureate Way, Kannapolis, Carolina de Nord 28081, Statele Unite
§ Biotech Center, SEBS, Universitatea Rutgers, 59 Dudley Rd, New Brunswick, New Jersey 08901, Statele Unite
Thirumurugan Rathinasabapathy
§ Biotech Center, SEBS, Universitatea Rutgers, 59 Dudley Rd, New Brunswick, New Jersey 08901, Statele Unite
Alexander Poulev
§ Biotech Center, SEBS, Universitatea Rutgers, 59 Dudley Rd, New Brunswick, New Jersey 08901, Statele Unite
Ilya Raskin
§ Biotech Center, SEBS, Universitatea Rutgers, 59 Dudley Rd, New Brunswick, New Jersey 08901, Statele Unite
Departamentul de Chimie Farmaceutică, Școala de Farmacie, Universitatea Internațională de Medicină, Nr. 126, Jalan Jalil Perkasa 19, Kukit Jalil, 57000 Kuala Lumpur, Malaezia.
Abstract
Glicozidele gravidane par să moduleze aportul de alimente afectând eventual circuitele de alimentare hipotalamice; cu toate acestea, mecanismele efectului de reglare a poftei de mâncare ale glicozidelor pregnane rămân obscure. Aici, arătăm că extractele îmbogățite cu glicozide pregnane din mlaștină Asclepias incarnata la 25-100 mg/kg zilnic au atenuat consumul de alimente (cu până la 47,1 ± 8,5% mai puțin decât martorii) și creșterea în greutate corporală la șobolani (10% pentru bărbați și 9 % pentru femei, respectiv) prin activarea semnalizării melanocortinei și inhibarea golirii gastrice. Glicozida gravidă majoră a laptelui, ikemagenina, și-a exercitat efectul de reglare a poftei de mâncare prin scăderea nivelului de proteine legate de agouti (de 0,6 ori), dar nu și a peptidelor de sațietate NPY. Tratamentul cu Ikemagenin a crescut, de asemenea, secreția factorului neurotropic derivat din creier (BDNF) în aval de receptorii melanocortinei din hipotalamus (de 1,4 ori) și din cultura celulară a gliomului de șobolan C6 in vitro (de până la 6 ori). Aceste rezultate susțin efectele multimodale ale glicozidelor pregnane asupra reglării hranei, care depinde de activitatea căii de semnalizare a melanocortinei și BDNF.
INTRODUCERE
Lăptișoarele sunt o sursă abundentă de glicozide pregnane. 8 Suculente de lapte cu creștere lentă Hoodia gordonii și Caralluma fimbriata au fost utilizate în medicina tradițională ca inhibitori naturali ai apetitului. 9,10 P57AS3 pregnano glicozida este singurul constituent activ raportat de la Hoodia care acționează ca un inhibitor al apetitului, 11 prin creșterea posibilă a conținutului de ATP al neuronilor hipotalamici. 12 Într-un singur studiu dublu-orb, controlat cu placebo, cu 50 de voluntari sănătoși, care au primit 1 g de extract Caralluma pe zi timp de 60 de zile, circumferința taliei și foamea au arătat o scădere semnificativă în grupul experimental în comparație cu placebo după 2 luni de tratament . 10 Gama naturală limitată și creșterea lentă a acestor plante suculente și-au restricționat considerabil disponibilitatea pentru cercetare și aplicații terapeutice.
Speciile de asclepias de lapte sunt adaptate la o gamă largă de medii în aproape toate statele din Statele Unite și sunt cunoscute pentru o creștere viguroasă care permite stabilirea lor cu succes ca cultură alternativă pentru producția de fibre, latex, ață de semințe și uleiuri. 13 Lăstarii tineri, tulpini, muguri de flori, fructe imature și rădăcini de lapte de mlaștină (Asclepias incarnata L.) au fost fierte și consumate ca legume de diferite grupuri indigene din estul și mijlocul vestului Americii. 14 În legătură cu un studiu privind constituenții fitochimici ai algei de mlaștină, Warashina a identificat o bibliotecă naturală de glicozide pregnane analoage celor din Hoodia. 15,16 O astfel de diversitate oferă o sursă unică și abundentă de glicozide pregnane pentru investigarea efectelor lor fiziologice și farmacologice.
Pentru a aborda potențialul glicozidelor pregnane de a reduce aportul de alimente și pentru a identifica țintele lor celulare și moleculare, acest studiu a evaluat capacitățile de suprimare a poftei de mâncare ale extractului îmbogățit cu glicozidă pregnan din rădăcinile mlaștinei de lapte (incarnatină) și constituentul său principal al glicozidului pregnan, 12β- cinamoil-3,8,12,14β-tetrahidroxipregn-5-en-20-on glicozidă (icemagenină).
MATERIALE ȘI METODE
Produse chimice
Solvenții utilizați în acest studiu au fost de cromatografie lichidă de înaltă performanță (HPLC); toate celelalte substanțe chimice au fost de calitate analitică și au fost achiziționate de la Sigma-Aldrich (St. Louis, MO), dacă nu se specifică altfel.
Sursa plantei, extracția și identificarea compusului
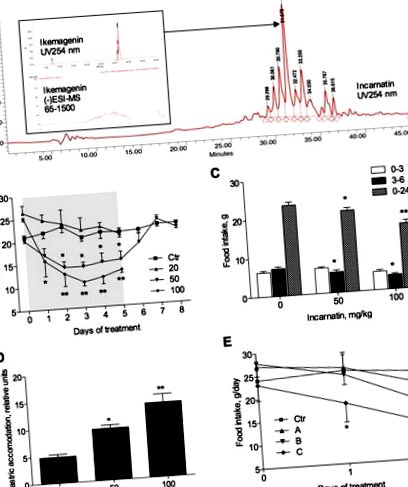
Plantele A. incarnata (mlaștină) au fost cultivate din semințe hidroponic timp de 4 luni și recoltate. Pudra de rădăcină liofilizată (100 g) a fost degresată cu hexan (3 × 100 ml) pe un agitator la temperatura camerei timp de 8 ore. Straturile organice au fost aruncate, iar peleta a fost eliberată de solvent rezidual într-o hotă de fum peste noapte. Materialul rezidual degresat a fost apoi extras cu metanol (2 × 150 ml) pe un agitator timp de 8 ore la temperatura camerei. Supernatantul a fost apoi evaporat sub presiune redusă și liofilizat, obținându-se un extract de rădăcină de lapte brut denumit incarnatină (8 g). Incarnatin conținea 30% (w: w) glicozide pregnane totale, după cum se estimează printr-un test colorimetric pe bază de xanthidrol 17 și nu glicozide cardiace, confirmat de o reacție Kedde negativă. 18 Separarea cromatografică a incarnatinei în trei bazine de subfracție de polaritate mare (A), medie (B) și mică (C) a fost efectuată pe HPLC la scară pregătitoare utilizând coloana Phenomenex Luna C-8 cu fază inversă, dimensiune 150 mm × 2 mm, particule dimensiune 3 μm, echipat cu o precolumnă Phenomenex SecurityGuard. Faza mobilă a constat din două componente, solventul A (0,5% acid acetic în apă deionizată, pH 3-3,5) și solventul B (100% acetonitril) și a fost rulat în modul gradient.
Hrănirea indusă de post
Trei grupuri de șobolani (n = 6) postite 24 de ore au primit o singură doză per os de soluție martor (10% DMSO în ulei de porumb) sau 50 și 100 mg/kg incarnatină suspendată într-un volum total de 2 ml soluție martor la începutul ciclului de hrănire (luminile stinse, 1400 h), moment în care animalele au primit hrană și apă ad libitum. Aportul de alimente a fost măsurat la 3, 6 și 24 de ore după tratamentul cu gavaj și corectat pentru scurgeri (ziua 1). Stomacurile și conținutul stomacului au fost colectate și înregistrate la 3 ore după gavaj cu o doză respectivă de extract de incarnatină în ziua 2 a experimentului.
Golirea gastrică și tranzitul intestinal
Trei grupuri de șobolani (n = 6) postite timp de 4 ore au primit o singură doză per os de soluție martor (10% DMSO în ulei de porumb) sau 50 și 100 mg/kg incarnatină suspendată într-un volum total de 2 ml soluție martor la începutul ciclului de alimentare (luminile stinse, 1400 h). Golirea gastrică a fost determinată de o modificare a metodei cu roșu fenol. 19 După o expunere de 30 de minute la incarnatină, o soluție de peptonă 20% conținând 0,05% roșu fenol ca marker a fost administrată intragastric (1 ml/șobolan). Șaizeci de minute mai târziu, animalele au fost sacrificate, cavitatea abdominală a fost deschisă, joncțiunea gastresofagiană și pilor au fost strânse și stomacul a fost îndepărtat, cântărit și plasat în 14 ml de NaOH 0,1 N și omogenizat. Suspensia a fost lăsată să se stabilească timp de 1 oră la temperatura camerei și apoi, s-au adăugat 5 ml de supernatant la 0,5 ml de acid tricloracetic 20% (g/v) și s-au centrifugat la 3000 rpm timp de 20 min. Supernatantul a fost amestecat cu 4 ml de NaOH 0,5 N și cantitatea de roșu de fenol din probă a fost determinată din absorbanța la 560 nm pe un cititor de microplacă Synergy HT (Biotek, Winooski, VT). În același timp, intestinul subțire a fost prins la ambele capete și complet extins, iar distanța de la pilor la centrul geometric al colorantului migrator a fost înregistrată.
Studiu de hrănire pe termen lung
Incarnatin a fost administrat zilnic timp de 90 de zile la șobolani sănătoși, cu o recuperare de 28 de zile și evaluarea hrănirii pereche de către Laboratoarele Covance (Viena, VA) (studiul nr. 6731-133). Șobolanii Sprague-Dawley de sex masculin și feminin au fost repartizați la cinci grupuri de studiu (15/sex/grup în grupurile 1, 4 și 5; 10/sex/grup în grupurile 2 și 3). Grupurile 1 (control) și 5 (control alimentat pereche) au primit vehiculul, ulei de porumb. Grupurile 2, 3 și 4 au primit incarnatină la doze de 20, 40 și respectiv 50 mg/kg/zi. Preparatele de dozare au fost administrate la o doză de 5 ml/kg prin gavaj oral o dată pe zi la șobolani timp de cel puțin 90 de zile. În timpul fazei de dozare, grupurile 4 și 5 au fost hrănite în perechi (consumul mediu de alimente din grupa 4 a fost utilizat pentru a determina cantitatea de alimente furnizate grupului 5). Animalele suplimentare desemnate pentru faza de recuperare (5/sex/grup în grupurile 1, 4 și 5) au suferit cel puțin 28 de zile de recuperare după administrarea dozei. Au fost evaluate mortalitatea, observațiile clinice, greutatea corporală și consumul de alimente și apă.
Studiul de hrănire a Ikemageninei
Când animalele au fost tratate cu ikemagenin, două grupuri de șobolani (n = 3) postite 24 de ore au primit o singură doză per os de soluție martor (10% DMSO în ulei de porumb) sau 10 mg/kg ikemagenin suspendat într-un volum total de 2 ml de soluție de control la începutul ciclului de alimentare (luminile stinse, 1400 h). Aportul alimentar a fost măsurat la 3 ore după tratamentul cu gavaj, moment în care animalele au fost sacrificate, iar hipotalamusul a fost disecat și procesat pentru extracția ARN și proteine.
Cultură de celule
Linia celulară C6 de gliom de șobolan care exprimă BDNF a fost obținută de la ATCC (Manassas, VA). Celulele au fost trecute în mod obișnuit la fiecare 3-4 zile și menținute în mediul Eagle modificat (DMEM) al Dulbecco conținând 10% ser fetal bovin (FBS) și 0,1% penicilină - streptomicină la 37 ° C și 5% CO2. Celulele au fost subculturate în vase cu 24 de godeuri și, odată subconfluente, expuse la vehicul DMEM proaspăt conținând vehicul (0,1% etanol) sau la diferite concentrații de icemagenină (0,1-10 μM) adăugate la un set de trei godeuri pe doză. Această gamă de doze a fost aleasă pe baza activității farmacologice a ikemageninei în celulele H295R. 20 Acid valproic (2 mM) a fost utilizat ca martor pozitiv. Viabilitatea celulară a fost estimată utilizând testul MTT 21 prin absorbanță citită la 550 nm pe un spectrofotometru cu microplacă (Molecular Devices, Sunnyvale, CA).
Analiza expresiei genelor
Analiza Western Blot
Extractele de celule sau țesuturi întregi au fost preparate în tampon de liză rece ca gheața (62,5 mM Tris · HCI pH 6,8, 2% g/v SDS, 10% glicerol, 50 mM DTT și 0,01% g/v albastru de bromofenol) și centrifugate la 12000 g timp de 20 min la 4 ° C. Cantități egale de proteine (50 μg) din supernatante au fost separate pe geluri de poliacrilamidă SDS 10% și șterse pe membrana de nitroceluloză. Analiza Western blot a fost efectuată cu anticorpi monoclonali pentru BDNF (Abcam, Cambridge, MA) și AGRP (Santa Cruz Biotechnology, Santa Cruz, CA) conform instrucțiunilor producătorului. După ce au fost spălate, petele au fost incubate cu un anticorp secundar marcat cu peroxidază antirabit și vizualizate folosind reactivul ECL Western Bloting Detection (GE Healthcare, Piscataway, NJ). După ce au fost dezbrăcate, petele au fost sondate cu anticorpi β-actinici (Santa Cruz) pentru a servi drept control de încărcare.
Statistici
Datele sunt reprezentate ca medie ± erori standard ale mediei (SEM). Analizele statistice au fost efectuate folosind GraphPad Prism 4.0 (San Diego, CA) folosind testul t Student sau analiza unică a varianței (ANOVA) (după caz). Greutatea corporală a fost analizată cu ANOVA cu măsuri repetate unidirecționale cu testare posthoc pentru a localiza diferențe semnificative la fiecare moment. Valorile P mai mici de 0,05 au fost considerate semnificative.
REZULTATE
Glicozidele Pregnane din rădăcinile mlaștinei de lapte reduc consumul de alimente
Efectul subfracțiunilor de incarnatină asupra consumului de alimente
Trei fracții de polaritate diferită obținute de la incarnatină prin HPLC cu fază inversă au fost apoi testate pentru suprimarea apetitului în doză de 100 mg/kg. Aportul de alimente a fost redus după 1 zi de dozare atât în fracțiunile de polaritate medie (B), cât și în cea mică (C); cu toate acestea, scăderea a atins semnificația numai la animalele care primesc fracția C (Figura 1E). După 2 zile de tratament, animalele care au primit fracția B și-au redus consumul zilnic de hrană cu 30,1 ± 4,8% (p Figura 2A). Inhibarea a fost mai mare la o doză de 100 mg/kg. În același timp, valoarea centrului geometric mediu, o măsură indirectă a tranzitului intestinal, a fost semnificativ mai mare la șobolanii care au primit 50 sau 100 mg/kg de incarnatină (Figura 2B). Funcția motorie colonică, măsurată prin numărul de pelete fecale expulzate de fiecare animal în 1 oră după administrarea de incarnatină la șobolani, a crescut doza în mod dependent (Figura 2C).
Efectul Ikemagenin asupra nivelurilor BDNF în cultura celulară
BDNF este o peptidă anorectică centrală care funcționează în aval de receptorii melanocortinei. 5 Pentru a confirma un efect direct al ikemageninei asupra expresiei BDNF, am testat activitatea de stimulare a BDNF a ikemageninei în celulele de gliom de șobolan C6 (Figura 4A). Doza de Ikemagenin a crescut în mod dependent nivelurile de ARNm BDNF de până la 6 ori față de celulele tratate cu vehicul. Acidul valporic a servit ca un control pozitiv în această analiză (2 mM) și a crescut nivelurile de ARNm BDNF de 2,1 ori în condiții identice. O creștere a proteinei BDNF in vitro după tratamentul cu ikemagenin a fost confirmată prin analiza Western blot (Figura 4B).
Efectul direct al ikemageninei asupra nivelurilor BDNF în celulele C6 gliom. (A) Creșterea dependentă de doză a nivelurilor de ARNm BDNF ca răspuns la 8 ore de tratament cu 0-10 μM icemagenină. (B) Analiza Western blot a nivelurilor BDNF după 24 de ore de tratament cu 0-10 μM ikemagenin în urma cuantificării densitometrice utilizând GAPDH ca control al încărcării. Asteriscurile indică o diferență semnificativă (* p Tabelul 1). O scădere nesemnificativă reziduală de 2% a aportului alimentar a fost observată, de asemenea, în timpul fazei de recuperare la bărbați, în timp ce șobolanii femele au supra-compensat aportul alimentar. Greutatea corporală și creșterea în greutate corporală au scăzut cu administrarea de incarnatină cu 6 și, respectiv, 10% la bărbați și cu 3 și 9% la femei, dar nu au atins semnificație pentru nici o zi de tratament (Figura 5). Aceste valori au fost, de asemenea, în strâns acord cu cele din grupul hrănit în perechi, sugerând că doar modificarea consumului de alimente este suficientă pentru a explica reducerea observată a greutății corporale și a creșterii în greutate corporală asociate cu administrarea de incarnatină. Aportul mediu de apă a fost crescut la ambele sexe în timpul fazei de dozare a experimentului, dar nu a avut o semnificație bogată și nu a fost observat în timpul fazei de recuperare.
Consumul redus de alimente asociat cu administrarea orală de incarnatină a fost observat împreună cu o creștere profundă a acomodării gastrice și întârzierea golirii gastrice (Figura 2). Stomacul proximal produce contracții de frecvență redusă, susținute, care generează un gradient de presiune de la stomac la intestinul subțire și este astfel responsabil pentru golirea gastrică. Acest model de motilitate gastrică rezultă din celulele musculare netede care integrează un număr mare de semnale chimice, hormonale și neuronale, acestea din urmă provenind predominant din sistemul nervos enteric. Un set similar de simptome constând în golirea gastrică lichidă întârziată, relaxarea stomacului proximal și tranzitul intestinal subțire accelerat a fost descris anterior la om pentru agonistul receptorului serotoninei MKC-733 26 și metformină. Viteza de golire gastrică este importantă în reglarea aportului de alimente și a homeostaziei glucozei, în special la subiecții obezi. 28 În consecință, încetinirea golirii gastrice reduce consumul de alimente prin prelungirea reflexului de sațietate mediat de nervul vagal. 29 Mecanismul exact al modului în care glicozidele pregnane afectează golirea gastrică rămâne de investigat.
În mod colectiv, rezultatele prezentate aici demonstrează că tratamentul cu glicozide pregnane are mai multe efecte asupra consumului de alimente care sunt posibil mediate de neuropeptidele hipotalamice. Deși mecanismul precis nu este cunoscut, atât analiza genomică, cât și testele funcționale sugerează că mecanismele celulare care operează in vivo în hipotalamus pentru a spori sațietatea pot fi fie direct afectate de glicozide pregnane (ca în cazul BDNF), fie pot fi secundare modularea tranzitului gastro-intestinal prin stimularea terminalelor aferente vagale. Înțelegerea efectului glicozidelor pregnane ar putea duce la o mai bună înțelegere a mecanismelor care stau la baza comportamentului alimentar și ar putea duce la noi ținte terapeutice pentru pierderea în greutate.
Mulțumiri
Finanțarea
Analizele au fost susținute parțial de Grantul Centrului de Cercetare Botanică NIH 2P50AT002776-06 de la Centrul Național de Medicină Complementară și Alternativă (NCCAM).
Acest manuscris este trimis în memoria iubitoare a lui Dmitry Govorko și a lui Joseph M. O'Neil care au contribuit la această lucrare. Îi suntem recunoscători lui Ivan Jenkins pentru ajutorul cu efect de seră și Reni Pouleva pentru asistența tehnică în cultura celulară.
- Selectarea alimentelor de către căprioarele europene (Capreolus capreolus) efectele chimiei plantelor și
- Dispozitive pentru monitorizarea activității fizice și a consumului de alimente - The New York Times
- Temperatura ambientală caldă a frontierelor scade consumul de alimente într-un birou simulat, care stabilește un pilot
- Calorii, frumusețe și ovulație Efectele ciclului menstrual asupra alimentelor și aspectului
- Hrănirea pisicilor noastre Un ghid pentru consumul adecvat de alimente pentru animale de companie