Shinya FUKIZAWA
1 Institutul de cercetare, Suntory Global Innovation Center Ltd., 8-1-1 Seikadai, Seika-cho, Soraku-gun, Kyoto 619-0284, Japonia
Mai YAMASHITA
1 Institutul de cercetare, Suntory Global Innovation Center Ltd., 8-1-1 Seikadai, Seika-cho, Soraku-gun, Kyoto 619-0284, Japonia
Ken-ichi WAKABAYASHI
1 Institutul de cercetare, Suntory Global Innovation Center Ltd., 8-1-1 Seikadai, Seika-cho, Soraku-gun, Kyoto 619-0284, Japonia
Shiho FUJISAKA
2 Departamentul 1 de Medicină Internă, Universitatea din Toyama, 2630 Sugitani, Toyama-shi, Toyama 930-0194, Japonia
Kazuyuki TOBE
2 Departamentul 1 de Medicină Internă, Universitatea din Toyama, 2630 Sugitani, Toyama-shi, Toyama 930-0194, Japonia
Yuji NONAKA
1 Institutul de cercetare, Suntory Global Innovation Center Ltd., 8-1-1 Seikadai, Seika-cho, Soraku-gun, Kyoto 619-0284, Japonia
Norihito MURAYAMA
1 Institutul de cercetare, Suntory Global Innovation Center Ltd., 8-1-1 Seikadai, Seika-cho, Soraku-gun, Kyoto 619-0284, Japonia
Abstract
INTRODUCERE
Obiceiurile alimentare se schimbă în întreaga lume și un număr tot mai mare de oameni, în special în țările dezvoltate, suferă de obezitate. Obezitatea contribuie la apariția sindromului metabolic, care se caracterizează prin obezitate abdominală, dislipidemie aterogenă, tensiune arterială crescută, rezistență la insulină, stări proinflamatorii și protrombotice [1,2,3]. Potrivit celui mai recent sondaj din 2015, aproximativ 604 milioane de adulți și 108 milioane de copii au fost diagnosticați cu obezitate în 195 de țări [4]. Într-o revizuire a 11 studii, obezitatea în copilărie și adolescență a avut efecte adverse asupra mortalității și morbidității (diabet, hipertensiune, boli ischemice ale inimii și accident vascular cerebral) la vârsta adultă [5, 6]. Astfel, este clar că au fost necesare măsuri preventive pentru a reduce prevalența obezității [7].
Deși companiile farmaceutice lucrează pentru a dezvolta medicamente anti-obezitate eficiente, aceste medicamente sunt acoperite doar de asigurări la pacienții care au dificultăți în dieta sau exercițiile fizice. Deoarece obezitatea rezultă dintr-un dezechilibru între caloriile consumate și caloriile consumate [8], prevenirea obezității prin schimbarea obiceiurilor alimentare este importantă. Unele ingrediente naturale obținute din materii prime alimentare pot ajuta la abordarea epidemiei de obezitate [9]. De exemplu, un studiu clinic a arătat că glicozidele cu quercetină au fost eficiente pentru reducerea grăsimilor viscerale la adulții sănătoși [10]. Quercetina exprimă activitatea lipolitică în țesutul adipos prin îmbunătățirea eliberării glicerinei și fosforilarea lipazei sensibile la hormoni în adipocitele 3T3-L1 [11]. În mod similar, catechinele de ceai îmbunătățesc metabolismul lipidic prin activitatea de beta-oxidare în ficat, sugerând că acestea pot ajuta la suprimarea obezității [12].
Recent, mai multe rapoarte au sugerat că microbiomul este asociat cu progresia obezității. De exemplu, raportul Firmicutes la Bacteroidetes este mai mare la subiecții japonezi obezi comparativ cu subiecții nonobezi [13]. Un studiu efectuat pe animale a arătat că transplantul microbiotei de la șoareci obezi în șoareci fără germeni (GF) a contribuit la fiziopatologia obezității [14]. Când microbiota fecală de la șoareci obezi femele a fost transplantată la șoareci GF, greutatea corporală totală și masa grasă au crescut [15]. Aceste rapoarte susțin semnificația microbiomilor atunci când se ia în considerare mecanismul de bază al obezității.
Unele ingrediente alimentare, inclusiv fibre și polifenoli, au potențialul de a schimba microbiomul [16]. De exemplu, într-un studiu clinic, epigalocatechin-3-galat (EGCG) și resveratrol au fost acordate voluntarilor timp de 12 săptămâni. După intervenție, nivelurile de bacteroidete din microbiom au scăzut [17]. Nivelurile de oxidare a grăsimilor, care pot fi măsurate prin calorimetrie indirectă, au fost asociate cu o abundență inițială de bacteroidete [17]. Aceste rezultate susțin relația dintre microbiom și fenotipuri și cresc posibilitatea ca ingredientele alimentare să afecteze microbiomul.
Xanthohumol, un prenilflavonoid derivat din hamei (Humulus lupulus), a fost raportat a fi benefic pentru sănătate. Xanthohumolul inactivează proteinele de legare a elementelor de reglare a sterolului (SREBP) și reduce sinteza acizilor grași, sugerând că poate regla metabolismul lipidelor și îmbunătăți obezitatea [18]. De asemenea, inhibă angiogeneza la liniile celulare de adenocarcinom pancreatic uman și la șoarecii BALB/c, sugerând că are potențial ca medicament anticancer [19]. Xanthohumolul prezintă un spectru larg de activitate antipatogenă [20]. Cu toate acestea, deși este un compus terapeutic candidat pentru diverse probleme de sănătate, în anumite condiții (de exemplu, la temperaturi ridicate), acesta poate fi izomerizat într-un prenilflavonoid numit isoxanthohumol (IX) [21]. IX este mai rezistent la căldură decât xanthohumolul și este un compus tipic produs în timpul procesului de preparare a berii [22]. Deși IX are trăsături de dorit ca compus funcțional, sunt disponibile puține informații despre bioactivitatea sa. Până în prezent, sa raportat că IX inactivează degradarea formelor precursoare ale SREBP în celulele Huh-7, sugerând că ar putea regla și sinteza acizilor grași [23]. Cu toate acestea, nu este clar dacă IX are efecte anti-obezitate in vivo sau modifică compoziția microbiomului.
Acest studiu a urmărit să investigheze dacă IX ar putea afecta progresia obezității la un model de șoarece și dacă modificările microbiomului ar putea fi relevante pentru efectul IX. În acest scop, am evaluat acumularea de grăsime viscerală și creșterea în greutate corporală utilizând un model de șoarece obez indus de o dietă bogată în grăsimi după tratament oral cu IX timp de 8 săptămâni. Apoi, am evaluat compoziția microbiomului folosind secvențierea genei 16S rRNA. Pentru a clarifica relația dintre microbiom și efectele anti-obezitate ale IX-ului, am evaluat efectul anti-obezitate al IX-ului folosind șoareci GF. De asemenea, am analizat expresia genei hepatice a Acil-CoA oxidazei (Acox1) și a carnitinei palmitoyltransferazei 1a (Cpt1a) după 2 săptămâni de administrare a IX. Am selectat aceste două gene, Acox1 și Cpt1a, deoarece acestea sunt enzime care limitează rata de oxidare a acizilor grași și sunt legate de anti-obezitate [12, 24].
MATERIALE ȘI METODE
Prepararea IX și xanthohumol
IX și xanthohumol au fost purificate dintr-un extract comercial de hamei achiziționat de la Asama Chemical Co., Ltd. (Tokyo, Japonia), utilizând cromatografia pe coloană cu fază normală și inversată. Puritățile IX și xanthohumol au fost confirmate pe baza absorbției ultraviolete atât la 280 nm, cât și la 350 nm, utilizând cromatografie lichidă de înaltă performanță. Produsele purificate cu o zonă de vârf de IX peste 95% în raport cu absorbanța totală au fost utilizate în experimentele ulterioare.
Efect anti-obezitate al IX-ului în modelul de șoarece obez indus de o dietă bogată în grăsimi
Șoarecii masculi C57BL/6 J (cu vârsta de 7 săptămâni) au fost cumpărați de la CLEA Japan, Inc. (Tokyo, Japonia). Pe tot parcursul experimentului, șoarecilor li s-a permis accesul la alimente și apă ad libitum și au fost menținuți la 25 ± 1 ° C și 60 ± 5% umiditate sub un ciclu de lumină-întuneric de 12 ore. Animalele au fost hrănite cu o dietă comercială (D12450B [control]; Research Diets, New Brunswick, NJ, SUA) timp de 1 săptămână. După aceea, șoarecii au fost împărțiți în mod aleatoriu în 7 grupe (n = 8 per grup) pe baza greutății corporale și alocați următoarelor condiții: dietă normală (ND), dietă bogată în grăsimi (HFD) constând din 60% kcal din grăsimi (D12492; Research Diets), HFD și catechine de ceai 300 mg/kg (HFD + C; ca grup de control pozitiv), HFD și doză medie (60 mg/kg) xanthohumol (HFD + XN-M), HFD și scăzut -doza (L; 20 mg/kg) IX (HFD + IX-L), HFD și doză medie (M; 60 mg/kg) IX (HFD + IX-M) și HFD și doză mare (H; 180 mg/kg) IX (HFD + IX-H).
IX, xanthohumol și formularea pentru catehine de ceai (polifenon 70A, Mitsui Norin Co., Ltd., Tokyo, Japonia) au fost diluate în 0,5% greutate/greutate% soluție apoasă de sare de sodiu carboximetil celuloză (Kanto Chemical Co., Inc., Tokyo, Japonia) și administrat oral șoarecilor C57BL/6 J o dată pe zi timp de 8 săptămâni folosind un ac de hrănire. Greutățile corporale au fost măsurate de două ori pe săptămână folosind o cântare electronică (GX-6000, A&D Company, Ltd., Tokyo, Japonia). În ultima zi de administrare, șoarecii au fost sacrificați sub anestezie de izofluran și au fost colectate următoarele țesuturi: țesut adipos visceral (grăsime epididimală, grăsime perirenală și grăsime mezenterică) și conținut cecal. Fiecare probă a fost colectată separat într-un tub de 1,5 ml, liofilizată și depozitată la aproximativ -80 ° C până la analiză. În mod similar, la scurt timp după disecție, am măsurat greutățile fiecărui țesut adipos visceral, inclusiv grăsimea epididimală, grăsimea perirenală și grăsimea mezenterică. Toate experimentele au fost efectuate în 2017. Toate protocoalele pentru procedurile la animale au fost aprobate de Comitetul de etică al experimentelor pe animale în conformitate cu Regulamentul intern privind experimentele pe animale de la Suntory, care se bazează pe Legea pentru tratamentul și gestionarea umană a animalelor (Legea nr. 105, 1 octombrie 1973, modificată la 2 iunie 2017).
O analiză bună a microbiomului folosind conținut cecal
Expresia genei hepatice legată de beta-oxidarea acizilor grași
Un experiment suplimentar a fost efectuat pentru a investiga expresia genei hepatice legate de beta-oxidarea acidului gras. Pentru a evalua efectele pe termen scurt, administrarea orală zilnică de IX a fost repetată timp de 2 săptămâni utilizând modelul de șoarece obez indus de HFD. Stările animalelor și tratamentul de pre-hrănire au fost aceleași cu experimentele de mai sus. Șoarecii au fost împărțiți aleatoriu în 4 grupuri (n = 8 per grup) și alocați la următoarele condiții: ND, HFD, HFD și cu doză mică (30 mg/kg) IX (HFD + IX-L ') și HFD + IX -M. Dozele de IX au fost de 30 și 60 mg/kg. După administrare repetată timp de 2 săptămâni, toți șoarecii au fost sacrificați sub anestezie cu izofluran și țesuturile hepatice au fost colectate și supuse PCR cantitativă în timp real. ARN-ul total a fost izolat din țesuturile hepatice folosind reactiv QIAzol și un kit RNeasy (QIAGEN). Apoi, s-a folosit un kit de transcripție inversă ADNc de mare capacitate (Thermo Fisher Scientific Inc., Waltham, MA, SUA) pentru a sintetiza ADNc. PCR cantitativă în timp real a fost efectuată folosind TaqMan Fast Universal PCR Master Mix (Thermo Fisher Scientific Inc.) și primerii specifici a 2 gene: Acox1 și Cpt1a. Nivelul de expresie genică a fost corelat cu cel al genelor ARNr 18S.
Efect anti-obezitate al IX-ului asupra șoarecilor GF
Un experiment cu șoareci masculi C57BL/6N GF a fost efectuat la Sankyo Labo Service Corporation, Inc. (Ibaraki, Japonia). Pe tot parcursul experimentului, șoarecii au fost crescuți într-un izolator pentru a controla expunerea lor la agenți virali, bacterieni sau paraziți. Șoarecilor li s-a permis accesul la alimente și apă ad libitum și au fost menținuți la 23 ± 3 ° C și 55 ± 15% umiditate sub un ciclu de lumină-întuneric de 12 ore. Pentru a explora implicarea microbiomului în acumularea de grăsimi și creșterea în greutate, am investigat posibilul efect anti-obezitate al IX-ului la șoarecii GF timp de 8 săptămâni (începând cu vârsta de 7 săptămâni). Șoarecii GF au fost împărțiți aleatoriu în 5 grupuri (n = 8 per grup) pe baza greutății corporale și alocați la următoarele condiții: ND, HFD, HFD + C, HFD + IX-M și HFD + IX-H. Dozele de IX au fost de 60 și 180 mg/kg. În ultima zi, au fost măsurate greutățile corporale. Apoi, șoarecii au fost sacrificați sub anestezie cu izofluran și țesuturile adipoase viscerale, grăsimea epididimală, grăsimea perirenală și grăsimea mezenterică au fost colectate pentru a măsura greutățile.
analize statistice
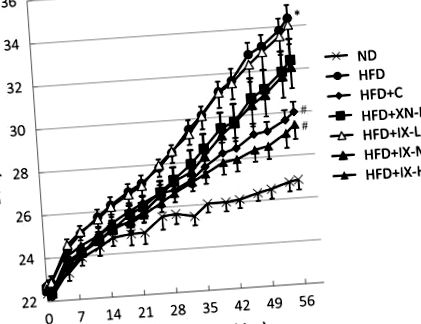
Toate datele sunt prezentate ca mijloace ± SE. IBM SPSS Statistics versiunea 23 a fost utilizată pentru analiza statistică (IBM, Armonk, NY, SUA). Testul lui Dunnett a fost folosit pentru a compara mai mult de 2 grupuri. Testul t al studentului a fost utilizat pentru 2 grupuri independente (de exemplu, ND și HFD). Diferențele au fost considerate semnificative la p Fig. 1) și greutățile tuturor țesuturilor adipoase - grăsime epididimală (Fig. 2A), grăsime perirenală (Fig. 2B) și grăsime mezenterică (Fig. 2C) - la șoarecii hrăniți cu HFD au fost semnificativ mai mari decât cei hrăniți cu ND. În grupurile HFD + C și HFD + IX-H, greutatea corporală și greutățile tuturor țesuturilor adipoase au fost semnificativ mai mici decât cele din grupul HFD. În grupurile HFD + IX-M și HFD + XN-M, doar greutatea grăsimii mezenterice a fost semnificativ mai mică decât în grupul HFD. Nu s-au observat diferențe semnificative în cantitățile de diete consumate între grupul HFD și alte grupuri. Administrarea orală de IX, precum și de xanthohumol și catehine de ceai, a suprimat acumularea indusă de HFD de grăsime viscerală și creșterea în greutate corporală în modelul de șoarece obez indus de HFD.
Efectul administrării orale de isoxanthohumol, xanthohumol și catehine de ceai timp de 8 săptămâni la modificarea greutății corporale într-un model de șoarece obez indus de o dietă bogată în grăsimi. Datele sunt prezentate ca mijloace ± SE de 8 șoareci. * p # p Fig. 3A). La nivel de gen, abundențele relative ale Akkermansia muciniphila, Blautia, Escherichia coli, Bacteroides, Prevotella și Eubacterium au fost semnificativ mai mari în grupurile HFD + IX-M și HFD + IX-H decât în grupul HFD (Fig. 3B) . Abundențele relative de A. muciniphila au reprezentat 23% și 24% din microbiomul total în grupurile HFD + IX-M și, respectiv, HFD + IX-H, în timp ce A. muciniphila a fost nedetectabilă în grupurile ND și HFD (limita de detectare pentru abundența relativă: 0,005%). S-au observat variații în cadrul subgrupurilor în grupul HFD + C. A. muciniphila a fost confirmată la doar 4 din cei 8 șoareci, fiind sub limita de detecție la ceilalți 4 șoareci (Fig. 3C). Abundențele relative de Blautia au reprezentat 8% și 10% din microbiomul total în grupurile HFD + IX-M și respectiv HFD + IX-H, în timp ce Blautia a reprezentat mai puțin de 1% în grupurile ND și HFD. În contrast, abundențele relative de Oscillospira, Lactococcus, Dehalobacterium, Anaerotruncus și Ruminococcus au fost semnificativ mai mici în grupurile HFD + IX-M și HFD + IX-H decât în grupul HFD (Fig. 3B). În general, tratamentul oral cu IX timp de 8 săptămâni a modificat compoziția microbiomului.
Compoziția microbiană a conținutului de cecal după administrarea orală de izoxanthohumol și catehine de ceai timp de 8 săptămâni la nivelurile de gen (A) filum și (B) pentru Akkermansia muciniphila, precum și date individuale (C). Datele sunt prezentate ca mijloace de 8 șoareci. Pentru nivelul (A) de filum, #p Fig. 4A, 4B). Nivelurile relative de expresie ale Acox1 au arătat creșteri de 1,3 și 1,6 ori în grupurile HFD + IX-L ’și HFD + IX-M comparativ cu grupul HFD. Nivelurile relative de expresie ale Cpt1a au arătat creșteri de 1,5 și 1,7 ori în grupurile HFD + IX-L ’și HFD + IX-M comparativ cu grupul HFD.
Nivelurile de expresie a ARNm ale (A) Acil-CoA oxidazei (Acox1) și (B) Carnitinei palmitoyltransferazei 1a (Cpt1a) în ficat după administrarea orală de izoxanthumhumol timp de 2 săptămâni. Datele sunt prezentate ca mijloace ± SE de 8 șoareci. * p Fig. 5A) și greutățile tuturor țesuturilor adipoase - grăsime epididimală (Fig. 5B), grăsime perirenală (Fig. 5C) și grăsime mezenterică (Fig. 5D) - au fost semnificativ mai mari în grupul HFD decât în grupul ND. Cu toate acestea, nu au existat diferențe semnificative în greutatea corporală finală și în greutățile oricărui țesut adipos între grupul HFD și alte grupuri de intervenție (HFD + C, HFD + IX-M și HFD + IX-H). În general, administrarea orală de IX a avut un efect redus asupra acumulării induse de HFD de grăsime viscerală și creșterea în greutate corporală în modelul de șoarece GF.
Deși s-a demonstrat că IX reglează compoziția microbiomului, nu înseamnă neapărat că o modificare a microbiomului este legată de suprimarea obezității. Pentru a confirma această relație, am investigat efectul IX folosind un model de șoarece GF, în care efectul microbiomului poate fi ignorat. La șoarecii GF, creșterea în greutate corporală și acumularea de grăsime viscerală au fost mai moderate decât la șoarecii non-GF (Fig. 1, 2 2 și și 5). 5). Aceste date sunt în concordanță cu un raport anterior care demonstrează contribuția microbiomului la creșterea în greutate corporală și acumularea de grăsime [31]. În consecință, IX nu a prezentat un efect semnificativ anti-obezitate la șoarecii GF. Pe baza acestor constatări, putem face ipoteza că efectul anti-obezitate al IX-ului este legat de modificările microbiomului. În timp ce unele bacterii intestinale pot contribui la obezitate atunci când se compară rezultatele șoarecilor GF și non-GF, A. muciniphila sau Blautia pot reprezenta bacterii anti-obezitate. Catechinele de ceai nu au avut efecte semnificative anti-obezitate la șoarecii GF, deși au existat variații ale microbiomului în cadrul subgrupurilor, cum ar fi în abundența relativă a A. muciniphila. Nu este clar dacă mecanismul care stă la baza efectului anti-obezitate al catechinelor de ceai este același cu cel din IX.
În concluzie, un prenilflavonoid derivat din hamei, IX, a arătat activitate anti-obezitate și capacitatea de a schimba compoziția microbiomului la șoareci. Compoziția microbiomului este asociată cu efectul anti-obezitate al IX-ului, deoarece IX nu a prezentat efecte anti-obezitate semnificative la șoarecii GF. Rămâne neclar dacă creșterea abundenței relative de A. muciniphila și Blautia sunt direct implicate în efectul anti-obezitate. Deoarece IX este mai rezistent la căldură decât xanthohumolul, acesta poate fi util în dezvoltarea produselor alimentare care au beneficii anti-obezitate. Sunt necesare studii clinice viitoare pentru a confirma constatările noastre.
- Antrenamentul aerob inversează semnalizarea pro-inflamatorie indusă de dietă bogată în grăsimi la mușchii scheletici ai șobolanilor
- Efectul anti-obezitate al proteinelor din cacao (Theobroma cacao L
- Un studiu pilot al efectului kiwiului verde asupra fermentației intestinale umane măsurat de
- Un extract de afine bogat în polifenoli protejează împotriva obezității induse de dietă, rezistenței la insulină și
- Ziua anti-obezitate 72 Cele mai bune mesaje, citate; Salutari