Lucia Leite Lais
1 Departamentul de nutriție, Universitatea Federală din Rio Grande do Norte, Natal 59084-100, Brazilia.
Sancha Helena de Lima Vale
1 Departamentul de nutriție, Universitatea Federală din Rio Grande do Norte, Natal 59084-100, Brazilia.
Camila Alves Xavier
2 Departamentul de nutriție, Universitatea Potiguar, Natal 59056-000, Brazilia.
Alfredo de Araujo Silva
3 Spitalul Universitar Lauro Wanderley, Universitatea Federală din Paraiba, Joao Pessoa 58051-900, Brazilia.
Tolunay Beker Aydemir
4 Departamentul de Știința Alimentelor și Nutriția Umană, Universitatea din Florida, Gainesville 32611, Statele Unite.
Robert J Cousins
4 Departamentul de Știința Alimentelor și Nutriția Umană, Universitatea din Florida, Gainesville 32611, Statele Unite.
Abstract
Introducere
Inflamația, stresul oxidativ și tulburările homeostaziei zincului pot juca un rol esențial în patogeneza și progresia diabetului zaharat de tip 2 (T2DM) [1,2]. Starea scăzută de zinc este asociată cu o scădere a sensibilității la insulină, afectarea utilizării glucozei, inflamație și deteriorarea oxidativă [3]. În ciuda relației bine stabilite dintre transportorul de zinc 8 (ZnT8) și diabet, încă lipsește un instrument de diagnostic fiabil pentru a accesa starea zincului [4]. Transportorii de metalotioneină (MT) și zinc (ZnT) au fost studiați recent ca posibili biomarkeri legați de starea zincului corporal [5]. Cu toate acestea, înțelegerea relațiilor dintre ZnTs și T2DM este limitată, iar impactul dietei asupra genelor legate de inflamație și stres oxidativ în T2DM este încă slab înțeles. Mai mult, nutriția este probabil cel mai important factor de mediu, care este capabil să moduleze expresia genelor implicate în căile metabolice asociate cu T2DM [6], ceea ce evidențiază importanța unei diete adecvate ca terapie nutrițională. Astfel, acest studiu a avut drept scop evaluarea efectului unei diete echilibrate de o săptămână asupra controlului metabolic și a exprimării ZnT-urilor în celulele mononucleare din sângele periferic de la pacienții cu T2DM.
Materiale și metode
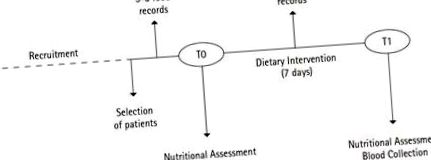
Participanți și proiectarea studiului
Consumul de alimente
Informațiile privind consumul de alimente au fost obținute utilizând înregistrări alimentare din 3 zile neconsecutive (2 zile săptămânale și 1 zi de weekend). Pacienții au primit trei formulare de înregistrare a alimentelor de 24 de ore pentru a înregistra, toate alimentele și băuturile consumate, cât mai exact posibil. După cum au recomandat Thompson și Byers [7], dieteticienii instruiți au instruit pacienții cum să-și înregistreze corect aportul de alimente, inclusiv informații despre timp, descrierea alimentelor și cantitatea consumată. Măsurile menajere ale alimentelor au fost convertite în grame sau în scară de volum înainte de a fi analizate. Energia, proteinele, grăsimile, carbohidrații, aportul total de fibre, calciu, fier și zinc au fost calculate utilizând software-ul AVANUTRI Revolution® (Avanutri, Rio de Janeiro, Brazilia). Alimentele care nu au fost incluse în software au fost încorporate în analize pe baza tabelului de compoziție alimentară braziliană [8] sau pe informațiile nutriționale conținute pe etichetele alimentelor.
Evaluarea nutrițională
Evaluarea stării nutriționale s-a bazat pe indicele de masă corporală (IMC) și procentul de masă grasă (% FM) calculat de Bioimpedanță (RJL Systems, Clinton Township, MI, SUA), conform recomandărilor literaturii [9,10].
Intervenție dietetică
Planul individualizat de alimentație s-a bazat pe recomandările Asociației Americane a Diabetului [11] și a Societății Diabetului din Brazilia [12]. O dietă normocalorică (25-30 kcal/kg/zi) pentru menținerea greutății, conținând 20% energie ca proteină, 20% ca grăsime, cu niveluri scăzute de acizi grași saturați (SFA) și 60% ca carbohidrați fibră a fost asigurată pentru T1. Dieta a inclus carbohidrați din fructe, legume, cereale integrale, leguminoase, alimente care conțin fibre și lapte cu conținut scăzut de grăsimi. Grăsimile trans au fost reduse la minimum. Zahărul a fost înlocuit cu îndulcitor non-nutritiv. Carnea roșie a fost oferită doar de două ori pe săptămână și s-au oferit trei porții de pește pe săptămână. Uleiul de măsline extravirgin era inclus zilnic ca sos de salate. Am oferit un model de dietă care este complet accesibil și realist. Dieta a fost furnizată și nu numai prescrisă, eliminând eventualele prejudecăți. Mâncarea și mesele erau livrate la casele pacienților în fiecare zi.
Colectarea și prelucrarea probelor
Analize statistice
Rezultatele sunt prezentate ca medie ± SD. Testul Shapiro-Wilk a fost utilizat pentru a analiza normalitatea datelor. Pentru a compara mijloacele dintre T0 și T1 (date asociate) (Tabelul 1 și Figura 2), am folosit testul Student t sau testul Wilcoxon, în funcție de distribuția datelor. Testul de corelație Pearson sau Spearmen a fost utilizat pentru a analiza asocierea dintre fiecare pereche de expresie genică studiată (Tabelul 2), în funcție de faptul dacă datele au fost distribuite în mod normal sau nu. Mai mult, pentru a compara diferențele dintre două grupuri independente (de exemplu, subiecți sănătoși vs. T0) (Figura 2) care nu sunt distribuite în mod normal, am folosit testul Man-Whitney. Analiza statistică a fost efectuată folosind Graph Pad-Prism v.6.0a și modificările au fost considerate semnificative dacă p ≤ 0,05.
ZnT: transportori de zinc (ZnT1-10 și ZIP1-14), NS: nesemnificativ, TNFα: factor de necroză tumorală α, IL6: interleukină 6, MT1: metalotioneină 1.
* p ≤ 0,05; † p Tabelul 1). Obezitatea și citokinele pro-inflamatorii, inclusiv TNFα și IL6, pot spori rezistența la insulină și pot afecta homeostazia glucozei [13]. Nivelurile mai mari de TNFα și IL6 plasmatice găsite la pacienții diabetici relevă un profil inflamator tipic al acestor pacienți. În concordanță cu rezultatele noastre, niveluri mai ridicate de TNFα au fost găsite la femeile aflate în postmenopauză [14] și la pacienții diabetici de sex masculin și feminin [15].
După ce dieta echilibrată a fost oferită pacienților diabetici (T1), nivelurile plasmatice de TNFα și IL6 au avut tendința de a scădea, dar diferența nu a fost semnificativă (Tabelul 1). Intervenția de o săptămână ar fi putut fi prea scurtă pentru a detecta modificări semnificative ale acestor parametri. Dimpotrivă, FPG la pacienții diabetici a scăzut semnificativ la T1. Cu toate acestea, nu s-a observat nicio modificare a greutății la pacienții noștri diabetici (Tabelul 1), subliniind importanța compoziției dietei și nu doar o restricție calorică asupra controlului glicemic al pacienților diabetici [16].
Participanții din toate grupurile au avut o concentrație de SZn peste valoarea minimă sugerată pentru starea scăzută de zinc (Tabelul 1). Studiile au arătat atât scăderea [1,17], cât și creșterea [18,19] a nivelurilor de SZn la pacienții diabetici. În general, o scădere a SZn este frecventă în T2DM datorită hiperzincuriei, în timp ce o creștere a SZn se observă mai des în diabetul de tip 1 datorită distrugerii celulelor β pancreatice cu eliberarea de zinc [20]. Mai mult, concentrațiile de SZn pot fi dependente de vârsta diabetului care apare [2] și de durata diabetului: nivelul SZn scade odată cu durata mai lungă a diabetului [20]. SZn nu este un biomarker de încredere pentru a evalua starea corpului de zinc [21]. Deoarece pacienții cu diabet zaharat au SZn normal în acest studiu, este posibil ca mediatorii inflamatori crescuți să nu fi fost la nivelurile necesare pentru a induce hiposincemia [22, 23]. Comparând dieta echilibrată (T1) cu dieta obișnuită (T0) la pacienții diabetici, au existat diferențe semnificative în totalul grăsimilor și SFA și o creștere semnificativă a aportului de carbohidrați, fibre, calciu și fier (Tabelul 1).
Exprimarea transportorilor de zinc în PBMC
Pacienții cu T2DM au prezentat o expresie mai scăzută a mARN-ului ZnT4 și mARN-ului IL6 mai mare comparativ cu subiecții sănătoși (Figura 2). Comparând T0 și T1, am observat reglarea descendentă a ARNm-urilor TNFα, IL6 și MT1 ca răspuns la intervenția alimentară echilibrată (Figura 2). Cu toate acestea, mARN-ul ZnT4 nu a fost diferit între T0 și T1 în acest studiu. De remarcat, Noh și colab. [24] a găsit o reglare descendentă a expresiei mARN-ului ZnT4 la femeile obeze cu niveluri ridicate de TNFα plasmatic. Ca proteină exportatoare de zinc, o scădere a expresiei mARN-ului ZnT4 la diabetici în comparație cu persoanele sănătoase ar putea influența inflamația prin creșterea reținerii zincului intracelular.
Un studiu de epuizare și reumplere a zincului a demonstrat o expresie modulată a ZnT-urilor și a genelor inflamatorii din celulele sanguine de la nouă bărbați sănătoși [5]. În schimb, un studiu de 12 săptămâni nu a arătat nicio diferență semnificativă în expresia ZnTs și MT după suplimentarea cu zinc și/sau acid α-linolenic [14]. În studiul nostru, expresia ZnTs nu s-a modificat ca răspuns la o intervenție a unei diete echilibrate de o săptămână (Figura 2). Cu toate acestea, reglarea descendentă a TNFα, IL6 și MT1 a fost observată la T1 ca răspuns la dietă fără o modificare a terapiei medicale sau a nivelului de activitate fizică. Rezultatele noastre sunt în acord cu studiile, care au raportat că alegerile alimentare sănătoase îmbunătățesc metabolismul glucozei și diminuează inflamația, reprimând astfel expresia genelor pro-inflamatorii [25,26]. În plus, având în vedere că MT este o proteină redox-activă și este indusă în timpul inflamației, reglarea descendentă a ARNm MT1 găsită la T1 indică o reducere a stresului oxidativ [27].
O serie de corelații bivariate în transcrierile din PBMC a fost găsită în Tabelul 2. Studiile anterioare au găsit asociații pozitive în rândul mARN-urilor ZnT la adulții tineri sănătoși (ZnT1 vs. ZnT5 și ZnT1 vs. Zip3) [26] și la femeile diabetice cu T2DM după (Zip3 vs. Zip5) sau fără supliment de zinc (ZnT6 vs. Zip7 ) [14]. De acord cu Foster și colab. [28], am observat cea mai mare asociere dintre mARN-ul ZnT1, Zip3 și ZnT5. Exprimarea acestui grup de ZnTs s-a comportat în mod similar la pacienții cu T2DM. Mai mult, ARNm TNFa a fost puternic asociat cu transcrierile ZnT1 și MT1, în timp ce ARNm IL6 a avut o corelație puternică cu Zip8 și Zip14. Această constatare este în acord cu reglementarea documentată a acestor gene transponder de către citokinele proinflamatorii [21]. De remarcat, toate asociațiile pozitive care implică ARNm MT1 au fost găsite numai la T1, implicând faptul că expresia MT1 este sensibilă la nivelurile glicemice (Figura 2).
Concluzii
O dietă echilibrată oferită timp de o săptămână a reușit să îmbunătățească controlul metabolic la pacienții cu T2DM prin scăderea FPG. Acest control metabolic poate fi legat de reglarea descendentă a transcrierilor legate de zinc din PBMC, ca modificări ale ARNm TNFα, IL6 și MT1. Intervenția dietetică nu a reușit să ofere o schimbare semnificativă a ARNm-ului ZnTs de la PBMC în acest studiu.
Limitările prezentului studiu includ dimensiunea sa mică a eșantionului și o perioadă scurtă de studiu. Sunt necesare studii suplimentare pentru a înțelege mai bine impactul dietei asupra ZnT-urilor și efectele acesteia asupra căilor metabolice și inflamatorii la adulții cu T2DM.
Mulțumiri
Această activitate a fost susținută parțial de Consiliul Național pentru Dezvoltare Științifică și Tehnologică (CNPq), numărul de grant 472832/2011-5 (către LLL) și NIH Grant R01 94244 de la Institutul Național pentru Diabet și Boli Digestive și Rinice (către RJC).
Note de subsol
Conflict de interese: Autorii declară că nu au interese concurente.
Contribuțiile autorilor: Contribuția fiecărui autor: LLL, SHLV, CAX și AAS au participat la proiectarea datelor de cercetare și achiziție. LLL, TBA și RJC au participat la analiza și interpretarea datelor; LLL și RJC au scris manuscrisul. Toți autorii au citit și au aprobat manuscrisul final.
- Numărarea caloriilor și o dietă echilibrată - manechine
- Hrănește-ți calul o dietă echilibrată - Expert-instrucțiuni pentru călăreții englezi
- Guppii mănâncă alge Un ghid pentru o dietă echilibrată a Guppy; Tank Mate
- Hrana pentru câini - O dietă echilibrată pentru câinele dvs. VetBabble
- Consumul unei diete echilibrate Matsun Nutrition Liquid Supplement Contract Manufacturing