Southern Crop Protection and Food Research Centre, Agriculture and Agro - Food Canada, 1391 Sandford St., London, ON, Canada, N5V 4T3
Lawson Health Research Institute, Londra, ON, Canada, N6A 5A5
Institutul de cercetare Robarts, Londra, ON, Canada, N6A 5A5
Lawson Health Research Institute, Londra, ON, Canada, N6A 5A5
Plantigen Inc., 700 Collip Circle, Londra, ON, Canada, N6G 4X8
Sunnybrook and Women's College Health Science Center, 2075 Bayview Avenue, Room A338, Toronto, ON, Canada, M4N 3M5
Southern Crop Protection and Food Research Centre, Agriculture and Agro - Food Canada, 1391 Sandford St., London, ON, Canada, N5V 4T3
Lawson Health Research Institute, Londra, ON, Canada, N6A 5A5
Institutul de cercetare Robarts, Londra, ON, Canada, N6A 5A5
Southern Crop Protection and Food Research Centre, Agriculture and Agro - Food Canada, 1391 Sandford St., London, ON, Canada, N5V 4T3
Lawson Health Research Institute, Londra, ON, Canada, N6A 5A5
Institutul de cercetare Robarts, Londra, ON, Canada, N6A 5A5
Lawson Health Research Institute, Londra, ON, Canada, N6A 5A5
Plantigen Inc., 700 Collip Circle, Londra, ON, Canada, N6G 4X8
Sunnybrook and Women's College Health Science Center, 2075 Bayview Avenue, Room A338, Toronto, ON, Canada, M4N 3M5
Southern Crop Protection and Food Research Centre, Agriculture and Agro - Food Canada, 1391 Sandford St., London, ON, Canada, N5V 4T3
Lawson Health Research Institute, Londra, ON, Canada, N6A 5A5
Institutul de cercetare Robarts, Londra, ON, Canada, N6A 5A5
rezumat
Introducere
Descris inițial în 1989 (Fiorentino și colab., 1989), IL-10 s-a arătat în numeroase studii că este o citokină antiinflamatoare puternică prin capacitatea sa de a inhiba activarea celulelor T macrofage și T-helper-1 (Th1), precum și expresia TNF-α ( Vieira și colab., 1991; Kuhn și colab., 1993; Schreiber și colab., 1995). Deși administrarea sistemică a IL-10 a arătat un beneficiu clar în CD și UC rezistente la steroizi, din păcate, în studiile pe termen lung, beneficiul clinic și îmbunătățirea endoscopică a inflamației intestinale la pacienții cu DC activă moderată și cronică activă au fost compensate de efectele dăunătoare asupra niveluri de celule roșii din sânge și trombocite, care au fost probabil legate de administrarea sistemică (subcutanată) de doze mai mari de IL-10 (> 10 µg/kg) (Schreiber și colab., 2000). Pentru a evita toxicitatea asociată cu administrarea sistemică, Steidler și colab. (2000) au utilizat administrarea intragastrică de Lactococcus lactis secretând IL-10 pentru a reduce inflamația la modelele murine de colită ale IL-10 -/- și dextran sulfat de sodiu (DSS). În studiile ulterioare, o tulpină dependentă de timidină Lactococ a fost utilizat pentru a aborda problemele de biosecuritate și potențialei evadări de mediu ale organismelor modificate (Steidler și colab., 2003).
rezultate si discutii
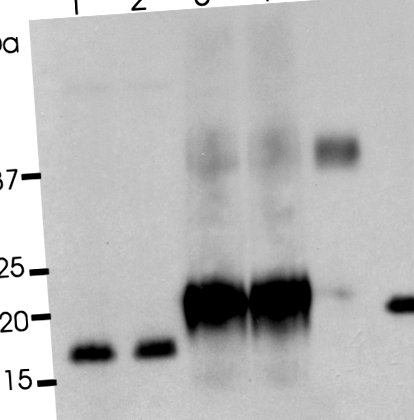
IL-10 exprimat de plante nu este glicozilat
Interleukina-10 umană recombinantă din plante (pIL-10) nu este glicozilată. IL-10 recombinant (rIL-10), pIL-10 și eritropoietină recombinantă (rEPO) au fost tratați în tampon de deglicozilare timp de 2 ore la 37 ° C cu sau fără PNGază F. Banda 1, rIL-10; banda 2, rIL - 10 cu PNGase F; Articolul 3, pIL-10; banda 4, pIL - 10 cu PNGase F; banda 5, rEPO; banda 6, rEPO cu PNGase F.
IL-10 exprimat de plante este rezistent la digestia lichidului gastric și intestinal
Proteina IL-10 purificată este acid-labilă și este degradată rapid în condiții de pH scăzut (Syto și colab., 1998). Întrucât intenția noastră era de a furniza rIL-10 exprimat în țesutul plantei ca supliment alimentar, a fost esențial să determinăm dacă pIL-10 este rezistent la degradarea gastro-intestinală și dacă matricea celulară a plantei a contribuit la orice protecție împotriva enzimelor și condiții de pH. In vitro studiile cu soluții digestive simulate sunt utilizate pe scară largă ca modele de digestie a animalelor pentru a investiga eliberarea controlată a produselor farmaceutice experimentale (Doherty și colab., 1991), precum și digestibilitatea proteinelor vegetale și animale și a aditivilor alimentari (Zikakis și colab., 1977; Tilch și Elias, 1984). Prin urmare, am comparat stabilitatea hIL-10 produsă în plantele transgenice, fie încorporate în țesutul de tutun liofilizat, fie purificate din țesutul plantei, folosind fluid gastric simulat (SGF, 3,2 g/L pepsină, pH 1,2) pentru a modela condițiile stomacului și lichid intestinal simulat (SIF, 10 g/L pancreatină, pH 6,8) pentru afecțiuni proximale ale intestinului subțire. Toate experimentele de digestie au fost efectuate cu proteine dimerice native rIL-10 și pIL-10 care s-au dovedit anterior a fi biologic active (Menassa și colab., 2001).
În absența materialului vegetal, interleukina-10 umană recombinantă din plante purificată (pIL-10) a fost comparată cu IL-10 recombinantă (rIL-10). IL-10 a fost detectat prin imunoblotare după digestia rIL-10 (a, c) și a pIL-10 (b, d) în fluidul gastric simulat (SGF) la pH acid (a, b) și neutru (c, d). Stelele umplute indică monomerul IL-10; stelele deschise indică dimerul IL-10. pIL-10 este puțin mai mare decât rIL-10 datorită etichetei terminale C (Menassa și colab., 2001).
Detectarea interleukinei-10 (IL-10) prin test imunosorbent legat de enzime (ELISA). (a) Tratamentul frunzelor liofilizate în fluid gastric simulat (SGF) la pH neutru sau acid. (b) Tratamentul IL-10 recombinant purificat (rIL-10), IL-10 uman recombinant de plante (pIL-10) sau frunze liofilizate care exprimă IL-10 în lichid intestinal simulat (SIF).
Administrarea orală cronică a tutunului cu conținut scăzut de nicotină este bine tolerată de șoareci
S-a demonstrat că nicotina afectează inflamația atât la pacienții cu UC, cât și la cei cu CD (Birrenbach și Bocker, 2004). Deși nicotina are un impact negativ asupra jejunitei, pare să îmbunătățească colita la șoarecii IL-10 -/-, sugerând că există efecte directe ale nicotinei asupra sistemului imunitar (Eliakim și colab., 2001). Prin urmare, era important să ne asigurăm că efectele chiar și unor cantități mici de nicotină din tutunul cu alcaloizi slabi nu confundau observațiile la șoarecii hrăniți cu țesut de tutun. Tutun cu conținut scăzut de alcaloizi, cultivat în camere cu mediu controlat, conține între 1,5 și 3,1 µg nicotină/g greutate uscată (DW) (Tabelul 1). Expunerea maximă calculată mai mică de 6 µg pe zi a fost cu mult sub nivelurile de expunere de 75 µg pe zi, care au avut efect la șoarecii IL - 10 -/- (Eliakim și colab., 2002). În concordanță cu aceasta, nu a existat nicio diferență în niciun parametru clinic, creștere în greutate sau histologie intestinală la șoareci cărora li s-a administrat țesut din plante de tutun cu conținut scăzut de nicotină față de cei care au primit chow normal (nu este prezentat).
| Procesul 1 | C57BL/6 | 8 | 20 | 2.9 | 5.2 | 2,68 |
| Procesul 2 | C3H | 8 | 20 | 3.1 | 2 | 4.5 |
| Procesul 3 | C3H | 5 (control), 10 (grup IL - 10) | 30 | 1.5 | 1.4 | 6 |
- * Variabilitatea conținutului de nicotină și IL-10 este rezultatul diferențelor în condițiile de creștere ale diferitelor loturi, adică camere de creștere diferite, vârsta diferită a plantelor la recoltare.
(a) Studiu privind toxicitatea tutunului. Creșterea procentuală în greutate medie a șoarecilor de tip B6 sălbatici hrăniți cu chow obișnuit, tutun cu nicotină crescută în câmp (C, 7 mg nicotină/g greutate uscată) sau tutun cu nicotină scăzut cultivat în câmp (LN, 0,6 mg nicotină/g greutate uscată ) fie la 10%, fie la 20% din dietă (g/g) timp de 7 săptămâni. (b) Scoruri generale de histologie intestinală pentru interleukina C57BL/6 - 10 șoareci nuli (IL - 10 -/-) hrăniți cu chow regulat (n = 8), tutun cultivat în cameră de creștere (LN 20%, 2,9 (g nicotină/g greutate uscată), n = 8) sau tutun crescut în cameră de creștere care exprimă IL-10 (LN 20% IL-10, 5,2 (g nicotină/g greutate uscată, 2,68 (g IL - 10/g greutate uscată), n = 8) la 20% din dietă. Secțiunile au fost punctate pentru ulcerație, infiltrat, leziuni epiteliale și foliculi limfoizi. Datele prezentate sunt pentru intestinul subțire. Barele indică erori standard; asteriscul indică o diferență semnificativă la P = 0,002.
Experimente de hrănire a șoarecilor cu IL-10 - exprimarea tutunului
(a) Creșterea procentuală în greutate medie a interleukinei - 10 nule (IL - 10 -/-) șoareci C3H hrăniți cu chow regulat, camera de creștere - tutun crescut cu nicotină redusă (LN, 3 µg nicotină/g greutate uscată) sau transgenic scăzut - nicotină tutun care exprimă IL-10 (LN IL-10, 6 µg IL-10/g greutate uscată) la 30% din dietă timp de 30 de zile. (b) Scoruri generale de histologie intestinală pentru C3H IL - 10 -/- șoareci hrăniți cu chow regulat (n = 13), tutun cultivat în cameră de creștere (LN, 2,9 µg nicotină/g greutate uscată, n = 12) sau tutun crescut în cameră de creștere exprimând IL-10, LN IL-10, 5,2 µg nicotină/g greutate uscată, 2,68 (g IL - 10/g greutate uscată, n = 18) la 20% sau 30% din dietă. Secțiunile au fost punctate pentru ulcerație, infiltrat, leziuni epiteliale și foliculi limfoizi. Datele prezentate combină intestinul gros și subțire de la 20% și 30% grupuri hrănite cu tutun într-un scor compozit. Barele indică erori standard; asteriscurile indică o diferență semnificativă la P = 0,004.
Hrănirea tutunului care conține IL-10 afectează expresia genei citokinelor intestinale
Relativ puține studii au examinat efectul expunerii la IL-10 asupra expresiei genei citokinelor in vivo. În macrofagele murine de la șoareci IL-10 -/-, atât TNF-α, cât și IL-1β au fost reglate în jos și nici o genă de citokine nu a fost reglată în sus cu administrarea de IL-10 (Lang și colab., 2002). În schimb, IL-10 TNF-α reglat în jos și IL-1α și IL-1β induse în celulele mononucleare umane in vitro, fără niciun efect asupra expresiei IL-2, IL-4 și interferon-γ (IFN-γ) (Williams și colab., 2002; Jung și colab., 2004). In vivo analizele profilurilor de transcripție a citokinelor la pacienții psoriazici supuși tratamentului cu IL-10 au demonstrat un efect doar asupra IL-24, un membru al familiei de citokine IL-10 (Jung și colab., 2004). Este posibil ca aceste rezultate divergente să reflecte variația speciilor sau diferențele legate de populațiile specifice de celule. Deși baza moleculară a efectelor imunosupresoare ale IL-10 nu a fost pe deplin elucidată, în majoritatea cazurilor, IL-10 are o profundă capacitate de reglare descendentă a citokinei pro-inflamatorii TNF-α, iar din punct de vedere terapeutic acest lucru pare important având în vedere dovezile dovedite eficacitatea anticorpilor care blochează TNF-α în IBD.
Niveluri stabile de factor de necroză tumorală-α (TNF-alfa), interleukină-1β (IL-1beta) și IL-2 mARN la șoareci C3H hrăniți cu 30% tutun în dieta lor. ARNm extras din intestinul subțire al fiecărui șoarece a fost grupat și analizat prin reacție în timp real cu transcriptază inversă - polimerază (RT - PCR). Rezultatele au fost normalizate la gliceraldehidă-3-fosfat dehidrogenază (GAPDH). Nivelul de exprimare în controlul plantelor a fost stabilit la 100, iar tratamentul cu tutun care exprimă IL-10 - a fost exprimat ca procent din control. IL-10, șoareci hrăniți cu 30% tutun care exprimă IL-10; P - C, șoareci hrăniți cu tutun de control.
Utilizarea tutunului cu conținut scăzut de alcaloizi în acest studiu a permis livrarea cronică de IL-10 la șoareci fără prelucrare extinsă a țesutului vegetal, iar minimizarea procesării are un apel atât în ceea ce privește aspectele legate de costuri, cât și de stabilitatea citokinelor. Nicotina este principalul alcaloid al tutunului, cuprinzând aproximativ 95% din conținutul total de alcaloizi. Deși s-a înregistrat o scădere cu peste 90% a nicotinei în tutunul cu alcaloizi slabi cultivate în câmp și o scădere cu 99,9% folosind camere de creștere, efectele la om ale unor cantități mici de nicotină și chiar și cantități mai mici de alcaloizi minori nornicotină, anatabină și anabazina, administrată zilnic nu este cunoscută (revizuită în Hukkanen și colab., 2005). Alte eforturi de ameliorare convenționale și moleculare pot permite îmbogățirea citokinelor transgenice și scăderea în continuare a alcaloizilor la niveluri care să permită studii clinice cu tutun transgenic (Sato și colab., 2001).
Acest studiu demonstrează, pentru prima dată, capacitatea țesutului transgenic de tutun cu conținut scăzut de transgen, care exprimă IL-10, de a atenua leziunile intestinale la un model de șoarece de IBD și de a inhiba expresia TNF-α direct la locurile de inflamație. Deoarece IL-10, și poate alte citokine terapeutice, exprimate în matricea plantelor sunt biologic active și posedă o rezistență sporită la degradarea gastrointestinală, utilizarea plantelor transgenice atât ca sisteme de exprimare cât și de eliberare poate avea avantaje atractive față de terapiile actuale în IBD. Această abordare pentru a atenua expresia citokinelor pro-inflamatorii din intestin poate deveni o nouă abordare importantă în terapiile topice și luminale ale inflamației intestinale.
Proceduri experimentale
Experimente de deglicozilare
PIL-10 purificat, rIL-10 și EPO recombinant au fost deglicozilați cu PNGază F (New England Biolabs, Pickering, ON) într-un volum de 50 - µL la 37 ° C timp de 2 ore, conform instrucțiunilor producătorului. Proteinele glicozilate au fost separate pe un gel de 12% prin electroforeză pe gel de dodecil sulfat de sodiu - poliacrilamidă (SDS - PAGE) și transferate pe membrane de difluorură de poliviniliden (PVDF). Imunodetecția a fost efectuată cu anticorp policloronal de capră biotinilat anti-IL-10 (R&D Systems, 1: 1000) și anticorp anti-EPO de iepure (1: 1000), urmat de streptavidin-peroxidază de hrean (HRP) (BD Pharmingen, 1: 3000 ) și IgG anti-iepure - HRP (Bio-Rad, 1: 3000). Detectarea a fost efectuată cu reactivi chemiluminescenți ECL (Amersham Biosciences, Quebec, Canada).
Digestia în lichidul gastric și intestinal simulat
rIL-10 a fost obținut ca o soluție stoc de 100 μg/ml (BD Pharmingen). pIL-10 a fost purificat prin cromatografie de ioni metalici imobilizați din plante de tutun transgenice care exprimă gena hIL-10 sub controlul promotorului 35S (Menassa și colab., 2001). rIL-10 și pIL-10 (150 ng) au fost digerate în SGF și SIF (Board of Trustees, 2000) la o concentrație de 1 ng/µL într-un interval de puncte de timp (0 s, 15 s, 30 s, 1 min., 5 min, 15 min și 30 min sau 60 min) la 37 ° C. La fiecare moment, au fost luate 10-ng IL-10 alicote și reacția de digestie a fost oprită prin adăugarea de Na2CO3 la o concentrație finală de 45 m m. Pentru digestia în SGF la pH neutru, SGF a fost neutralizat cu Na2CO3 înainte de efectuarea digestiilor proteice. Probele au fost analizate prin imunoblotare sau prin test imunosorbent legat de enzime (ELISA), așa cum este descris în Menassa și colab. (2001).
Pentru analiza efectului protector al țesutului frunzelor asupra pIL-10, frunzele mature care exprimă pIL-10 au fost liofilizate și măcinate într-o pulbere fină folosind un blender. Pentru fiecare punct de timp, 0,7 g de țesut frunzei au fost amestecate cu 5 ml de SGF sau SIF și reacția a fost stinsă la intervalul corespunzător cu 2 ml de 160 m m Na2CO3. Probele digerate au fost extrase în soluție tampon de extracție [fosfat - soluție salină tamponată, 0,05% (v/v) Tween 20, 2% (g/v) polivinilpolpirolidonă (PVPP), fluorură de fenilmetilsulfonil (PMSF), 1 µg/mL leupeptină, pH 7,4 ] și clarificat prin centrifugare la 13 000 g timp de 15 min la 4 ° C. IL-10 rezidual a fost cuantificat prin ELISA.
Șoareci și studii de hrănire IL-10
O colonie de șoareci B6 a fost întreținută în instalația pentru animale de la Universitatea Western Ontario, ON, Canada. Experimentele pe animale au fost efectuate în conformitate cu ghidurile Consiliului canadian pentru îngrijirea animalelor în conformitate cu protocoalele aprobate de subcomitetul pentru utilizare animalelor din instituția noastră. Șoarecii B6 în vârstă de șase săptămâni au fost hrăniți cu chow obișnuit sau chow obișnuit suplimentat cu tutun 10 sau 20% cu conținut scăzut de nicotină sau cu nicotină normală, liofilizat timp de 7 săptămâni. Grupurile de tratament au constat din trei șoareci care au fost adăpostiți în aceeași cușcă. Grupul de control a fost format din patru șoareci găzduiți împreună. Hrana a fost adăugată în cuști la fiecare 2 zile pentru a ajunge la 5 g pe șoarece pe zi. La sfârșitul a 2 zile, alimentele au fost adăugate în recipientele golite din cușcă. Șoarecii au fost cântăriți individual la începutul experimentului și săptămânal după aceea.
Două colonii de șoareci nuli IL-10 au fost înființate în condiții de barieră și menținute în instalația pentru animale de la Universitatea Western Ontario. Fondator IL - 10 șoareci nul pe originalul C57BL/6 (B6), precum și încrucișați înapoi (n = 10) Tulpinile de fond C3H au fost furnizate cu generozitate de Dr. E. Leiter (Laboratorul Jackson, Bar Harbor, ME, SUA) și derivarea lor a fost descrisă și colab., 2001; Mahler și Leiter, 2002). Pentru hrănirea cu IL-10, semințele dintr-o linie homozigotă IL-10 cu expresie ridicată au fost germinate și crescute într-o cameră de mediu controlat. Frunzele au fost congelate rapid în N2 lichid și liofilizate. Țesutul uscat a fost măcinat, amestecat, analizat pentru concentrația IL-10 prin ELISA (Menassa și colab., 2001) și pentru conținutul de alcaloizi prin cromatografie gazoasă capilară așa cum s-a descris anterior și colab., 1992). Proteina solubilă totală a fost cuantificată folosind metoda Bradford (Bradford, 1976).
Analiza profilelor de citokine la șoareci tratați și netratați
ARN-ul a fost extras din probe de țesut intestinal și splenic folosind reactiv TRIzol (Invitrogen). ARN de la diferite animale din același grup de tratament a fost combinat și 5 µg au fost folosiți pentru transcrierea inversă cu oligo-dT și sistemul de sinteză SuperScript First-Strand pentru reacția în lanț a transcriptazei-polimerazei inverse (RT-PCR) (Invitrogen). Primerii specifici genei au fost proiectați după Overbergh și colab. (2003). PCR-urile au fost efectuate cu LightCycler (Roche) și LC FastStart DNA Master SYBR Green I Kit (Roche). Datele rezultate au fost analizate cu software-ul LightCycler, iar cantitățile relative de ADNc au fost estimate față de o curbă standard calculată din diluții ale aceluiași fragment clonat într-o plasmidă, așa cum este descris de Overbergh și colab. (2003).
analize statistice
Analiza unidirecțională a varianței (anova) sau t‐Testele (distribuție cu o singură coadă) folosind software-ul statistic Statview (SAS, Cary, NC, SUA) au fost utilizate ca fiind adecvate pentru comparații între grupurile de tratament în experimentele de hrănire. Datele au fost colectate din experimente separate în fiecare studiu pentru analize statistice. A P valoarea de 0,05 a fost considerată semnificativă.
- Viermii cu coarne din tutun devin molii de colibri - Extinderea UFIFAS Județul Wakulla
- The Human Trust Vladivostok Review Hollywood Reporter
- Actualizarea importanței fierului pentru sănătatea umană
- Program pentru elementele esențiale ale nutriției umane (Master online)
- Tabelul 1 Postul intermitent ca parte a managementului pentru T2DM de la modele animale la om