* Acest MFA a fost deprioritizat până în momentul în care ies la lumină datele convingătoare necesare umane descrise aici.
REZUMAT
Au existat mai multe ipoteze de lungă durată în cercetările HD care propun o legătură cauzală între energia neregulată și metabolismul în patogeneza HD. Dovezile până în prezent au fost contradictorii și incomplete. Prima prioritate a CHDI în MAE pentru Energetică și Metabolism este de a efectua studii pentru a determina dacă aceste procese sunt perturbate în HDGEC și, dacă da, dacă această tulburare se corelează cu progresia bolii. Dacă această conexiune cauzală de bază nu poate fi demonstrată experimental, CHDI va deprioritiza activitățile și va minimiza resursele pentru această zonă de cercetare. Realizăm un număr mic de studii focalizate care vizează identificarea modificărilor energetice și metabolice în HDGEC-uri și modele animale relevante HD. Dacă se identifică o semnătură HD pentru disfuncția energetică, vom continua studii de urmărire care explorează căile terapeutice din acest domeniu.
VIZIUNEA DE CERCETARE
Un volum mare de literatură sugerează că energia și metabolismul mitocondrial sunt perturbate în HD. Pierderea dramatică în greutate, care nu poate fi explicată de mișcările coreice sau de malnutriție, a fost recunoscută de multă vreme la unii pacienți cu simptome HD, sugerând decuplarea mitocondrială sau o altă problemă energetică. Spectroscopia de rezonanță magnetică nucleară a protonilor a relevat niveluri crescute de lactat în creierul pacienților simptomatici cu HD, indicând o deficiență a fosforilării oxidative. De asemenea, a fost raportată o reducere repetată a CAG în funcție de lungime a raporturilor fosfocreatină/creatină, ATP/fosfocreatină și ATP/ADP în țesuturile periferice. Mai mult, dovezile unei creșteri semnificative a stresului oxidativ și a produselor deteriorate rezultate au fost descrise la pacienții cu manifestare HD și la modelele animale.
Cu toate acestea, o mare parte a lucrării a fost inconsistentă, greu de reprodus sau realizată în modele animale HD cu valoare predictivă necunoscută. Datele umane au fost colectate în mare parte folosind țesuturi periferice sau postmortem, cu puține dovezi din creierul uman viu. Mai mult, două dintre cele mai mari studii clinice de intervenție în HD - care au evaluat beneficiul terapeutic al două suplimente nutritive, coenzima Q10 și creatina, cu presupuse mecanisme de acțiune legate de energie - nu și-au îndeplinit obiectivele de eficacitate și nu au oferit informații suplimentare despre validitate a ipotezei mecanice energetice.
Mitocondriopatiile clasice, cum ar fi sindromul Leigh sau MELAS, implică de obicei o întrerupere dramatică sau completă a uneia sau mai multor componente energetice esențiale și, prin urmare, au fenotipuri foarte pronunțate și timpurii. În timp ce HD împărtășește unele caracteristici cu aceste tulburări, cum ar fi vulnerabilitatea diferențială a ganglionilor bazali, efectele observate în HDGEC sunt mult mai subtile și apar pe o perioadă de timp mult mai lungă. Nu este clar modul în care vânătoarea mutantă își exercită efectele asupra acestor sisteme fie direct (cum ar fi prin interacțiunea cu componentele mitocondriale), fie indirect (de exemplu, prin precipitarea nevoii de niveluri crescute de producție de energie). Prin urmare, prioritatea maximă a CHDI va fi identificarea și caracterizarea mecanismelor moleculare precise responsabile pentru orice disfuncție energetică în HD.
Ca cadru pentru strategia noastră, CHDI a propus trei postulate testabile despre rolul energeticii în HD. În primul rând, prezența proteinei mHTT în celule duce la o cerere crescută de energie printr-un mecanism încă necunoscut. În al doilea rând, la începutul evoluției bolii celulele sunt capabile să facă față acestei cereri crescute prin creșterea producției mitocondriale, dar în timp acest nivel persistent de stres energetic are ca rezultat expunerea cronică la speciile reactive de oxigen (ROS). În al treilea rând, combinația ROS și cererea crescută de energie compromite în cele din urmă fiziologia mitocondrială, sistemele de apărare redox și are ca rezultat niveluri insuficiente de producție energetică. Dacă este corectă, această traiectorie ar putea explica de ce unele semne clinice majore HD apar adesea mai târziu în viață. Și pentru că neuronii au cereri de energie mai mari decât alte tipuri de celule, consecințele unei astfel de dereglări ar fi evidente în special în neuroni.
CHDI lucrează cu colegii la studii esențiale pentru a testa aceste postulate prin investigarea a trei mecanisme biologice care probabil ar juca un rol în toate - toxicitatea mediată de niveluri ridicate de ROS, homeostazia energetică în celulă și fiziologia mitocondrială. Ne vom strădui să folosim metode și tehnologii care să evite confuziile experimentale care au împiedicat prea des câmpul și să optimizăm sensibilitatea testelor bine validate pentru a detecta uneori semnale marginale. Vom continua să folosim instrumente genetice, farmacologice și clinice pentru a înțelege mai bine natura precisă a disfuncției energetice presupuse în HD.
În timp ce multe aspecte ale energeticii sunt bine conservate între specii, rămâne neclar cât de utile vor fi modelele genetice preclinice actuale ale HD fie în elucidarea naturii unei disfuncții energetice presupuse de hunttin, fie în prezicerea eficacității intervențiilor candidate. Prin urmare, ori de câte ori este posibil, ne vom concentra studiile experimentale pe oameni.
Intenția noastră este de a finaliza cu succes schema noastră experimentală și de a genera un corp de dovezi suficient de convingător pentru a ne extinde abordarea către un MAE mai larg, rațional și bazat pe mecanisme pentru Energetică și Metabolism la CHDI. Acest lucru va necesita un semnal clar, specific, central la începutul evoluției bolii, indicând faptul că disfuncția energetică joacă un rol fundamental în fiziopatologia HD.
Scopul nostru este de a genera dovezi detaliate care identifică abordări terapeutice raționale pentru HD în câmpul disfuncției energetice. Vom modela apoi disfuncția la rozătoarele HD, vom interveni genetic sau farmacologic pentru a corecta fenotipurile aberante și apoi vom continua spre dezvoltarea clinică. Cu toate acestea, în cele din urmă, nu vom ști încă dacă deficitele energetice sunt cauzale în HD până când nu avem un tratament terapeutic care funcționează așa cum se intenționează la oameni și vom vedea că evoluția bolii lor a fost modificată cu succes.
DETALII PROGRAMUL DE CERCETARE
Homeostazia energetică
Cele mai proeminente modificări metabolice ale HDGEC pre-simptomatice și simptomatice sunt pierderea în greutate, modificările specifice regiunii în utilizarea glucozei cerebrale și a nivelurilor de lactat și activitățile aberante ale enzimelor mitocondriale implicate în metabolismul glucozei. Studiile preclinice efectuate pe modele de șoarece HD indică, de asemenea, o reglare metabolică compromisă. Cu toate acestea, ceea ce este mai puțin clar este exact modul în care un astfel de impact ar putea afecta neuronii la persoanele cu HD.
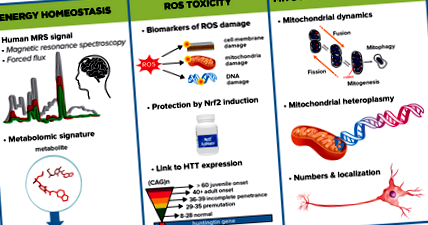
Rezumat grafic care descrie unele dintre subzonele cheie pe care MAE pentru Energetică și Metabolism le va investiga pentru a determina afectarea energetică în HD și abordări pentru explorarea mecanismelor responsabile.
Deși s-a crezut mult timp că mitocondriile nu joacă un rol în semnalizarea neuronală, se știe acum că o funcție centrală a oxidării mitocondriale în neuroni este de a furniza energie pentru transmiterea neuronală. Prin urmare, este de așteptat ca afectarea metabolismului energiei mitocondriale să afecteze în mod direct transmisia neuronală.
Lucrările recente susținute de CHDI au folosit MRS pentru a măsura rata metabolică in vivo în neuroni și glia în două modele de șoarece HD. Tehnica implică etichetarea glucozei cu carbon-13 și urmarea acestei etichete prin ciclul acidului tricarboxilic pentru a urmări metabolismul energiei mitocondriale într-un voxel ales al scanării cerebrale. 13 C MRS este deosebit de atractiv, deoarece este complet traductibil între șoareci și oameni.
În studiile MRS la șoarece, atât modelele R6/2, cât și modelele Q175 HD au arătat reduceri semnificative ale metabolismului energetic neuronal în striat, precum și cortex și talamus, înainte de apariția fenotipurilor comportamentale; aceste reduceri au devenit pronunțate pe măsură ce fenotipul bolii a progresat. Nu s-au observat astfel de reduceri în metabolismul celulelor gliale. Aceste rezultate sugerează că disfuncția energetică a creierului este extrem de sensibilă la prezența vânătorii mutante chiar înainte de apariția fenotipurilor evidente și, deoarece această disfuncție nu este văzută în glia, se datorează pierderii funcției neuronale.
MRS cu flux forțat este o tehnică asociată care se efectuează după ce crește mai întâi cererea de energie pe creier pentru a determina dacă activitatea metabolică mitocondrială crește în mod adecvat sub acest stres. CHDI intenționează să utilizeze MRS cu flux forțat în creierele HD umane vii pentru a măsura o varietate de metaboliți energetici. Vom evalua corelațiile dintre diferențele observate la stadiul bolii, severitatea bolii, lungimea repetată a CAG și specificitatea regională (de exemplu, striatum vs cortex) sau de tip celular (de exemplu, MSN vs glia) în creier.
Acest studiu ne va permite să stabilim dacă energia mitocondrială este importantă în HD și să înțelegem ce elemente specifice ale mecanismului sunt afectate, cum ar fi glicoliza, complexele de transport de electroni, ciclul de glutamat/glutamină perturbat, printre altele. Schimbările robuste observate în cadrul acestei paradigme ar oferi o ancoră în biologia umană pentru a modela acest aspect al bolii. Cel mai important, dacă se descoperă deficite, vom explora posibilitățile terapeutice și vom descoperi potențialii biomarkeri ai bolii. De exemplu, studiile de urmărire ar explora dacă strategiile de scădere a HTT normalizează disfuncția energetică. Pe de altă parte, eșecul de a dezvălui diferențele energetice mitocondriale în creierele HD folosind această tehnică ar indica inutilitatea și eliminarea consecințelor acestui AMF din portofoliul CHDI.
Cu toate acestea, este probabil ca rezultatele acestui experiment uman să nu fie atât de ușor de interpretat; având în vedere cât de prevalente sunt anomaliile energetice în boala neurodegenerativă, este posibil să găsim unele diferențe în ceea ce privește energia HD, indiferent dacă sunt cauzale, compensatorii sau doar epifenomene. Poate că o aspirație mai realistă pentru acest studiu este identificarea unei semnături HD a metaboliților care au crescut sau au scăzut.
Toxicitate ROS
Stresul oxidativ - un dezechilibru între producerea ROS și sistemul de apărare antioxidant - a fost implicat în patogeneza HD atât la om, cât și la modelele animale. Independent, două grupuri au raportat creșterea markerilor produselor de deteriorare a stresului oxidativ din plasmă și sânge la pacienții cu manifestare HD. În mod concordant, s-a constatat o reducere a sistemelor antioxidante, iar aceste modificări s-au corelat cu progresia bolii. Cu toate acestea, dovezile că reducerea ROS pot încetini progresia bolii sunt încă lipsite și în principal excluse de lipsa unor metode cantitative sensibile și specifice de urmărire a diferitelor tipuri de daune ROS. În plus, o serie de factori de confuzie, cum ar fi fumatul, vârsta, sexul, dieta și procedurile de colectare a probelor influențează profund măsurătorile ROS.
CHDI dezvoltă și validează metode sensibile bazate pe spectrometrie de masă pentru a măsura produsele moleculare ale efectelor dăunătoare cauzate de ROS asupra proteinelor, lipidelor și ADN-ului. Folosind aceste teste de subprodus ROS, CHDI și colegii vor investiga creșterea daunelor ROS în HDGEC și în modelele animale de HD. Acest panou cantitativ in vivo de markeri de stres oxidativ poate fi apoi corelat cu neurodegenerarea și progresia fenotipului atât în modelele animale, cât și în HDGEC. Odată stabilite și validate, aceste teste de subprodus ROS vor fi puse la dispoziția comunității HD pentru a evalua stresul oxidativ.
Până în prezent, terapiile antioxidante testate în studiile clinice nu au arătat niciun beneficiu terapeutic în vreo boală și este puțin probabil ca un singur antioxidant să fie suficient pentru a diminua efectele ROS în HD. Dacă aceste studii de marker ROS propuse identifică o creștere a produselor de deteriorare a ROS la persoanele cu HD, cea mai promițătoare cale terapeutică ar fi probabil creșterea coordonată a apărării antioxidante endogene. CHDI intenționează să investigheze două posibile ținte terapeutice de-a lungul acestor linii: NRF2, o genă care induce răspunsuri antioxidante înnăscute la stresul oxidativ și ATM kinază, care este implicată în răspunsul la deteriorarea ADN și prezintă activitate crescută în HD.
Dezvoltăm activatori NRF2 cu penetrare cerebrală și inhibitori ATM și vom evalua efectul acestora asupra panoului markerului de stres oxidativ, a fluxului forțat MRS, a comportamentului și a altor măsuri de rezultat. O altă cale de investigație este dacă alte intervenții farmacologice, cum ar fi cele care scad nivelul mutantului sau nivelul total de HTT, pot reduce leziunile ROS, măsurate de panoul markerului de stres oxidativ.
De asemenea, colaborăm cu colaboratori pentru a dezvolta markeri farmacodinamici pentru activarea NRF2 folosind șoareci reporter ca o condiție prealabilă pentru evaluarea potențialului terapeutic. Folosind atât șoarecii transgenici NRF2, cât și livrarea virală a NRF2, acești colaboratori abordează dacă supraexprimarea NRF2 în neuroni sau glia poate ameliora fenotipul.
Fiziologia mitocondrială
Dinamica mitocondrială - procese precum fuziunea și fisiunea mitocondrială, traficul, biogeneza și mitofagia - sunt cruciale pentru funcția organului și homeostazia. Fragmentarea mitocondrială și apoptoza crescută au fost raportate în prezența huntingtinei mutante în neuroni atât în modelele celulare cât și la cele animale de HD, oferind dovezi pentru o legătură patologică între huntina mutantă și dinamica mitocondrială anormală. Mutațiile cumulative ale ADN-ului mitocondrial ar putea fi, de asemenea, implicate în patologia bolii.
CHDI lucrează cu colegii să caracterizeze în continuare dinamica mitocondrială și semnăturile metabolice în țesutul cerebral model HD și diferite țesuturi periferice HDGEC din proiectul EHDN Multi-Tissue Monitoring (MTM) De asemenea, colaborăm cu alți colaboratori pentru a examina rolul fuziunii și fisiunii mitocondriale în HD. La modelele celulare, reducerea fisiunii mitocondriale îmbunătățește viabilitatea celulară, sugerând că moleculele care promovează acest proces ar putea avea potențial terapeutic. Testăm această idee in vivo folosind un model de șoarece în care Mff, receptorul unei proteine centrale la fisiunea mitocondrială, a fost inactivat. Acești șoareci au cardiomiopatie extinsă și disfuncție mitocondrială care pot fi salvate odată cu îndepărtarea concomitentă a unei proteine care joacă un rol central în fuziunea mitocondrială. Aceste descoperiri indică faptul că echilibrul dintre cele două procese este important atât în fiziologia mitocondrială, cât și în menținerea funcției țesuturilor și a organelor. Următorul pas al proiectului este explorarea rolului Mff într-un model de mouse HD.
Un alt proiect examinează dacă și cum mutațiile și variația numărului de copii ale ADN-ului mitocondrial ar putea fi implicate în vârsta de debut a HD, progresia bolii, severitatea sau alte caracteristici patologice prin secvențierea ADN-ului mitocondrial din HDGEC și compararea acestora cu cele ale participanților la 1000 de genomi Proiect. Rezultatele timpurii sugerează că liniile celulare derivate din HDGEC au o creștere semnificativă a heteroplasmelor - combinații de ADN mitocondrial mutant și nemutat în cadrul oricărei celule.
- Fruta Planta mărește cu adevărat metabolismul și ajută la reducerea poftei de mâncare
- Mancarea nedorita iti incetineste metabolismul
- Fumatul de marijuana îți mărește metabolismul Mergeți-l pe Alice!
- Crowdfunding to Fresh Prime Keto Recenzii înșelătorie sau LEGIT Sporiți-vă rata de metabolizare! CUMPĂRĂ ACUM pe
- Metabolizarea brânzeturilor modul în care consumul de brânză vă poate ajuta să slăbiți - Food24
