Departamentul de Urologie, Spitalul Universitar Bicetre, Asistență Publică - Hôpitaux de Paris, APHP, Universitatea Paris - Saclay, Le Kremlin - Bicetre, Franța
Corespondență: Cedric Lebacle, Departamentul de Urologie, Spitalul Universitar Bicetre, 78 rue du General Leclerc, 94270, Le Kremlin - Bicetre, Franța.
Departamentul de Urologie, Spitalul Universitar Pontchaillou, Rennes, Franța
Departamentul de Urologie, Spitalul Universitar Bordeaux, Spitalul Pellegrin, Bordeaux, Franța
Rețeaua franceză de cercetare privind cancerul de rinichi UroCCR, Bordeaux, Franța
Departamentul de Medicină, Gustave Roussy, Universitatea Paris-Saclay, Villejuif, Franța
Departamentul de Oncologie, Centrul Eugen Marquis, Rennes, Franța
Departamentul de Oncologie Medicală, Spitalul Universitar din Bordeaux, Spitalul Saint - Andre, Bordeaux, Franța
Departamentul de Urologie, Spitalul Saint-Joseph, Paris, Franța
Departamentul de Urologie, Nouvel Hopital Civil, Spitalul Universitar Strasbourg, Strasbourg, Franța
Departamentul de Urologie, Nouvel Hopital Civil, Spitalul Universitar Strasbourg, Strasbourg, Franța
Departamentul de Oncologie, Spitalul Hautepierre, Spitalul Universitar Strasbourg, Strasbourg, Franța
Unitatea de cercetare clinică Paris - Sud, Departamentul de Statistică, Spitalul Universitar Bicetre, Asistență Publică - Hôpitaux de Paris, Le Kremlin - Bicêtre, Franța
Unitatea de cercetare clinică Paris - Sud, Departamentul de Statistică, Spitalul Universitar Bicetre, Asistență Publică - Hôpitaux de Paris, Le Kremlin - Bicêtre, Franța
Departamentul de Urologie, Spitalul Mont de Marsan, Mont de Marsan, Franța
Departamentul de Medicină, Gustave Roussy, Universitatea Paris-Saclay, Villejuif, Franța
Departamentul de Urologie, Spitalul Universitar Bicetre, Asistență Publică - Hôpitaux de Paris, APHP, Universitatea Paris - Saclay, Le Kremlin - Bicetre, Franța
Corespondență: Cedric Lebacle, Departamentul de Urologie, Spitalul Universitar Bicetre, 78 rue du General Leclerc, 94270, Le Kremlin - Bicetre, Franța.
Departamentul de Urologie, Spitalul Universitar Pontchaillou, Rennes, Franța
Departamentul de Urologie, Spitalul Universitar Bordeaux, Spitalul Pellegrin, Bordeaux, Franța
Rețeaua franceză de cercetare privind cancerul de rinichi UroCCR, Bordeaux, Franța
Departamentul de Medicină, Gustave Roussy, Universitatea Paris-Saclay, Villejuif, Franța
Departamentul de Oncologie, Centrul Eugen Marquis, Rennes, Franța
Departamentul de Oncologie Medicală, Spitalul Universitar din Bordeaux, Spitalul Saint - Andre, Bordeaux, Franța
Departamentul de Urologie, Spitalul Saint-Joseph, Paris, Franța
Departamentul de Urologie, Nouvel Hopital Civil, Spitalul Universitar Strasbourg, Strasbourg, Franța
Departamentul de Urologie, Nouvel Hopital Civil, Spitalul Universitar Strasbourg, Strasbourg, Franța
Departamentul de Oncologie, Spitalul Hautepierre, Spitalul Universitar Strasbourg, Strasbourg, Franța
Unitatea de cercetare clinică Paris - Sud, Departamentul de Statistică, Spitalul Universitar Bicetre, Asistență Publică - Hôpitaux de Paris, Le Kremlin - Bicêtre, Franța
Unitatea de cercetare clinică Paris - Sud, Departamentul de Statistică, Spitalul Universitar Bicetre, Asistență Publică - Hôpitaux de Paris, Le Kremlin - Bicêtre, Franța
Departamentul de Urologie, Spitalul Mont de Marsan, Mont de Marsan, Franța
Departamentul de Medicină, Gustave Roussy, Universitatea Paris-Saclay, Villejuif, Franța
Abstract
Obiectiv
Pentru a evalua capacitatea axitinibului neoadjuvant de a reduce dimensiunea carcinomului cu celule renale T2 (RCC) pentru trecerea de la o nefrectomie radicală (RN) la o indicație de nefrectomie parțială (PN), oferind conservarea funcției renale.
Pacienți și metode
Pacienții cu RCC cu celule clare cT2aN0NxM0, considerate neadecvate pentru PN, au fost înrolați într-un studiu prospectiv, multicentric, de fază II (AXIPAN). Axitinib 5 mg și până la 7-10 mg a fost administrat de două ori pe zi, timp de 2-6 luni înainte de operație, în funcție de răspunsul radiologic. Rezultatul principal a fost numărul de pacienți care au primit PN pentru o tumoare
Rezultate
Au fost înscriși 18 pacienți. Dimensiunea mediană (interval) a tumorii și scorul de nefrometrie RENAL au fost de 76,5 (70-98) mm și respectiv 11 (7-11). După tratamentul neoadjuvant cu axitinib, 16 tumori au scăzut în diametru, cu o reducere medie a dimensiunii de 17% (64,0 vs 76,5 mm; P
Concluzie
Axitinibul neoadjuvant în cT2 ccRCC este fezabil și, chiar și cu o scădere modestă a dimensiunii, a permis o contracție a tumorii
Abrevieri
Introducere
Majoritatea CCR sunt diagnosticate într-un stadiu localizat 1. Nefrectomia radicală (RN) este recomandată în cazurile de tumori mari (> 7 cm) sau foarte complexe atunci când există un rinichi contralateral normal 2. Nefrectomia parțială (PN) păstrează mai bine funcția renală în comparație cu RN și ar putea scădea incidența evenimentelor cardiovasculare și îmbunătăți supraviețuirea 3, 4 .
Nefrectomia parțială este fezabilă în unele tumori T2 5, dar este o provocare tehnică și nu este considerată standardul de îngrijire. O metaanaliză recentă a arătat o recurență mai scăzută și o mortalitate mai mică specifică cancerului pentru PN, dar mortalitate identică pentru toate cauzele între PN și RN, respectiv 6; prin urmare, există o rațiune pentru a pune în scenă tumorile renale mari (cT2) pentru a putea efectua PN și pentru a păstra parenchimul renal.
Inhibitorii tirozin kinazei (TKI) sunt utilizați pentru a trata RCC metastatic și pot reduce dimensiunea tumorii primare 7-10. Din acest motiv, TKI-urile au fost investigate în cadrul neoadjuvantului pentru a facilita intervenția chirurgicală în tumorile avansate local 8, 11. Sunitinib, administrat în două cicluri, a fost cel mai studiat medicament 12, 13. Axitinib este un receptor al factorului de creștere epidermal vascular oral 1–3, c - KIT și inhibitor al receptorului factorului de creștere derivat din trombocite aprobat în 2012 pentru tratarea RCC metastatică după eșecul terapiei sistemice anterioare. Axitinib este teoretic mai puternic decât TKI-urile din prima generație în ceea ce privește inhibarea receptorilor factorului de creștere epidermică vasculară, motiv pentru care a fost de interes în prezentul studiu. Axitinib a obținut o rată de răspuns obiectivă de 19% într-un studiu de fază III față de sorafenib în terapia de linia a doua a pacienților cu CCR metastatic 14 .
Scopul studiului de față a fost de a evalua capacitatea axitinibului neoadjuvant de a reduce tumorile renale localizate cT2 pentru care PN a fost considerat inițial „neadecvat” conform ghidurilor.
Pacienți și metode
Studiul a fost conceput ca un studiu open-label, non-randomizat, multicentric, de fază II și a fost înregistrat la clinictrials.gov (NCT02597322). Toți pacienții au prezentat o tumoare renală cT2a N0NxM0 conform clasificării TNM din 2009. După obținerea consimțământului pacientului, s-a efectuat sistematic o biopsie pentru a asigura prezența unei componente a celulelor limpezi. Pacienții eligibili au trebuit să aibă funcție renală normală (Modificarea dietei în boala renală [MDRD] GFR estimat [eGFR] ≥60 ml/min) și un statut de performanță al Grupului de Oncologie Cooperativă din Est de 0 sau 1. Decizia că tumora nu este adecvat pentru PN a fost luat în conformitate cu practica obișnuită, liniile directoare actuale și experiența medicului și a fost discutat în timpul ședinței multidisciplinare a consiliului tumorilor RCC. Comitetul de etică al comitetului de revizuire instituțională a aprobat obținerea consimțământului informat înainte de înscrierea pacientului.
Principalele criterii de excludere au inclus dovezi ale bolii metastatice la CT corporală, hipertensiune arterială necontrolată preexistentă sau boli cardiovasculare semnificative, utilizarea curentă sau necesitatea anticipată de tratament cu medicamente care au cunoscut interacțiuni CYP3A4 sau CYP1A2 și cerința terapiei anticoagulante cu vitamina K orală. antagoniști.
Axitinib 5 mg a fost administrat de două ori pe zi, cu titrarea dozei efectuată în funcție de tolerabilitatea individuală, așa cum este practica standard. Pacienții care au tolerat axitinib fără evenimente adverse (EA)> gradul 2 pe o perioadă de 2 săptămâni au avut doza crescută progresiv la 7 mg de două ori pe zi și la maximum 10 mg de două ori pe zi.
Pacienții au fost urmăriți utilizând CT renală la fiecare 2 luni. Durata totală a tratamentului cu axitinib a variat de la 2 la 6 luni în funcție de răspunsul radiologic. Dacă dimensiunea tumorii a crescut, pacientul a fost tratat cu RN. Dacă dimensiunea tumorii a rămas stabilă sau a scăzut, axitinibul a fost urmărit.
Ultima imagine CT înainte de tratamentul chirurgical a ghidat decizia chirurgului între tratamentul standard (RN) și cel experimental (PN). Decizia finală cu privire la tipul de intervenție chirurgicală a fost lăsată la latitudinea chirurgului, în funcție de răspunsul tumoral cu axitinib și de expertiza sa. PN a fost efectuat folosind o abordare deschisă sau asistată de robot, în funcție de mediul de lucru al chirurgului. Centrele selectate au inclus chirurgi experimentați obișnuiți cu PN complexe.
Măsura principală a rezultatului a fost numărul de pacienți cărora li s-a administrat PN pentru o tumoră cT1 sd, interval interquartil sau interval pentru variabilele cantitative. Modificările variabilelor măsurate, cum ar fi diametrul tumorii, scorul de nefrometrie RENAL și eGFR au fost analizate folosind testul Wilcoxon cu rang semnat, cu P
Rezultate
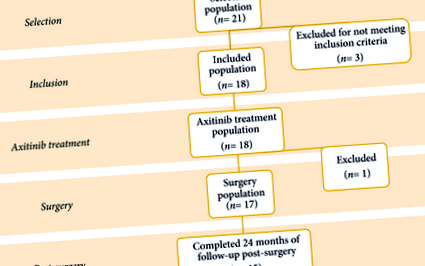
Au fost înrolați un total de 18 pacienți (Fig. 1), inclusiv șapte femei și 11 bărbați, cu o vârstă medie (interval) de 60 (36-83) ani. Toți pacienții au fost supuși biopsiei tumorii renale înainte de includerea în studiu. Caracteristicile pacientului și ale tumorii sunt detaliate în Tabelul 1. Dimensiunea mediană (interval) a tumorii inițiale a fost de 76,5 (70-98) mm, iar scorul mediu (interval) de nefrometrie RENAL a fost 11 (7-11). Nivelul mediu al creatininei serice a fost de 0,8 mg/dL, iar eGFR a fost de 99,8 mL/min/1,73 m 2. Clasele Societății Internaționale de Patologie Urologică au fost II, III și IV la 14, 3 și respectiv 1 pacient.
| Caracteristică | |
| Vârstă, medie ± sd ani | 60,4 ± 9,7 |
| Bărbați | 11 |
| femei | 7 |
| IMC, mediană (interval) kg/m 2 | 24 (19-39) |
| Starea de performanță ECOG, n | |
| 0 | 16 |
| 1 | 2 |
| Nivelul inițial al creatininei, medie ± sd mg/dL | 0,8 ± 0,2 |
| MDRD GFR, medie ± sd mL/min/1,73 m 2 | 99,8 ± 29,4 |
| Dimensiunea tumorii inițiale, mediană (interval) mm | 76,5 (70-98) |
| Scorul de nefrometrie RENAL de bază, mediană (min - max) | 11 (7-11) |
| Gradul de bază al tumorii de biopsie, n | |
| 2 | 14 |
| 3 | 3 |
| 4 | 1 |
- IMC, indicele de masă corporală; ECOG, Grupul de Oncologie Cooperativă din Est; MDRD, Modificarea dietei în bolile renale.
Axitinib a fost administrat preoperator timp de 2, 4 și 6 luni la 12, trei și, respectiv, trei pacienți. Doza de axitinib a rămas la 5 mg de două ori pe zi la 12 pacienți, a fost crescută la 7 mg de două ori pe zi la doi pacienți, a fost crescută la 10 mg de două ori pe zi la trei pacienți și a scăzut la 3 mg de două ori pe zi la un singur pacient. Intervalul mediu (intervalul interquartilei [IQR]) de la întreruperea tratamentului până la intervenția chirurgicală a fost de 6 (3-10) zile.
Efectele axitinibului asupra dimensiunii tumorii sunt rezumate în Tabelul 2 și Fig. S1. Diametrul tumorii a scăzut la 16 pacienți. Dimensiunea maximă a tumorilor a fost semnificativ mai mică la sfârșitul tratamentului decât la momentul inițial (64 vs 76,5 mm; P Tabelul 2. Rezultatele tratamentului cu Axitinib
Un total de 17 pacienți au fost operați. Rezultatul primar a fost considerat atins la 12 pacienți (67%) care au suferit PN pentru tumori cT1 la 7 cm după tratament. Variabilele chirurgicale sunt rezumate în Tabelul 3.
Discuţie
Utilizarea TKI a crescut supraviețuirea după RCC metastatic 15, 16; cu toate acestea, răspunsul complet este rar, iar răspunsul parțial este observat doar la 31% dintre pacienți 7. A existat un anumit interes în utilizarea TKI înainte de operație și mai multe studii retrospective au arătat rate de răspuns semnificative (Tabelul S3). Scăderea dimensiunii tumorii primare este de obicei limitată, totuși și nu este clar modul în care tratamentele neoadjuvante pot facilita extirparea tumorilor renale complexe. Acest lucru sugerează că, în astfel de cazuri complexe, tratamentul neoadjuvant nu trebuie considerat o opțiune standard, ci mai degrabă o discuție de la caz la caz cu un urolog cu experiență în ceea ce privește posibilitatea de a efectua PN.
În prezentul studiu de fază II, am arătat că axitinibul neoadjuvant a atins o rată de răspuns parțială de 22% în conformitate cu RECIST, cu 89% dintre pacienți care se confruntă cu contracția tumorii. Mai mult, scorul de nefrometrie RENAL a scăzut în 46% din cazuri. Majoritatea pacienților au suferit în cele din urmă PN, ceea ce sugerează că axitinibul ar putea face posibilă efectuarea PN în cazurile în care inițial a fost considerată nerecomandată conform ghidurilor.
Rata de răspuns RECIST de 22% (interval 1-46%) a fost în conformitate cu alte studii TKI 17. Contracția tumorii a fost similară cu cea a altor terapii vizate cu care reducerea mediană a diametrului tumorii a variat de la 8% la 28%, comparativ cu 17% în prezentul studiu. Rata de realizare a PN (89%) a fost mai mare decât în alte publicații 17-22 .
Chiar dacă studiul a fost conceput pentru a evalua rata finală a PN pentru tumorile 23 .
Mai mulți agenți, cum ar fi bevacizumab, sorafenib, sunitinib și pazopanib, au fost utilizați în cadrul pre-chirurgical la pacienții cu RCC metastatic (Tabelul S3). Rini și colab. 20 au efectuat un studiu de fază II al pazopanibului neoadjuvant la 25 de pacienți cu tumori renale cu complexitate ridicată. Ei au raportat o scădere a scorului de nefrometrie RENAL la 71% și o reducere a volumului tumorii la 92% dintre pacienți. Un PN a fost efectuat la 20 din cei 25 de pacienți (80%). Karam și colab. 17 au prezentat un studiu de fază II al axitinibului neoadjuvant la 24 de pacienți cu RCC cu celule clare nemetastatice cT3a pentru a investiga siguranța și eficacitatea reducerii tumorilor renale. După 12 săptămâni de axitinib, reducerea mediană a diametrului tumorii renale primare a fost de 28,3%, 45,8% dintre pacienți au avut un răspuns parțial conform RECIST și 21% dintre pacienți au suferit PN. Acest studiu a fost limitat de faptul că autorii nu au oferit un scor de nefrometrie RENAL care ar putea ajuta la definirea abordării chirurgicale mai bune pentru efectuarea PN și perioada de tratament cu 12 săptămâni pre-specificată cu axitinib poate să nu fi fost optimă. În studiul prezent cu axitinib, 16 pacienți au prezentat contracție tumorală și 89% dintre pacienți au suferit PN.
Rezultatele mai bune obținute cu axitinib neoadjuvant ar putea fi legate de mai mulți factori. În primul rând, toți pacienții au avut histologie cu celule clare, documentată cu biopsie înainte de includerea în studiu. Este clar că histologia celulelor răspunde la TKI. În al doilea rând, terapia preoperatorie a fost administrată pentru o perioadă suficientă de 2-6 luni, ceea ce ar fi putut maximiza beneficiile expunerii la medicamente. În al treilea rând, având în vedere posibilitatea de titrare a dozei, cinci pacienți au avut o doză crescută de axitinib. În al patrulea rând, mecanismul de acțiune al axitinibului ar putea conferi un răspuns mai bun în tumoarea primară în comparație cu alte TKI disponibile 9, 10. În al cincilea rând, răspunsul tumorii renale primare este probabil diferit în contextul localizat, în comparație cu setarea metastatică, unde au fost efectuate cele mai multe studii neoadjuvante sau pre-chirurgicale (Tabelul S3).
Axitinib a fost bine tolerat în general, iar toxicitățile au fost ușor de gestionat. Nu au existat AE de gradul 4 sau de gradul 5 și niciuna dintre SAE nu a dus la întreruperea axitinibului.
Evaluarea patologică a arătat că 41% dintre aceste tumori cT2 au fost în cele din urmă pT3a, 47% dintre tumori au fost de grad înalt și 11% au avut o marjă chirurgicală pozitivă. Aceste rezultate patologice pot explica ratele de progresie de 22% ale bolii metastatice la urmărirea de 2 ani.
Rezultatele actuale trebuie confirmate având în vedere numărul mic de pacienți incluși în studiu și lipsa unui braț de control. Alte studii neoadjuvante cu terapii imunomodulatoare vor raporta noi rezultate cu nivolumab (NCT03055013, NCT02595918), pembrolizumab (NCT02212730), pembrolizumab și crioablare urmate de nefrectomie (NCT03189186) și durvalumab2006 cu sau fără.
În concluzie, axitinibul neoadjuvant este fezabil și chiar și cu o scădere modestă a dimensiunii, ar putea favoriza PN față de RN în tumorile renale localizate cT2 de bază. PN a rămas, totuși, extrem de complex, necesitând suficientă expertiză chirurgică și informații despre pacienți cu privire la o posibilă morbiditate crescută. Cu toate acestea, studiul de față poate sprijini discuția de la caz la caz cu urologii experimentați pentru a considera axitinibul ca o opțiune pentru neoadjuvant în acest cadru. Sunt justificate studii suplimentare pentru a evalua impactul asupra recurenței și supraviețuirii generale.
Mulțumiri
Mulțumim Unității de Cercetare Clinică a Spitalelor Universității Paris Sud pentru gestionarea datelor și analize statistice și Pfizer pentru sprijinirea studiului printr-o subvenție. AP-HP a fost organizația de sponsorizare.
Conflict de interese
Dr. Albiges raportează consultanță pentru Novartis, Bristol - Myers Squibb, Amgen, Ipsen, Roche, Pfizer, Astellas Pharma și Merck, în afara lucrării depuse; Dr. Escudier raportează onorariul primit pentru consultanță și prelegere de la Pfizer, BMS, Novartis, Ipsen, Roche, Oncorena, în afara lucrării depuse; Dr. Laguerre raportează taxele personale de la Pfizer, în afara lucrării trimise; Dr. Patard raportează subvenții de la Pfizer, în timpul desfășurării studiului; Dr. Lebacle raportează subvenții de la Astellas, în afara lucrării depuse; Toți ceilalți autori nu au nimic de dezvăluit.
Figura S1. Scăderea relativă a diametrului tumorii (%). Răspuns parțial de RECIST în roșu.
Tabelul S1. Patologia finală.
Tabelul S2. Descrierea evenimentelor adverse (AE).
Tabelul S3. Rezultatele studiilor de terapie țintită preoperatorie pentru carcinomul cu celule renale (adaptat după Karam și colab. 17).
Vă rugăm să rețineți: editorul nu este responsabil pentru conținutul sau funcționalitatea oricăror informații de susținere furnizate de autori. Orice întrebări (altele decât conținutul lipsă) ar trebui să fie adresate autorului corespunzător pentru articol.
- Fără fructe în faza 2 - Când să nu mănânci fructe pe P2 din dieta hCG
- Studiu clinic asupra bolii renale în fază finală pe dializă Dieta terapeutică - Registrul studiilor clinice
- Efectele clinice ale tratamentului dietetic profilactic asupra pietrelor renale - ScienceDirect
- Efectele înlocuirii parțiale și complete a făinii de soia cu făină de bumbac asupra creșterii, furajelor
- Acoperiri Gratuite Efect full-text al tratamentului termic asupra microstructurii și compoziției fazei