1 Laborator de biologie clinică și farmacogenomică și Centrul de cercetare clinică și genomică, Institutul de medicină orientală, Universitatea Kyung Hee, 26 Kyungheedae-ro, Dongdaemun-gu, Seoul 130-701, Republica Coreea
2 Departamentul de Medicină Preventivă, Colegiul de Medicină Orientală, Universitatea Kyung Hee, 26 Kyungheedae-ro, Dongdaemun-gu, Seoul 130-701, Republica Coreea
Abstract
1. Introducere
Obezitatea datorată dezechilibrului consumului și consumului de energie a atins proporții epidemice în unele părți ale lumii. Pe lângă masa mai mare de grăsime și greutatea corporală [1], obezitatea este asociată cu un risc mai mare de probleme de sănătate, cum ar fi bolile cardiovasculare, rezistența la insulină și diabetul zaharat, hiperlipidemia, artroza, multe forme de cancer și stresul psihologic [2, 3].
OB-1 constă din Semințe de Benincasae, Laminaria japonica Areschon., Pini Folium, Moli Folium, Citrus aurantium Linn. Și Planta efedra (Materia medica, ISBN: 8985897373). Semințe de Benincasae este un diuretic care a fost folosit pentru a elimina toxinele și edemele din organism încă din primele timpuri. Laminaria japonica Areschon sa raportat că are un efect anti-obezitate [4]. Se știe că Pini Folium crește metabolismul lipidic seric și Moli Folium suprimă obezitatea. De asemenea, s-a raportat că Citrus aurantium Linn crește rata metabolică bazală, acționează ca diuretic și reduce activitatea lipazei [5]. Planta efedra este un medicament anti-obezitate bine cunoscut care reduce greutățile corporale [6].
Modificările induse de obezitate ale țesutului adipocitar au ca rezultat modificarea expresiei sau funcției hormonilor endocrini importanți precum leptina și adiponectina. Nivelurile de leptină în post sunt remarcabil crescute în adipocite de la indivizi obezi, iar expresia genică a acestuia este semnificativ crescută la șobolanii cu obezitate indusă de dietă [1, 7]. Spre deosebire de leptină, adiponectina este redusă în țesutul adipocitar de la indivizi obezi [8].
AMPK este cunoscut ca o moleculă cheie care reglează echilibrul energetic, greutatea corporală, aportul de alimente și echilibrul metabolic al lipidelor și glucozei. Activarea AMPK schimbă celulele de la consumul de ATP la procesele active de producere a ATP, cum ar fi acidul gras și oxidarea glucozei. Din aceste motive, AMPK a devenit centrul multor studii recente ca țintă terapeutică a bolilor metabolice [9-11].
2. Metode și materiale
2.1. Pregătirea OB-1
Șase ierburi, Semințe Benincasae, Laminaria japonica Areschon, Pini Folium, Moli Folium, Citrus aurantium Linn, și Planta efedra, au fost cumpărate de la Omniherb (Gyeong Buk, Coreea) și imersate în 1 L de 80% etanol și apoi sonicate timp de 30 de minute. Extractul rezultat a fost filtrat printr-un filtru de sticlă folosind o pompă de vid. S-a folosit un evaporator rotativ sub vid (Eyela, Japonia) pentru a concentra extractul lichid la 45 ° C. Extractul concentrat a fost apoi liofilizat și reconstituit în soluție salină la concentrația de lucru. OB-1 este preparat din aceste șase extracte de ierburi în raport de 1: 1: 1: 1: 1: 1.
2.2. Proiectare experimentală
Șobolani Wistar masculi de patru săptămâni cu greutatea de 140-160 g au fost achiziționați de la Central Laboratory Animal, Inc. (Seul, Republica Coreea). Animalele au fost examinate în conformitate cu Ghidul pentru experimente pe animale editat de Academia Coreeană de Științe Medicale. Patru șobolani au fost adăpostiți pe cușcă sub un ciclu de lumină-întuneric de 12: 12 ore, umiditate de 50% și
° C Componenta nutritivă și raportul compoziției dietelor martor și bogate în grăsimi sunt indicate în Tabelul 1 [1, 12]. Șobolanii au fost hrăniți cu un chow standard pentru pelete de laborator (Purina Co.; Republica Coreea) și s-au aclimatizat în mediul lor timp de 7 zile înainte de a începe experimentul. După aclimatizare, grupul de control (
) a primit o dietă standard de laborator (dieta de control) și grupul de dietă bogată în grăsimi (
) a primit dieta descrisă în tabelul 1. Componenta nutritivă a dietei de control (3.665 kcal/g) a fost 65% carbohidrați, 20% proteine și 4,5% lipide. Dieta bogată în grăsimi (4.058 kcal/g) a fost un amestec care conține alimente umane foarte gustoase (prăjituri, brânză, cârnați, chipsuri, ciocolată și migdale) în proporție de 2: 2: 2: 2: 1: 1 și un cantitate egală (în grame) din dieta de control a laboratoarelor de control. Această dietă bogată în grăsimi conținea 32%, 12% și 31% din energia sa sub formă de carbohidrați, proteine și, respectiv, grăsimi. Animalele au fost cântărite la începutul experimentului și în fiecare săptămână după aceea. După 5 săptămâni de hrănire a șobolanilor fie dietă martor, fie bogată în grăsimi, fiecare grup a fost împărțit aleatoriu în grupuri tratate cu soluție salină sau tratate cu OB-1. Șobolanii au fost hrăniți cu dieta indicată, tratați cu soluție salină sau 40 mg/100 g de OB-1 zilnic timp de 5 săptămâni. Șobolanii au fost sacrificați prin administrarea de anestezie la 10 săptămâni după începerea tratamentului dietetic.
2.3. Mostre de organe
Probele de țesut adipos epididimal și ficat au fost enucleate de la șobolani și spălate în soluție salină rece. Probele de adipocite epididimale au fost depozitate imediat într-un congelator adânc de -70 ° C pentru izolarea ulterioară a ARNm. Probele de ficat au fost fixate peste noapte în 10% formalină tampon neutră (NBF) în pregătirea pentru colorarea histologică. Probele de ficat fixe au fost apoi înmuiate în 30% zaharoză (Sigma; St. Louis, MO, SUA) până când probele de ficat s-au scufundat pe fundul sticlei. După îndepărtarea excesului de lichid din probe, acestea au fost depozitate la -70 ° C.
2.4. Analiza RT-PCR
2.5. Analiza imunoblotului
Țesuturile au fost omogenizate în tampon conținând 50 mM Tris-HCI, pH 7,4, 5 mM EDTA, 150 mM NaCI, 0,1% dodecil sulfat de sodiu (SDS), 1% Triton X-100 și cocktail inhibitor de protează (104 mM AEBSF, 0,08 mM Aprotinin, 2 mM Leupeptin, 4 mM Bestatin, 1,5 mM Pepstatin A și 1,4 mM E-64) pe gheață. Țesutul omogenizat a fost incubat timp de 30 de minute pe gheață, urmat de centrifugare la 14.000 rpm timp de 30 de minute la 4 ° C. Supernatantul a fost utilizat pentru a efectua un test Bradford (Bio-rad) pentru a determina concentrația de proteine. Apoi, 50 μg de proteine totale au fost separate pe geluri de poliacrilamidă reducătoare cu 10% și transferate în membrane. Analiza imunoblot a fost efectuată folosind un anticorp fosfo-AMPK (Cell Signaling Technology; Beverly, MA, SUA) sau α-anticorpul tubulinic și proteinele imunoreactive au fost detectate folosind chemiluminiscență.
2.6. Izolarea celulei grase din adipocite
Celulele adipoase au fost izolate prin tratament cu colagenază, în conformitate cu o metodă descrisă anterior [13]. Pe scurt, probele de țesut adipos epididimal au fost tocate la temperatura camerei și incubate cu 1,5 g/L de colagenază în 10 mL de bicarbonat Krebs-Ringer (KRB; 10 nM HEPES, 6 mM glucoză și 30 g/L ser albumină bovină, pH 7,4, pregazat cu 95% O2/5% CO2) timp de 30 de minute la 37 ° C într-o baie de apă agitată. Adipocitele au fost apoi vizualizate prin microscopie și fotografiate.
2.7. Morfologia ficatului
Probele de ficat fixe descrise mai sus au fost încorporate în compusul de temperatură de tăiere optică (OCT) și 10 μM secțiuni au fost tăiate pe un criostat. Secțiunile de țesut au fost colorate cu Oil Red O (Sigma), pentru a vizualiza lipidele neutre, iar nucleele au fost contracolorate cu hematoxilină (Gill No. 2; Sigma). Oil Red O a fost dizolvat în 99% izopropanol, lăsat peste noapte la temperatura camerei și filtrat cu hârtie de filtru Whatman nr. 2 (Whatman; Marea Britanie). Această soluție stoc a fost amestecată cu apă distilată (2: 3) și re-filtrată cu hârtie de filtru Whatman nr. 2 înainte de utilizare. Diapozitivele care conțin țesut hepatic secționat au fost clătite cu izopropanol timp de 10 min și colorate cu soluția de lucru Oil Red O timp de 15 min. Lamela a fost apoi decolorată cu 70% izopropanol timp de 3 minute, clătită cu apă distilată timp de 5 minute și colorată cu hematoxilină timp de 30 sec. Diapozitivele colorate au primit o spălare finală cu apă distilată, uscate la aer și montate cu jeleu de glicerină.
2.8. Test de câmp deschis
Pentru a determina dacă tratamentul cu OB-1 a crescut nivelul de activitate al șobolanilor, am monitorizat și comparat numărul de vizite, creșterea și îngrijirea grupului tratat cu OB-1 cu grupul salin într-un teren deschis. Am folosit o arenă de 75 cm × 75 cm cu pereți înalți de 30 cm, construită din cinci bucăți de hârtie groasă și marcată cu o bandă transversală pe fund, la o distanță de 15 cm. O cameră video a fost plasată la 250 cm deasupra arenei și a fost folosită pentru a înregistra 10 minute de activitate pe șobolan. Au fost monitorizate incidențele a trei tipuri de activități (număr de vizite, creștere și îngrijire).
2.9. Analize statistice
Analizele statistice au fost efectuate folosind fereastra SPSS (versiunea 12.0). Toate datele cantitative au fost analizate de către independenți
-teste pentru diferențele dintre două mijloace și ANOVA unidirecțional pentru diferențele dintre patru mijloace.
valorile de) au fost semnificativ supraponderate comparativ cu controalele la șobolanii de dietă standard de laborator () după cinci săptămâni (
, Figura 1). Apoi, jumătate din fiecare grup indus de HFD și grupuri de control au fost subclasificate aleatoriu și administrate cu OB-1 și soluție salină timp de încă cinci săptămâni, cum ar fi HFD_OB-1, HFD_saline, Con_OB-1 și respectiv Con_saline. Tratamentele OB-1 la șobolani induși de HFD au arătat o reducere de aproximativ 3,1% a greutății corporale la 10 săptămâni, dar nu semnificativă (
). În plus, nu a existat nicio diferență în aportul de alimente între OB-1 și grupurile de tratament cu soluție salină. Ca grup HFD, nu a existat nicio diferență între tratamentul cu OB-1 și tratamentul cu soluție salină de control al greutății corporale.
) a fost indusă de o dietă bogată în grăsimi timp de cinci săptămâni, comparativ cu martorii (
). (b) După subclasificarea fiecărui grup, medicina pe bază de plante (OB-1) și soluția salină au fost tratate timp de încă cinci săptămâni. Fiecare dată prezintă media ± S.E.M. *
3.2. Creșterea activității mișcărilor în testul în câmp deschis de OB-1
Pentru a evalua efectele OB-1 asupra nivelurilor generale de activitate ale șobolanilor, șobolanii din fiecare grup au fost supuși unui test de câmp deschis pentru a evalua nivelurile lor de activitate. Pe parcursul celor 10 minute li s-a permis să călătorească liber, au fost monitorizate vizitarea, creșterea și îngrijirea șobolanilor. Interesant este faptul că tratamentele OB-1 la șobolani induși de HFD au crescut semnificativ activitatea mișcărilor în comparație cu grupul HFD_salin (, Figura 2).
) au fost monitorizate pentru a măsura nivelurile de activitate. Fiecare dată prezintă media ± S.E.M. *
3.3. Efectele OB-1 asupra adipocitelor și acumulării de lipide
Pentru a observa dacă OB-1 afectează morfologia celulelor, celulele adipocite albe au fost mai întâi izolate de șobolani din fiecare grup și apoi comparate prin microscopie. Adipocitele albe epididimale din obezitatea indusă de HFD s-au dovedit a fi mărite în comparație cu controalele care au fost hrănite cu dieta standard chow, în timp ce dimensiunea adipocitelor de la șobolanii administrați cu OB-1 cu obezitate indusă de HFD s-a găsit recuperată (Figura 3 ( A)). Deoarece obezitatea este legată de acumularea de lipide în ficat, țesuturile hepatice din fiecare grup au fost recoltate și apoi colorate cu Oil Red O, un colorant specific pentru colorarea lipidelor, și au contracolorat nucleele cu hematoxilină. Observația microscopică a arătat picături de lipide în țesuturile hepatice de la șobolani induși de obezitate fără administrarea de OB-1 (HFD_saline), în timp ce cei din grupul de tratament OB-1 nu au prezentat picături de lipide, similar cu probele martor (Figura 3 (b)), că tratamentele OB-1 ar putea modula formarea picăturilor de lipide în țesuturile hepatice.
3.4. Efectele OB-1 asupra expresiei mRNA a leptinei și adiponectinei
Pe baza modificărilor adipocitelor și a țesutului hepatic după tratamentele cu OB-1, s-a investigat dacă expresia genelor de leptină și adiponectină ar putea fi reglată de OB-1. Deși nivelul transcripțional al leptinei în adipocitele albe epididimale de la șobolanii induși de HFD a fost semnificativ crescut în comparație cu martorii, nu a existat nicio diferență între tratamentele cu OB-1 și tratamentele saline (Figura 4 (a)). În cazul adiponectinei, fiecare grup nu a prezentat nicio modificare semnificativă (Figura 4 (b)). Aceste rezultate indică faptul că OB-1 nu are niciun efect pentru a regla expresia atât a leptinei, cât și a adiponectinei.
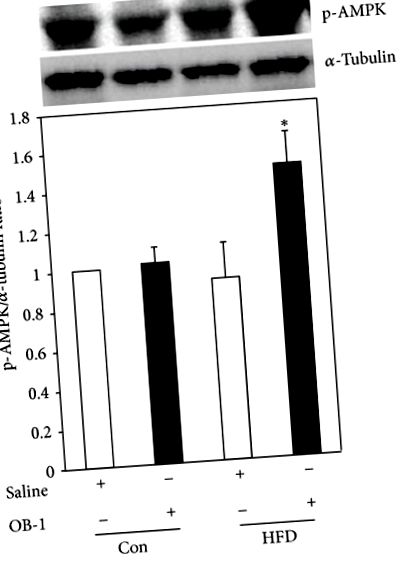
3.5. Efectul stimulator al OB-1 asupra fosforilării AMPK
Deoarece AMPK joacă un rol cheie în metabolismul energetic în celule, s-a investigat în continuare dacă OB-1 afectează activitatea AMPK în țesuturile hepatice de la șobolani. Nu au existat diferențe în expresia proteinei AMPK între martori și grupul administrat cu soluție salină cu obezitate indusă de HFD. Cu toate acestea, fosforilarea AMPK a fost semnificativ crescută în grupul administrat cu OB-1, comparativ cu grupul obez tratat cu soluție salină, precum și cu martorii (, Figura 5).
4. Discutie
AMPK joacă o funcție importantă în menținerea echilibrului energetic din celule. De asemenea, ficatul este un centru pentru metabolismul energetic și pentru homeostazia glucozei. Pentru a controla homeostazia energetică, activarea AMPK scade gluconeogeneza și lipogeneza, în timp ce crește oxidarea grăsimilor și absorbția glucozei prin activarea căilor generatoare de ATP și dezactivarea căilor de consum ATP [9, 18, 19]. În acest studiu, tratamentele OB-1 s-au dovedit a fi corelate negativ cu acumularea de picături de lipide în țesutul hepatic, sugerând că OB-1 ar putea inhiba acumularea de lipide prin blocarea căii legate de metabolismul lipidic. În sprijinul acestei idei, OB-1 a reglat pozitiv activitatea AMPK în țesutul hepatic din grupul tratat cu OB-1 cu obezitate indusă de HFD. Prin urmare, OB-1 ar putea regla negativ metabolismul lipidic sau gluconeogeneza prin activarea AMPK. Cu toate acestea, este necesar să se elucideze în detaliu mecanismele moleculare de bază.
Conform rezultatelor noastre la testele în câmp deschis [20], șobolanii administrați cu OB-1 cu obezitate indusă de HFD au arătat activități crescute de îngrijire și creștere comparativ cu grupul de control tratat cu soluție salină. Deși șobolanii obezi administrați cu OB-1 nu au prezentat nicio reducere semnificativă a greutății corporale comparativ cu grupul obez tratat cu soluție salină, aceste mișcări crescute sugerează că activarea AMPK și mecanismele sale conexe ar putea controla nu greutatea corporală sau aportul alimentar, ci metabolismul energetic [10, 21]. Această creștere a metabolismului energetic prin OB-1 ar putea scădea aproximativ 3,1% din greutatea corporală a șobolanilor în acest studiu, dar nu semnificativă și ar putea crește activitatea mișcărilor.
Leptina și adiponectina, ca hormoni derivați de adipocite, joacă roluri cheie în obezitate și în homeostazia energetică [22, 23]. Deoarece leptina reglează depozitele de grăsime corporală prin efectele sale asupra aportului alimentar și a metabolismului energetic, leptina este o moleculă importantă în procesul obezității [24]. Recent s-a raportat că există o corelație semnificativă între expresia leptinei și mărimea adipocitelor [25]. În plus, există o corelație între expresia adiponectinei, care este o adipokină care este secretată special de adipocite și dimensiunea adipocitelor în obezitate [26, 27]. Pe baza acestor fapte, s-a evaluat expresia leptinei și adiponectinei, dar nu s-a găsit nicio modificare semnificativă în expresia ARNm a genelor prin tratamentul OB-1. Cu toate acestea, s-a arătat că dimensiunea adipocitelor de la șobolani administrați cu OB-1 cu obezitate indusă de HFD este comparată cu adipocitele mărite ale șobolanilor induși de obezitate, sugerând că alte semnale ar putea fi implicate în exprimarea și reglarea adipocitelor în tratament din OB-1. S-a raportat că TNF este exprimat în adipocite umane, iar nivelul TNF este corelat pozitiv cu obezitatea [28]. Acest lucru sugerează că semnalizarea TNF ar putea fi implicată în exprimarea și reglarea adipocitelor în tratamentul OB-1.
Exercițiul fizic și contracția sunt corelate cu fosforilarea crescută a AMPK în mușchiul scheletic uman sau de șobolan [29, 30]. Prin urmare, constatările noastre că administrarea de OB-1 a crescut fosforilarea AMPK sugerează că componentele din cele șase plante ar putea stimula mecanismul mișcărilor fizice și exercițiile fizice prin activarea AMPK și/sau a regulatorilor implicați. În concluzie, acest studiu a arătat că tratamentele cu șobolani cu obezitate indusă de OB-1 până la HFD au crescut semnificativ fosforilarea AMPK și au scăzut dimensiunea crescută a adipocitelor din obezitatea indusă de HFD și acumularea de lipide. Prin urmare, se sugerează că aceste efecte ale OB-1, în special legate de activarea AMPK, ar putea modifica procesele metabolice. Descoperirile noastre necesită studii viitoare la nivelurile mecanismului molecular pentru a înțelege modul în care extractul de plante OB-1 sau componentele sale modulează procesele metabolice.
Mulțumiri
Această lucrare a fost susținută parțial de grantul Korea Science and Engineering Foundation (KOSEF) finanțat de guvernul coreean (MEST) (nr. 2009-0063466) și parțial de o subvenție din partea proiectului de cercetare și dezvoltare în medicina tradițională coreeană, Ministerul Sănătății și bunăstării Republica Coreea (B110043).
Referințe
- Extractul de plante ALS-L1023 din Melissa officinalis ameliorează obezitatea viscerală și insulina
- Efectul proteinei de cazeină înainte de somn asupra metabolizării grăsimilor la bărbații obezi - PubMed
- De ce dieta de ridicare a greutăților include multe proteine
- Necesarul de proteine dietetice al unui somn bagrid, Mystus nemurus (Cuvier & Valenciennes),
- Adevărul despre bicicliști și proteine ACTIVE