Introducere
Trombofilia este considerată ca o afecțiune predispozantă la dezvoltarea trombozei. Tromboza arterială apare de obicei după eroziunea sau ruperea unei plăci aterosclerotice și, prin trombi mediați de trombocite, poate provoca leziuni ischemice în special în țesuturile cu pat vascular terminal. Într-adevăr, ischemia cardiacă și accidentul vascular cerebral sunt cele mai severe manifestări clinice ale aterotrombozei. Ischemia poate apărea încet din progresia bolii aterosclerotice (angină stabilă, claudicație) sau acut în caz de tromboembolizare vasculară (ruptură de placă aterosclerotică) sau intracardică (fibrilație atrială, proteze mecanice de valvă).
Tabelul I
Factori de risc clasici pentru bolile cardiovasculare 35 .
| Hiperlipidemie | 3,25 (2,81-3,76) |
| Fumat | 2,87 (2,58-3,19) |
| Diabet | 2,37 (2,07-2,71) |
| Hipertensiune | 1,91 (1,74-2,10) |
| Obezitate abdominală | 1,62 (1,45-1,80) |
SAU: raport de cote; CI: intervale de încredere.
Tabelul II
Factori de risc clasici pentru tromboembolism venos.
| Factori de risc puternici (raport de cote> 10) |
| traume sau fracturi |
| chirurgie ortopedică majoră |
| chirurgie oncologică |
| Factori de risc moderate (cota 2-9) |
| chirurgie non-oncologică |
| contraceptive orale și terapie de substituție hormonală |
| sarcină și puerperiu |
| hipercoagulabilitate |
| tromboembolism venos anterior |
| Factori de risc slabi (cota 3 zile) |
| călătorie prelungită |
| sindrom metabolic |
| poluarea aerului |
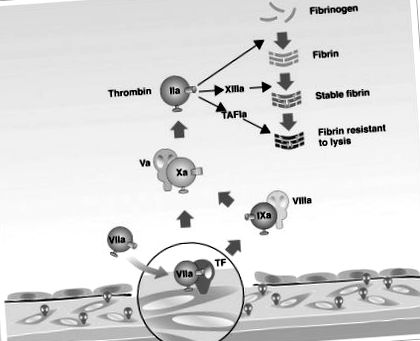
Rolul factorului tisular (TF) și al factorului VII de coagulare în activarea cascadei de coagulare care conduce la formarea trombinei.
TAFI = inhibitor de fibrinoliză activabil pentru trombină; „A” = „activat”.
Anomalii de trombofilie
Mecanisme anticoagulante ale coagulării sângelui. Antitrombina (AT) inhibă în principal factorii II (IIa) și X (Xa) activi prin legarea sa la glicozaminoglicanii (GAG); proteina C (PC), cu co-factorul proteinei S (PS), este activată de trombomodulină (TM) și inhibă factorii activați V (Va) și VIII (VIIIa) prin legarea sa la receptorul endotelial al proteinei C (EPCR).
TFPI = inhibitor al căii factorului tisular; „A” = „activat”.
Tabelul III
Coagulare moștenită, dobândită și mixtă sau factori de risc metabolici pentru tromboză.
| Deficitul de antitrombină | Sindromul antifosfolipidic | Hiperhomocisteinemie |
| Deficitul de proteine C | Niveluri crescute de fibrinogen | |
| Deficitul de proteine S. | Niveluri crescute de factor VIII | |
| Factorul V Leiden | Niveluri crescute de factor IX | |
| Protrombină G20210A | Niveluri crescute ale factorului XI |
Cei mai comuni doi factori de risc genetici pentru TEV sunt mutația G1691A din gena factorului V (factorul V Leiden) și mutația G20210A din gena protrombinei. Mutația câștigului de funcție a factorului V Leiden constă în înlocuirea unei arginine cu glutamină la poziția 506 a factorului de coagulare V (R506Q), care este locul de clivaj pentru proteina C activată în molecula factorului V 23. Factorul mutant V este parțial rezistent la inactivare de către proteina C activată, ducând la o stare hipercoagulabilă. Factorul V Leiden explică mai mult de 90% din cazurile de rezistență activă la proteina C 24. Mutația G20210A din gena protrombinei este o tranziție G la A în poziția nucleotidică 20210 în regiunea 3'-netradusă a genei factorului de coagulare II (protrombină), care crește nivelurile de protrombină 25. Aceste două mutații cresc, de asemenea, riscul de aterotromboză, dar într-o măsură mai mică 26. Prevalențele trombofiliei moștenite în populația generală și la pacienții cu TEV sunt prezentate în Tabelul IV .
Tabelul IV
Prevalența (%) factorilor de risc moșteniți pentru TEV la populația generală și la pacienți.
Hiperhomocisteinemia este un factor de risc ușor pentru tromboză datorită afectării căii metabolice care transformă aminoacidul metionină în cisteină, ducând la o creștere anormală a concentrațiilor plasmatice ale homocisteinei, un produs intermediar al acestei căi. Factorii genetici (de exemplu, mutații genetice în metilenetetrahidrofolat reductază și cistationina β-sintază) și factori dobândiți (de exemplu, deficiențe de folat, vitamina B12 sau vitamina B6, vârstă avansată, insuficiență renală cronică și utilizarea medicamentelor antifolice) interacționează cu determina concentrațiile plasmatice de homocisteină, astfel încât hiperhomocisteinemia este un factor de risc „mixt” (adică genetic și/sau dobândit) atât pentru tromboza arterială cât și pentru cea venoasă 29. Posibilele mecanisme prin care hiperhomocisteinemia contribuie la tromboză sunt multiple și sunt încă în studiu; acestea includ un efect toxic asupra celulelor endoteliale, proliferarea celulelor musculare netede și îngroșarea intimă, generarea afectată de oxid nitric și prostaciclină, aderența crescută a trombocitelor, activarea factorului V, interferența cu activarea proteinei C și expresia trombomodulinei, inducerea activității factorului tisular și inhibarea activatorului plasminogen tisular (t-PA) 30 .
A fost demonstrată o asociere între nivelurile plasmatice crescute ale unor factori de coagulare (VIII, IX, XI și fibrinogen) și un risc crescut de TEV 31. Nivelurile plasmatice ale acestor factori sunt influențate de vârstă și inflamație, dar sunt, de asemenea, sub control genetic. Mecanismele prin care factorii de coagulare crescuti nivelurile plasmatice sporesc riscul de tromboza sunt necunoscuti, dar o deplasare a echilibrului procesului de coagulare spre o stare procoagulanta este plauzibila. Nivelurile ridicate de fibrinogen sunt asociate cu un risc crescut de aterotromboză, în timp ce efectul factorului VIII este dependent de vWF, care joacă cel mai important rol în riscul crescut de tromboză asociat cu complexul factor VIII/vWF.
Sindromul metabolic și fumatul
Din punct de vedere biologic, sindromul metabolic este însoțit frecvent de o stare protrombotică. Aceasta include niveluri plasmatice crescute de PAI-1, inhibitor de fibrinoliză activabil cu trombină (TAFI), vWF, factorii de coagulare VIII, VII și XIII și fibrinogen, TF, eliberare crescută a microparticulelor de celule endoteliale și scăderea nivelului de proteină C. Mai mult, pacienții cu sindrom metabolic prezintă disfuncție endotelială (în principal scăderea producției de oxid nitric și prostaciclină) și reactivitate crescută a trombocitelor 33. Activarea sistemului hemostatic legat de sindromul metabolic a fost atribuită în principal acțiunii mediatorilor pro-inflamatori și pro-aterogeni (de exemplu, leptină, factor de necroză tumorală-α, interleukină-6) eliberat de celulele adipoase 33, unui declanșator efectul lipoproteinelor cu densitate foarte mică (VLDL) și al lipoproteinelor rămase asupra activării trombocitelor și a expresiei genei PAI-1 41, asupra efectelor adverse ale hiperglicemiei cronice asupra structurii și funcției fibrinei (generând un cheag mai rezistent la fibrinoliză) 42 și la creșterea microparticulelor circulante care susțin coagularea sângelui prin expunerea fosfolipidelor anionice și TF 43 .
Tabelul V
Asocieri între factorii de risc cardiovasculari clasici și TEV.
| Obezitate (IMC) | 2,33 (1,68-3,24) 50 |
| Diabet | 1,42 (1,12-1,77) 50 |
| Hipertensiune | 1,51 (1,23-1,85) 50 |
| Fumat | 1,42 (1,28-1,58) 51 |
IMC = indicele de masă corporală; SAU = raportul de cote; CI = intervale de încredere.
În cele din urmă, de asemenea, dislipidemia poate exercita o influență ușoară asupra riscului de TEV 52, 53, determinat de o meta-analiză recentă în care pacienții cu TEV au avut trigliceride ridicate și niveluri scăzute de colesterol HDL, în timp ce nu a fost observat niciun efect al colesterolemiei totale 50. Mai mult, dovezile preliminare arată că statinele pot fi protectoare împotriva TEV 54, 55, susținând ipoteza dislipidemiei care influențează riscul TEV.
În concluzie, în ciuda discrepanței dintre riscurile relative estimate de TEV și aterotromboză asociate cu factori de risc cardiovascular, acesta din urmă poate reprezenta o legătură între două entități clinice care au fost clasificate clasic distincte.
Tromboza anterioară
Prezența unui tromb rezidual după un prim episod de TVP este un factor de risc independent pentru recurența 67. După un prim episod de TEV, pacienții sunt de 40 de ori mai predispuși să dezvolte un eveniment recurent comparativ cu indivizii neafectați anterior68. TEV anterior reprezintă cel mai important factor de risc pentru recurența TVP sau EP (OR 15,5; 95% CI 6,77-35,99), iar riscul este mai mare la persoanele cu TEV idiopatic anterior decât la cei cu TEV secundar 69. Riscul de recurență variază în timp, fiind mai mare în primele 6-12 luni după evenimentul index 70. Într-un studiu care a implicat 355 de pacienți, incidența TEV recurentă a fost de 8,6% la 6 luni și de 17,5% după 2 ani 71. După 8 ani, rata de recurență a fost de până la 30,3% 71. Mai mult, TVP sau PE recurente sunt asociate cu un risc crescut de sindrom post-trombotic și hipertensiune pulmonară cronică tromboembolică 72. Prin urmare, prevenirea secundară a TEV este crucială pentru a reduce semnificativ povara acestor boli și până în prezent cea mai eficientă strategie este reprezentată de terapia anticoagulantă.
Un mecanism potențial prin care trombul rezidual crește riscul de recurență este afectarea fluxului venos, rezultând staza sângelui și formarea cheagurilor. Cu toate acestea, deoarece unii pacienți dezvoltă tromboză recurentă în piciorul inițial neafectat și alții dezvoltă PE izolat, trebuie implicate alte mecanisme. Tromboza reziduală este probabil un marker pentru o diateză procoagulantă mai generalizată. Într-adevăr, nivelurile crescute ale dimerului D plasmatic după retragerea anticoagulării orale (un marker al hipercoagulabilității) sunt un factor de risc independent pentru tromboza venoasă recurentă 73, 74 .
Traumatisme, intervenții chirurgicale și imobilizare
Deși TEV este cea mai frecventă complicație trombotică a intervenției chirurgicale, leziunile iatrogene chirurgicale pot duce și la ocluzie arterială. Mai mult, tromboza arterială secundară intervenției chirurgicale poate reprezenta prima manifestare a trombocitopeniei induse de heparină, o boală autoimună declanșată de expunerea la heparină care este administrată în mod obișnuit ca profilaxie antitrombotică a TEV post-operatorie. Tabloul clinic este caracterizat de trombocitopenie tranzitorie (în mai mult de 90% din cazuri numărul trombocitelor este> 15.000/μL) și atât trombozele arteriale, cât și cele venoase, în special ale membrelor inferioare, sunt descrise la pacienții chirurgicali 90 .
Cancer
Cancerul este unul dintre cei mai importanți factori de risc dobândiți pentru TEV 91. Unii autori estimează o incidență anuală a TEV de 1 din 200 de pacienți cu cancer 92, iar 20% din cazurile de TEV apar la pacienții cu cancer 93. În schimb, dintre toți pacienții cu cancer, 15% vor dezvolta TEV simptomatic 93, 50% TEV asimptomatic 94 și 50% vor avea TEV diagnosticat la autopsie 91. Riscul de TEV este mai mare la diagnostic (OR 53,5; IÎ 95% 8,6-334,3) și la pacienții cu metastaze la distanță (OR 19,8; IÎ 95% 2,6-149,1) 95. Dacă un pacient cu cancer supraviețuiește unui eveniment inițial de TEV, acesta are un risc crescut de recurență (OR 1,72; 95% CI 1,31-2,25) comparativ cu cel la un pacient fără cancer. Pacientul cu cancer cu TEV are, de asemenea, un risc semnificativ crescut de deces (OR 8,1; IÎ 95% 3,6-18,1), care persistă atât timp cât persistă malignitatea 71. În plus, TEV este a doua cauză principală de deces la pacienții spitalizați cu cancer, după infecții 96 .
Contraceptive orale și terapie hormonală
Tabelul VI
Modificări hemostatice în timpul utilizării contraceptivelor orale (OC) și sarcinii.
- Obezitate, factori de risc pentru boli cronice & amp; Cuvinte de luptă și # 195; și # 162; și # 194; și # 8364;
- Convulsii în tromboza venoasă și sinusală cerebrală - Mehvari Habibabadi - 2018 - Epilepsia deschisă -
- Adolescenții care fumează 4 factori de risc de urmărit pentru MD Anderson Cancer Center
- Factori de risc pentru boala arterială coronariană - StatPearls - Bibliotecă NCBI
- Persoanele care renunță la fumat riscă să câștige o greutate „substanțială”, indiferent de modificările caloriilor zilnice