Anna Julia Squarr
1 Institut de Neurobiologie, Universitatea din Münster, 48149 Münster, Germania
Klaus Brinkmann
1 Institut de Neurobiologie, Universitatea din Münster, 48149 Münster, Germania
Baoyu Chen
2 Departamentul de Biofizică și Institutul Medical Howard Hughes, Universitatea din Texas Southwestern Medical Center din Dallas, Dallas, TX 75390
Tim Steinbacher
3 Grupul de cercetare asociat institutului „Aderența celulară și polaritatea celulei”, Universitatea din Münster, 48149 Münster, Germania
4 Institutul de Biochimie Medicală, Universitatea din Münster, 48149 Münster, Germania
5 Centrul de biologie moleculară a inflamației, Universitatea din Münster, 48149 Münster, Germania
Klaus Ebnet
3 Grupul de cercetare asociat institutului „Aderența celulară și polaritatea celulei”, Universitatea din Münster, 48149 Münster, Germania
4 Institutul de Biochimie Medicală, Universitatea din Münster, 48149 Münster, Germania
5 Centrul de biologie moleculară a inflamației, Universitatea din Münster, 48149 Münster, Germania
Michael K. Rosen
2 Departamentul de Biofizică și Institutul Medical Howard Hughes, Universitatea din Texas Southwestern Medical Center din Dallas, Dallas, TX 75390
Sven Bogdan
1 Institut de Neurobiologie, Universitatea din Münster, 48149 Münster, Germania
Date asociate
Abstract
Mișcările direcționale ale celulelor în timpul morfogenezei necesită o interacțiune coordonată între receptorii de membrană și citoscheletul de actină. Complexul de reglementare WAVE (WRC) este un regulator conservat al actinei. Aici, am constatat că cadherina atipică Fat2 recrutează WRC către membranele bazale ale contactelor tricelulare, unde se formează un nou tip de proeminență de actină asemănătoare cu biciul polarizat planar. Pierderea funcției Fat2 sau a interacțiunii acesteia cu WRC perturbă proeminențele tricelulare și are ca rezultat formarea de filopodii nepolarizate. Furnizăm dovezi suplimentare pentru o rețea moleculară în care receptorul tirozin fosfatază Dlar interacționează cu WRC pentru a împerechea matricea extracelulară, membrana și citoscheletul de actină în timpul alungirii ouălor. Datele noastre descoperă un mecanism prin care informațiile de polaritate pot fi transduse de la un receptor de membrană la un regulator cheie de actină pentru a controla migrația colectivă a celulelor foliculilor în timpul alungirii ouălor. Imagistica în directă 4D a acinilor mamari MCF10A în rotație sugerează în plus un mecanism conservator evolutiv care conduce mișcările de rotație în morfogeneza epitelială.
Introducere
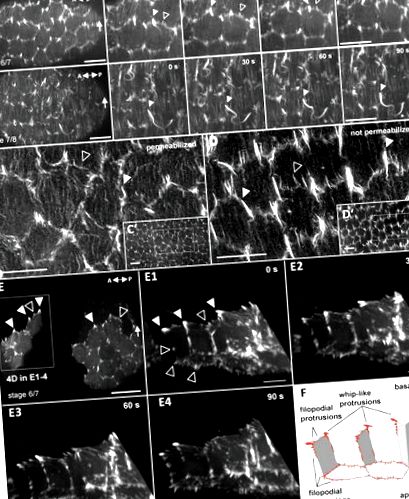
Mișcările colective și direcționate ale celulelor sunt esențiale pentru diverse procese de dezvoltare la animale. Progresele recente în imagistica în viu și condițiile de cultură ex vivo ale ovarelor Drosophila melanogaster au condus la descoperirea unui nou tip de mișcare morfogenetică care determină alungirea ouălor în timpul oogenezei muștelor (Haigo și Bilder, 2011; Bilder și Haigo, 2012). Foliculii alungitori, așa-numitele camere de ou, se rotesc în jurul axei lor anterioară - posterioară (A-P) în etapele inițiale ale oogenezei. Pe măsură ce celulele foliculului migrează în jurul axei lor circumferențiale, ele construiesc un ECM polarizat (Haigo și Bilder, 2011). ECM polarizat planar a fost propus să funcționeze ca un corset molecular pentru a restricționa expansiunea radială și pentru a forța alungirea camerei ouălor (Haigo și Bilder, 2011; Bilder și Haigo, 2012). La fel ca ECM, citoscheletul actinei bazale formează un corset compus din fascicule de actină paralele aliniate perpendicular pe axa A-P. Astfel, sincronizarea și orientarea rotației foliculului coincid cu formarea unui ECM polarizat plan și a citoscheletului de actină bazală.
Ce molecule determină rotația globală a camerei de ou? Două studii recente au dezvăluit un rol important al complexului Arp2/3 - activarea familiei WASP verprolin omologă (WAVE) și partenerul său de interacțiune Ena/Fosproteina stimulată de vasodilatator (Ena/VASP) în alungirea camerei de ou, doi regulatori de actină cheie cunoscuți care promovează migrarea celulelor în diferite sisteme (Cetera și colab., 2014; Chen și colab., 2014b). WAVE formează un complex heteropentameric, complexul de reglare WAVE (WRC), care cuprinde proteina Abi care interacționează Abi, Kette/Nap1, proteina 1 asociată în mod specific Rac1 (Sra-1) și celula 300 hematopoietică a progenitorului stem (HSPC300; Eden și colab., 2002; Chen și colab., 2010). Pierderea WRC sau a interacțiunii sale conservate cu Ena în Drosophila are ca rezultat ouă rotunde de formă anormală (Cetera și colab., 2014; Chen și colab., 2014b). Etichetarea in vivo a membranei utilizând o capcană Neuroglian-GFP a dezvăluit că celulele foliculilor care migrează formează proeminențe de membrană care se extind în direcția mișcării de rotație (Cetera și colab., 2014). WAVE și Ena sunt îmbogățite la vârfurile acestor proeminențe ale membranei și a fost propus un model în care WAVE definește marginea proeminentă a fiecărei celule foliculare și lamellipodii dependenți de WAVE determină migrarea colectivă a celulelor foliculului (Cetera și colab., 2014). În mod consecvent, epuizarea mediată de RNAi a Abi în toate celulele foliculului blochează complet rotația camerei ouă (Cetera și colab., 2014).
Având în vedere întreruperea citoscheletului actin bazal polarizat planar la mutanții fat2/kugelei, s-a propus că Fat2 ar putea controla o cale alternativă PCP în celulele foliculului (Bilder și Haigo, 2012). Studiile de localizare cu un transgen cu etichetă GFP susțin în continuare această idee (Viktorinová și colab., 2009; Gates, 2012). S-a raportat că o transgenă Fat2-GFP se localizează la joncțiunile tricelulare în camerele de ou în curs de dezvoltare până la stadiul 5 și concomitent cu debutul propus de rotație a camerei de ou, Fat2 se relocalizează la marginea întârziată a celulelor (Viktorinová și colab., 2009; Gates, 2012). Cu toate acestea, recentele analize imagistice în timp real demonstrează că rotația camerei ouă începe mult mai devreme, înainte de a putea fi observată o localizare asimetrică a Fat2-GFP (Cetera și colab., 2014). Astfel, relocalizarea Fat2 nu pare a fi semnalul instructiv pentru migrarea celulară a foliculului direcțional.
În celulele de mamifere, cel mai asemănător ortolog Fat2 la mamifere (Fat1) localizează tipurile de proeminențe ale membranei și contactele celulă-celulă, unde reglează dinamica joncțională a actinei și polaritatea celulară prin intermediul proteinelor Ena/VASP (Moeller și colab., 2004; Tanoue și Takeichi, 2004). Coada citoplasmatică a proteinei Drosophila Fat2, totuși, nu are toate cele trei situri de legare EVH1, care mediază legarea Ena/VASP a Fat1 la mamifere, sugerând că Drosophila Fat2 ar putea fi legată de citoscheletul de actină printr-o cale alternativă. Recent am descris un mecanism nou care leagă direct WRC de diverse molecule de adeziune celulară, canale ionice și receptori cuplați cu proteina G (Chen și colab., 2014a). Toți acești receptori transmembranari conțin un motiv peptidic conservat, secvența receptorului care interacționează cu WRC (WIRS) care leagă direct o suprafață de interacțiune conservată pe WRC formată din subunitatea Sra-1 și Abi (Chen și colab., 2014a). La muște, întreruperea suprafeței de legare WIRS în Abi are ca rezultat afectarea direcționării axonului fotoreceptor, morfologia defectuoasă a ouălor și sterilitatea feminină parțială (Chen și colab., 2014a). Aici, identificăm caderina atipică Fat2 ca un nou ligand WIRS și explorăm o cale moleculară în care Fat2 și Dlar acționează prin WRC pentru a controla migrația colectivă a celulelor în timpul oogenezei Drosophila.
Rezultate
Celulele foliculului formează două tipuri diferite de proeminențe bogate în actină dependente de WRC care conduc migrația colectivă a celulelor în timpul rotației camerei ouălor
WRC se acumulează la contactele tricelulare într-o manieră dependentă de Fat2
- Dovezi ale variației în planta complexă de inițiere a traducerii optime eIF4B, eIF4F și
- Cristale pentru slăbit; Cristale vindecătoare Cumpărați cristale cuarț colectiv
- Formula 1 va introduce noua greutate minimă a șoferului în 2019 The Drive
- Cut Line On Kevin Kisner; Pariu, Dustin Johnson; Conducerea vehiculului și o altă încălcare a drogurilor PGA Tour Golf
- Focus Weight Loss Club Recenzii, evaluări Centre de pierdere în greutate lângă 5610 West Riverpark Drive, Sugar