Susana Gómez-Ramírez
1 Departamentul de Medicină Internă, Spitalul Universitar Virgen de la Victoria. Campus de Teatinos, 2010 Málaga, Spania; se.oohay@marganasus
Elisa Brilli
2 Departamentul științific, Alesco S.r.l. Via delle Lenze, 216/B, 56122 Pisa, Italia; [email protected]
Germano Tarantino
3 Departamentul științific, Pharmanutra S.p.A. Via delle Lenze, 216/B, 56122 Pisa, Italia; [email protected]
Manuel Muñoz
4 Medicină transfuzională perioperatorie, Departamentul de specialități chirurgicale, biochimie și imunologie, Școala de Medicină, Campus de Teatinos, 29071 Málaga, Spania
Date asociate
Abstract
1. Introducere
Datele din 187 de țări din 2010 au arătat că anemia a afectat până la o treime din populația globală, deși prevalența a variat mult între regiuni, iar deficitul de fier (ID) a fost responsabil pentru aproximativ 50% din cazurile de anemie [1]. Într-o analiză sistematică din Global Burden of Disease Study 2016, anemia cu deficit de fier (IDA) a fost a patra cauză principală a anilor trăiți cu handicap, în special la femei [2]. Astfel, profilaxia și gestionarea ID sunt o problemă publică de prim ordin. Principalele cauze ale ID sunt cereri crescute, absorbție redusă și/sau pierderi crescute de fier [3,4] (Tabelul 1).
tabelul 1
Principalele cauze ale deficitului de fier.
- ▪ Creșterea corpului (copilărie și copilărie)
- ▪ Sarcina și alăptarea
- ▪ Recuperarea după pierderea de sânge
- ▪ Tratamentul cu agenți de stimulare a eritropoiezei
Alimentare sau absorbție externă limitată
- ▪ Aport slab
- ▪ Dieta inadecvată cu deficit de fier biodisponibil și/sau acid ascorbic (inclusiv exces de fibre dietetice, compuși fenolici din ceai sau cafea și produse din soia)
- ▪ Malabsorbție (gastrită atrofică autoimună, rezecție gastrică, chirurgie bariatrică, boală inflamatorie intestinală, boală celiacă, sensibilitate la gluten non-celiac, infecție cu Helicobater pylori)
- ▪ Medicamente (AntiH2, PPI, antiacide etc.)
- ▪ Niveluri crescute de hepcidină (de exemplu, IRIDA sau ACI)
- ▪ Defecte moleculare ale proteinelor de transport al fierului (de exemplu, deficiențe de hemoxigenază sau DMT1)
Pierderi crescute de fier:
- ▪ Traumatism de sângerare
- ▪ Sângerări gastro-intestinale (ulcerație peptică, neoplazie, boală inflamatorie a intestinului, malformații vasculare, medicamente [agenți antiinflamatori, antiplachetari sau anticoagulanți])
- ▪ Sângerări genito-urinare
- ▪ Menstruație și multi-paritate
- ▪ Flebotomii multiple de diagnostic („vampirism” medical)
- ▪ Donarea de sânge
- ▪ Dializă (în special hemodializă)
ACI, anemie a inflamației cronice; AntiH2, antagoniști ai receptorilor de histamină H2; DMT1, transportor metalic bivalent 1; IRIDA, anemie cu deficit de fier refractar la fier; PPI, inhibitori ai pompei de protoni.
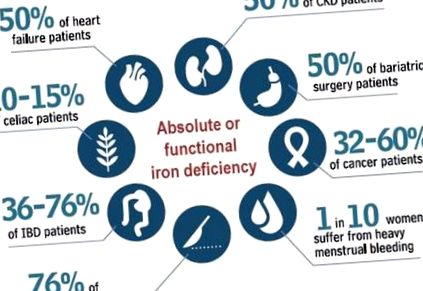
Cu toate acestea, prevalența și consecințele ID pot varia, de asemenea, în funcție de setarea clinică luată în considerare [5,6,7,8,9,10,11,12,13] (Figura 1). În urma diagnosticării ID-ului, este deosebit de relevant să se găsească și să se abordeze cauza subiacentă, în special în cazurile inexplicabile și/sau recurente, precum și să se aleagă opțiunea terapeutică care să răspundă în siguranță nevoilor pacientului [14,15,16,17].
Prevalența deficitului de fier între patologii. (Date preluate din referințe [5,6,7,8,9,10,11,12,13]).
2. Diagnosticul deficitului de fier
Evaluarea în laborator a stării fierului. * Conținutul scăzut de Hb în reticulocite (5%) sau raportul de transferină solubil ridicat la raportul de feritină log (> 2) ar putea identifica o componentă a unui deficit absolut de fier în prezența unui nivel ridicat de feritină indus de inflamație.
Cu toate acestea, deoarece este un reactant de fază acută, nivelurile ridicate de feritină nu exclud ID la pacienții care prezintă un statut inflamator. În aceste cazuri, alți parametri, cum ar fi un conținut scăzut de Hb în reticulocite (5%) sau un receptor de transferină solubil ridicat pentru raportul feritinei (> 2), indică o componentă a ID-ului adevărat. Dacă acest lucru este prezent, suplimentarea cu fier poate fi benefică [4,14,21].
3. Opțiuni de tratament pentru deficit de fier
Pe lângă căutarea și abordarea cauzei care stau la baza, dacă este posibil, ID-ul ar putea fi tratat cu fier oral, fier intravenos (IV) și/sau transfuzie de sânge, în funcție de nivelurile de Hb ale pacientului, de toleranță și de comorbiditate. Indiferent dacă este vorba despre un debut nou, recurent, explicat sau inexplicabil, trebuie luat în considerare și pentru alegerea dintre diferitele opțiuni de tratament ID
3.1. Suplimentare cu fier oral
Suplimentele de fier pe cale orală, furnizate sub formă de săruri feroase sau ferice, sunt de obicei prima linie de tratament pentru identificarea necomplicată, datorită disponibilității lor, ușurinței de administrare și costului relativ scăzut [14,15]. Fierul oral a fost de obicei prescris la o doză mare (100-200 mg fier elementar), care trebuie administrat de 2-3 ori pe zi. Cu toate acestea, biodisponibilitatea este de 10% până la 15% pentru preparatele de fier feros (sulfat, gluconat, fumarat etc.) și este chiar mai mică pentru sărurile de fier feric sau complexele de fier feric (aminoacizi, polizaharide, ovo-albumina etc.) ). Administrarea concomitentă a altor medicamente, cum ar fi inhibitorii pompei de protoni sau antiacide, sau mesele, precum și prezența unui status inflamator pot împiedica și mai mult absorbția sărurilor de fier orale [24]. Acest lucru poate prelungi durata tratamentului sau chiar îl poate face ineficient [24]. În plus, până la 50% dintre pacienții tratați cu fier pe cale orală (în funcție de formularea de fier) raportează efecte secundare gastrointestinale datorate toxicității directe a fierului ionic, care poate duce la o toleranță redusă și aderarea la suplimentarea cu fier [25,26].
Dozele unice mici de suplimente de fier (40-60 mg/zi) sunt asociate cu mai puține efecte secundare gastrointestinale și cu o secreție mai mică de hepcidină, rezultând o mai bună conformitate a tratamentului și o absorbție fracțională sporită [27,28]. Într-un studiu randomizat, 90 de pacienți octogenari cu IDA au primit 15 mg, 50 mg sau 150 mg de fier elementar pe zi. După două luni, nu au existat diferențe între grupuri în nivelurile de Hb (creștere medie de 1,4 g/dl în toate grupurile) sau feritină, dar efectele adverse au fost semnificativ mai frecvente în cazul dozelor mai mari [29]. Prin urmare, se preferă o doză zilnică unică mică (40-60 mg) și/sau o doză unică alternativă pe zi (80-100 mg) pentru a reduce efectele secundare și a maximiza absorbția fracționată [27,28,29]. Deși nu este dovedit oficial, aceasta apare ca o nouă paradigmă pentru suplimentarea orală cu fier în tratamentul ID [21].
3.2. Suplimentare intravenoasă cu fier
În cazul în care pacientul dezvoltă intoleranță la o sare de fier orală sau s-a dovedit ineficient, poate fi adecvată trecerea la o altă formulare orală de fier sau la fier intravenos (IV) [15]. Diferite formulări de fier IV au fost puse la dispoziție comercial pentru uz clinic, cum ar fi gluconatul feric (FG), zaharoza de fier (IS), dextranul cu fier cu greutate moleculară mică (LMWID), carboximaltoza ferică (FCM), ferumoxitolul (FXT) sau izomaltozida de fier 1000 (ISM). S-a dovedit că toate au o eficacitate dependentă de doză pentru corectarea ID [17,24]. Cu toate acestea, medicii și pacienții preferă formulări de fier IV mai noi, cum ar fi FCM sau ISM, care permit o infuzie de timp scurt (15-60 min) de doze mari de fier (1000 mg sau mai mult), comparativ cu Formulări IV „mai vechi” [17,24].
Cu toate acestea, deși din ce în ce mai sigure, formulările de fier IV sunt mai scumpe decât fierul oral și încă necesită acces venos (pot apărea efecte secundare la locul injectării) și monitorizarea perfuziei (există încă un risc de perfuzie și reacții de hipersensibilitate) [30 ]. În acest sens, Agenția Europeană a Medicamentului afirmă că „produsele de fier IV trebuie administrate numai atunci când personalul este instruit să evalueze și să gestioneze reacțiile anafilactice, iar facilitățile de resuscitare sunt disponibile imediat” [30]. În plus, cu excepția populației cu boli renale cronice [7], datele privind siguranța pe termen lung a fierului IV sunt rare [24].
3.3. Transfuzie de globule roșii
Un pacient care prezintă IDA severă și simptome alarmante (de exemplu, instabilitate hemodinamică) și/sau criterii de risc (de exemplu, boli coronariene) trebuie tratat cu transfuzie de globule roșii, utilizând cantitatea minimă necesară pentru a obține stabilitatea clinică. Aderarea la criteriile restrictive de transfuzie adaptate pacientului și transfuzarea unei unități în acel moment, cu reevaluare post-transfuzie, este foarte recomandată de majoritatea ghidurilor [6,31,32,33,34].
Transfuzia de globule roșii produce o creștere rapidă, deși tranzitorie, a Hb, crescând astfel capacitatea de transportare a oxigenului. Cu toate acestea, IDA severă va reapărea cu excepția cazului în care este identificată și abordată cauza principală. După ce stabilitatea hemodinamică a fost atinsă prin transfuzia de globule roșii, ar trebui luată în considerare suplimentarea suplimentară cu fier [17].
4. Sucrosomial ® Iron: Date preclinice
4.1. Compoziție și structură
Sărurile de fier orale utilizate în mod obișnuit sunt slab absorbite, fierul neabsorbit ducând la efecte secundare gastrointestinale [25]. Suplimentele mai noi de fier pe cale orală au fost formulate pentru a le crește tolerabilitatea [26]. Cu toate acestea, era încă nevoie de noi purtători care nu numai că protejează fierul, ci și sporesc absorbția sa intestinală, reducând astfel dozajul și efectele secundare [35].
Sucresterul este un agent tensioactiv derivat din esterificarea acizilor grași cu zaharoză (esteri zaharoză) și s-a dovedit recent că se comportă ca un potențiator al absorbției datorită capacității sale de a reduce rezistența barierei intestinale, facilitând astfel trecerea prin para-celular și trans-celular rute [36,37]. Efectele zaharoase depind atât de echilibrul hidrofil-lipofil, cât și de lungimea lanțului de acizi grași; prin urmare, alegerea materiei prime adecvate este crucială pentru dezvoltarea unei formulări cu proprietăți de intensificare a absorbției. Deși există dovezi ale proprietăților potențatoare ale esterilor de zaharoză pentru acumularea de medicamente în celulele CACO-2 [38] și pentru permeabilitatea intestinală la animale [39], utilizarea sa în administrarea orală a medicamentelor a fost abia studiată.
Sucrosomial ® Iron (SI), dezvoltat de Alesco srl (Pisa, Italia), reprezintă un purtător inovator care conține fier oral, în care pirofosfatul feric este protejat de o membrană stratificată fosfolipidică, în principal de lecitină de floarea-soarelui, plus o matrice de sugestie. Mai multă stabilitate și acoperire se obțin prin adăugarea altor ingrediente (fosfat tricalcic, amidon), formând „sucrosomul” și permițând SI să fie gastro-rezistent și transportat prin tractul intestinal, fără efecte secundare din interacțiunea dintre fier și mucoasa intestinală (Figura 3). Până în prezent, studiile in vitro au arătat că SI este absorbit în cea mai mare parte ca o structură asemănătoare veziculelor, ocolind calea convențională de absorbție a fierului. Datorită comportamentului său în tractul gastro-intestinal, SI este bine tolerat și foarte biodisponibil, comparativ cu sărurile de fier convenționale [40].
- Sucrosomial® Iron Povestea succesului obținut prin schimbarea perspectivei
- Stress Formula Plus Iron Utilizări orale, efecte secundare, interacțiuni, imagini, avertismente; Dozare - WebMD
- Suplimentarea cu pulbere de cardamom PRIME PubMed previne obezitatea, îmbunătățește intoleranța la glucoză,
- PRIME PubMed Efectul dietei și al postului asupra opacificării vezicii biliare în timpul administrării orale
- Supliment de dietă, probiotice și substanțe nutritive gratuite cu text integral pentru nutrienți în SARS-CoV-2