Research Discovery Research, Astellas Pharma Inc., Ibaraki, Japonia
Research Discovery Research, Astellas Pharma Inc., Ibaraki, Japonia
Research Discovery Research, Astellas Pharma Inc., Ibaraki, Japonia
Research Discovery Research, Astellas Pharma Inc., Ibaraki, Japonia
Research Discovery Research, Astellas Pharma Inc., Ibaraki, Japonia
Research Discovery Research, Astellas Pharma Inc., Ibaraki, Japonia
Abstract
Prevalența crescândă a obezității este una dintre cele mai presante probleme de sănătate din epoca modernă, dar medicamentele existente pentru combaterea acestei pandemii globale sunt în mod dezamăgitor limitate în ceea ce privește siguranța și eficacitatea. Insuficiența terapiilor disponibile în prezent pentru obezitate a făcut crucială dezvoltarea de noi medicamente. Cu toate acestea, în ultimele câteva decenii s-au realizat progrese majore în înțelegerea hiperplaziei adipocitelor asociate cu patogeneza obezității și, în consecință, au fost identificate noi ținte potențiale pentru tratamentul medical al obezității. Analizăm în primul rând progresele recente în reglarea hiperplaziei adipocitelor ca o nouă abordare netradițională emergentă. În acest minireview, ne concentrăm pe instabilitatea genomului 1 mediată de recQ (RMI1), o nouă țintă moleculară recent identificată pentru tratamentul obezității. Șoarecii cu deficit de RMI1 s-au dovedit a fi rezistenți la dieta bogată în grăsimi și la obezitatea legată de genetică. Exprimarea acestei proteine este reglementată de factorii de transcripție E2F și studii recente au sugerat că RMI1 joacă un rol important în controlul homeostaziei energetice în timpul dezvoltării obezității, cu un mod de acțiune bazat pe reglarea hiperplaziei adipocite.
Abrevieri
Introducere
Obezitatea este o tulburare complexă și un factor de risc major pentru bolile metabolice, cum ar fi diabetul zaharat de tip 2, hipertensiunea și bolile cardiovasculare. Obezitatea se dezvoltă ca urmare a unui dezechilibru între aportul și cheltuielile de energie. Pentru a spune simplu, reducerea cronică a cheltuielilor energetice în raport cu aportul determină o stocare crescută a excesului de energie sub formă de picături de triacilglicerol intracelular în celulele adipoase, ceea ce duce la creșterea masei grase și, în cele din urmă, la obezitate.
Se crede că hiperplazia adipocitelor (creșterea numărului de celule) și hipertrofia (creșterea dimensiunii celulei) sunt direct responsabile de creșterea observată a masei țesutului adipos [[1, 2]]. Hipertrofia adipocitelor în special este considerată principala cauză a obezității la adulți, iar hiperplazia adipocitelor la adulții obezi apare uneori secundar hipertrofiei adipocitelor, posibil datorită unui număr crescut de adipocite capabile să secrete factori de creștere paracrină care induc hiperplazie adipocitară [[]].
În timp ce numărul de bază al adipocitelor se stabilește în timpul copilăriei și adolescenței atât la oameni, cât și la rozătoare, țesutul adipos își păstrează capacitatea de a genera noi adipocite pe tot parcursul vieții. Creșterea numărului de adipocite în timpul îmbătrânirii a fost implicată în creșterea incidenței și severității obezității la vârstnici [[4]]. Tiazolidindionele, o clasă de agenți antidiabetici orali, sunt receptorii nucleari ai peroxizomilor - agoniști gamma activați ai receptorului proliferator, care sporesc generarea de adipocite de dimensiuni mici prin inducerea adipogenezei, rezultând o creștere a masei țesutului adipos și, prin urmare, obezitatea [[5]].
Acest număr tot mai mare de dovezi sugerează că hiperplazia adipocitelor poate fi un eveniment cheie în dezvoltarea și evoluția clinică ulterioară a unor tipuri de obezitate. În acest minireview, ne concentrăm asupra hiperplaziei adipocitelor ca o țintă terapeutică nouă pentru tratamentul obezității și discutăm meritele de a viza instabilitatea genomului 1 mediată de recQ (RMI1), o moleculă legată recent de homeostazia energetică, pentru tratamentul obezității.
Hiperplazia adipocitelor
Studiile preclinice au demonstrat că hiperplazia adipocitelor are loc în două etape: o creștere a numărului de preadipocite, urmată de diferențierea preadipocitelor în adipocite mature. Procesul de tranziție de la proliferare la diferențiere în adipocit este strict reglementat de interacțiunea dintre regulatorii ciclului celular și factorii de diferențiere și creează o cascadă de evenimente care duc la implicarea celulelor în fenotipul adipocitului [6, 7]. Acest proces, descris ca „adipogeneză”, necesită desfășurarea unei secvențe specifice de evenimente, inclusiv stoparea creșterii preadipocitelor proliferante, reintrarea coordonată în ciclul celular cu o expansiune clonală limitată și stoparea creșterii înainte de diferențierea terminală în timpul acumulării lipidelor, sugerând că unele conversații încrucișate au loc între ciclul celular sau mecanismul de proliferare celulară și factorii care controlează diferențierea celulară.
Reglarea ciclului celular
Factorii implicați în reglarea ciclului celular îndeplinesc în mod clar roluri importante în faza proliferativă a celulelor hiperplaziei adipocitelor. Progresia ciclului celular la mamifere este guvernată la fiecare fază a ciclului celular de diferiți complexe de molecule legate de ciclul celular, inclusiv cicline, kinaze dependente de ciclină, inhibitori ai acestora și proteina retinoblastomului (RB), precum și E2Fs.
Membrii familiei E2F și RB par să participe la reglementarea evenimentelor ciclului celular care sunt necesare pentru adipogeneză. În preadipocite arestate în creștere, de exemplu, E2F sunt complexate cu pRB, ducând la reprimarea genelor sale țintă [[8]]. La reintrarea în ciclul celular de către aceste preadipocite arestate de creștere, RB este fosforilat de hinoenzimele kinazei ciclinei/ciclinelor dependente, eliberând complexul E2F și astfel rezultând activarea genelor țintă E2F [[9]]. Fajas și colab. [[10]] a demonstrat că familia de proteine E2F joacă un rol central în proliferarea preadipocitelor și că șoarecii cu deficit de E2F1 sunt rezistenți la obezitate indusă de o dietă bogată în grăsimi (datorită suprimării acumulării de masă grasă).
Inhibitorii kinazei dependenți de ciclină includ două familii de proteine, familia Cip (Kip) și familia Ink4 și sunt actori centrali în ieșirea celulelor din ciclul celular [11]]. Pierderea p27 Kip1 sau p21 Cip1 la șoareci duce la hiperplazie adipocitară ca urmare a proliferării crescute sau a recrutării preadipocitelor [12], sugerând că acești inhibitori ai kinazei dependenți de ciclină sunt importanți în reglarea numărului adipocitelor. Proteina asociată kinazei fazei S (Skp) 1 - Cullin - F - box protein (SCF) ubiquitin ligase (E3) vizează inhibitorii kinazei dependenți de ciclină pentru degradare de către cei 26S proteazom și reglează astfel progresia ciclului celular [13]. Sakai și colab. [14]] a arătat că o deficiență în Skp2, subunitatea de legare a substratului complexului SCF Skp2, contribuie la degradarea p27 Kip1, rezultând o rezistență indusă la obezitate datorită inhibării proliferării preadipocitelor fără a provoca hipertrofia adipocitelor. Astfel de rezultate au fost observate atât în dietele bogate în grăsimi, cât și în agouti galben letal (A y ) modele de obezitate induse de gene. În mod similar, s-a demonstrat că alte molecule legate de ciclul celular, cum ar fi kinaza ciclin-dependentă [15, 16] și RB [[17]], joacă un rol important în proliferarea celulară în timpul adipogenezei.
Constatările menționate mai sus sugerează cu tărie că reglarea ciclului celular asociată cu hiperplazia adipocitelor poate prezenta o abordare nouă în tratarea obezității. Cu toate acestea, orice modulare a ciclului celular ar putea afecta nu numai țesuturile metabolice, ci și țesuturile normale. Într-adevăr, șoarecii cu deficit de Skp2 au arătat un număr redus de celule β în pancreas [[14]]. În plus, supraexprimarea p27 Kip1 în celulele β a indus hiperglicemie la șoareci ca urmare a inhibării proliferării celulelor β [[18]]. Aceste efecte adverse potențial grave asociate cu inhibarea nespecifică a proliferării celulare pot reprezenta un obstacol major pentru utilizarea clinică a acestei abordări în terapia obezității.
RMI1 și obezitate
Folosind o abordare de mutageneză aleatorie bazată pe metoda capcanelor genetice schimbabile, am identificat recent RMI1 ca un nou regulator al homeostaziei energetice [[19]], despre care s-a raportat că este o componentă esențială a complexelor proteice ale sindromului Bloom [[20]], deși nicio dovadă nu o legase de homeostazia energetică până la constatările noastre. S-a raportat anterior că RMI1, o proteină care leagă enzimele, mediază recombinarea ADN-ului, organizarea cromozomilor și biogeneza, precum și reglarea mașinilor punctului de control al ciclului celular [21]. RMI1 este, de asemenea, un membru al complexului genei sindromului Bloom (BLM) - topoisomerază; mutațiile vizate ale BLM sunt întârziate în dezvoltare și mor până la ziua embrionară 13.5 [[22, 23]] și embrionii knozatori homozigoti RMI1 mor din cauza unei cauze necunoscute [[19]]. Sindromul Bloom este o afecțiune genetică recesivă rară caracterizată prin nanism, eritem telangiectatic, deficit imunitar și predispoziție către dezvoltarea cancerului [24, 25]].
Șoarecii heterozigoți knockout RMI1 (RMI1 +/−) au un fenotip aproape identic cu cel de tip sălbatic, deși greutatea corporală și glicemia plasmatică de post sunt semnificativ mai mici la șoarecii de tip sălbatic. Cu toate acestea, șoarecii RMI1 +/− posedă o serie de caracteristici izbitoare care îi fac rezistenți la bolile metabolice. Când au fost hrăniți cu o dietă bogată în grăsimi, șoarecii mutanți au fost nu numai rezistenți la obezitate, ci au prezentat o intoleranță la glucoză îmbunătățită și o masă redusă a țesutului adipos abdominal. În plus, mutanții au fost, de asemenea, rezistenți la obezitate indusă de A y genă. O notă deosebită este faptul că șoarecii deficienți au prezentat o rată de creștere în greutate și cantitatea de aport alimentar echivalentă cu măsurătorile luate în condiții normale de dietă. Luate împreună, aceste rezultate indică faptul că șoarecii cu deficit de RMI1 pot crește normal în ciuda dezvoltării anomaliilor bazale, sugerând că impactul deficitului de RMI1 este sensibil și limitat la obezitatea în curs de dezvoltare [[19]]. Cu toate acestea, nu putem exclude posibilitatea ca modificări bazale ușoare, cum ar fi greutatea corporală mai mică și anomalii încă neidentificate, pot afecta parțial echilibrul energetic. Sunt necesare studii viitoare pentru a clarifica dacă șoarecii cu deficit de RMI1 prezintă un fenotip asemănător BLM.
RMI1 și reglarea ciclului celular
Modul de acțiune al RMI1 în reglarea homeostaziei energetice se poate baza pe reglarea hiperplaziei adipocitelor. Studiile au arătat că eliminarea siRNA a RMI1 a dus la suprimarea proliferării celulare [[24]]. Cu toate acestea, expresia RMI1 este reglată în sus în țesutul adipos abdominal al șoarecilor obezi și diabetici, care prezintă hiperplazie adipocitară, sugerând că RMI1 poate fi asociat cu dezvoltarea acumulării de lipide în țesuturile metabolice, ducând astfel la obezitate [[19]]. Recent am observat că tratamentul cu glucoză a crescut expresia RMI1 în liniile celulare derivate din adipocite. În mod curios, ambele niveluri de ARNm ale E2F5 și E2F8 au crescut la tratamentul cu glucoză, așa cum se vede cu RMI1, iar eliminarea siARN a acestor gene a suprimat expresia RMI1. În plus, analiza computerizată a arătat dovezi ale siturilor de consens ale elementelor de răspuns E2F în promotorul RMI1 (Suwa A, Kurama T, Shimokawa T și Aramori I, observații nepublicate), sugerând că E2F poate transactiva promotorul. Luate împreună, aceste rezultate indică faptul că expresia RMI1 poate fi reglată de moleculele familiei E2F în țesutul adipos în condiții de glucoză ridicată, influențând proliferarea preadipocitelor.
RMI1 ca o țintă nouă pentru tratamentul obezității
Studii recente in vivo și in vitro au demonstrat că RMI1 joacă un rol important în reglarea homeostaziei energetice printr-o interacțiune cu căile E2F, cel puțin parțial, sugerând implicarea în reglarea hiperplaziei adipocitelor. Expresia RMI1 este indusă de glucoză in vitro, si este in vivo expresia este indusă și de anomalii metabolice precum hiperglicemia și obezitatea în țesuturile metabolice precum ficatul și țesuturile adipoase.
Concluzii
Obezitatea se dezvoltă ca urmare a întreruperii homeostaziei dintre consumul de alimente și consumul de energie și, prin urmare, factorii care afectează aceste procese sunt centrul unei cercetări extinse care vizează dezvoltarea unor medicamente anti-obezitate eficiente. Cu toate acestea, până în prezent s-a obținut doar un succes limitat în acest demers [28], subliniind necesitatea unor opțiuni terapeutice suplimentare. Recent, au fost raportate noi abordări și ținte interesante pentru tratamentul obezității, dintre care multe au fost citate în celelalte minireviews din această serie. O astfel de abordare este conceptul de reglare centrală, concentrându-se pe calea malonil - CoA [29]], în timp ce o altă abordare utilizează mediatorul inflamator derivat din adipocite [[30]]. Cu toate acestea, aici ne concentrăm pe o abordare nouă identificată recent care implică hiperplazie adipocitară, diferind în mod clar atât de abordările centrale, cât și de cele inflamatorii. Având în vedere că o serie de cauze moleculare au fost implicate în dezvoltarea obezității, combinarea acestor abordări diferite reprezintă probabil cea mai eficientă metodă de tratament.
Aportul excesiv de calorii asociat cu hiperfagia și ingerarea unei diete bogate în grăsimi la șoareci are ca rezultat stocarea de energie suplimentară, inițial printr-o creștere a dimensiunii adipocitelor. Cu toate acestea, întrucât adipocitele au o capacitate limitată de extindere, aportul pe termen lung de exces de calorii duce în cele din urmă la o creștere a numărului de adipocite pentru a permite depozitarea surplusului de energie. În acest minireview, am rezumat dovezi privind reglarea numărului de adipocite ca o nouă abordare promițătoare pentru tratarea obezității, iar această abordare poate reprezenta o țintă pentru medicamente noi anti-obezitate care previn hiperplazia adipocitelor. Cu toate acestea, orice potențial terapeutic nu este bine stabilit în prezent și, prin urmare, o înțelegere mai detaliată a hiperplaziei adipocitelor la om este esențială pentru dezvoltarea unor tratamente eficiente și sigure. După cum sa subliniat aici, RMI1 este una dintre cele mai promițătoare ținte pentru tratamentul obezității, cu potențialul de a influența puternic îngrijirea pacienților cu obezitate.
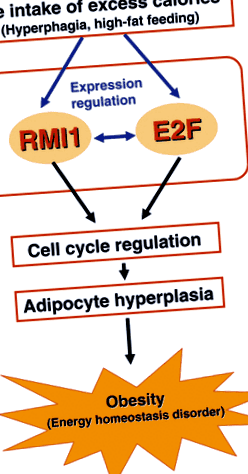
Modelul nostru ipotetic pentru reglarea hiperplaziei adipocitelor de către RMI1 este prezentat în Fig. 1. Aportul excesiv de calorii induce expresia RMI1 și E2F în adipocite și se așteaptă ca aceste modificări ale expresiei să crească o interacțiune pozitivă între molecule. Expresia crescută a RMI1 și E2F reglează astfel ciclul celular, ducând la hiperplazie adipocitară și la dezvoltarea obezității. Sunt în mod clar necesare studii suplimentare pentru a explora mecanismul detaliat și interacțiunea dintre moleculele RMI1 și E2F, precum și pentru a determina relevanța clinică a RMI1.
Un model ipotetic pentru reglarea hiperplaziei adipocitelor de către RMI1. Consumul excesiv de calorii datorat hiperfagiei și hrănirii bogate în grăsimi induce expresia RMI1 și E2F în adipocite și provoacă o interacțiune pozitivă între molecule. Exprimarea crescută a RMI1 și E2F reglează ciclul celular, ducând la hiperplazie adipocitară și la dezvoltarea ulterioară a obezității.
Mulțumiri
Mulțumim doctorilor Masao Kato, Ichiro Aramori, Hitoshi Matsushime, Masato Kobori, Jiro Hirosumi, Masayasu Yoshino, Shun - ichiro Matsumoto și Masanori Naitou la Astellas Pharma Inc., și Mses Chihiro Yamazaki și Rie Fujikawa la Trans Genic Inc. pentru sfaturile și sprijinul lor util.
- Statistici despre cancer, 2011 - Siegel - 2011 - CA A Cancer Journal for Clinicians - Wiley Online Library
- Aplicarea algoritmilor de tratare a obezității la adulții canadieni European Journal of Clinical
- Secțiunea cezariană și indicele de masă corporală la bărbații danezi - Svensson - 2013 - Obezitate - Wiley Online
- Asocierea dintre gustări și obezitate la copii o recenzie Nuru International Journal Of
- Erori legate de IMC în măsurarea obezității Jurnalul internațional de obezitate