Raphael Johannes Morscher
1 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Universitatea Medicală Paracelsus, Salzburg, Austria,
5 Divizia de Genetică Medicală, Universitatea de Medicină Innsbruck, Innsbruck, Tirol, Austria,
Sepideh Aminzadeh-Gohari
1 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Universitatea Medicală Paracelsus, Salzburg, Austria,
René Gunther Feichtinger
1 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Universitatea Medicală Paracelsus, Salzburg, Austria,
Johannes Adalbert Mayr
2 Departamentul de Pediatrie, Universitatea de Medicină Paracelsus, Salzburg, Austria,
Roland Lang
3 Departamentul de Dermatologie, Universitatea de Medicină Paracelsus, Salzburg, Austria,
Daniel Neureiter
4 Departamentul de Patologie, Universitatea de Medicină Paracelsus, Salzburg, Austria,
Wolfgang Sperl
2 Departamentul de Pediatrie, Universitatea de Medicină Paracelsus, Salzburg, Austria,
Barbara Kofler
1 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Universitatea Medicală Paracelsus, Salzburg, Austria,
Conceput și proiectat experimentele: BK RGF WS RJM. Au efectuat experimentele: RJM SAG RGF RL. Analizate datele: RJM RGF JAM DN WS BK. Am scris lucrarea: RJM BK.
Date asociate
Toate datele relevante se află în hârtie și în fișierele sale de informații de suport.
Abstract
Introducere
Neuroblastomul este un cancer pediatric malign derivat din celulele crestei neuronale. Se caracterizează printr-o reducere generalizată a fosforilării oxidative mitocondriale. Scopul prezentului studiu a fost de a investiga efectele restricției de calorii și ale dietei ketogenice asupra creșterii tumorii neuroblastomului și de a monitoriza potențialele mecanisme adaptative ale sistemului de fosforilare oxidativă a cancerului.
Metode
Xenogrefele au fost stabilite la șoareci nudi CD-1 prin injectare subcutanată a două linii celulare de neuroblastom având caracteristici genetice distincte și sensibilitate terapeutică [SH-SY5Y și SK-N-BE (2)]. Șoarecii au fost randomizați la patru grupuri de tratament care au primit dietă standard, dietă standard cu restricții calorice, dietă ketogenică pe bază de acizi grași cu lanț lung sau dietă cetogenă cu restricție calorică. Creșterea tumorii, supraviețuirea, parametrii metabolici și greutatea șoarecilor au fost monitorizate. Țesutul cancerului a fost evaluat pentru modificări induse de dietă ale indicilor de proliferare și parametrii multipli ai sistemului de fosforilare oxidativă (activități ale enzimei lanțului respirator, analiza Western blot, imunohistochimie și conținut de ADN mitocondrial).
Rezultate
Dieta cetogenică și/sau restricția calorică a redus semnificativ creșterea tumorii și supraviețuirea prelungită în modelul xenogrefei. Reducerea creșterii neuroblastomului s-a corelat cu scăderea concentrațiilor de glucoză din sânge și s-a caracterizat printr-o scădere semnificativă a nivelurilor de Ki-67 și fosfo-histonă H3 în grupurile de dietă cu creștere tumorală redusă. Ca și în țesutul tumoral uman, xenogrefele neuroblastomului au prezentat o activitate distinctă a complexului mitocondrial II, în combinație cu un nivel scăzut generalizat de fosforilare oxidativă mitocondrială, validând modelul tumorii. Neuroblastomul nu a arătat nicio capacitate de a-și adapta activitatea de fosforilare oxidativă mitocondrială la modificarea aportului de nutrienți indusă de intervenția dietetică.
Concluzii
Datele noastre sugerează că vizarea caracteristicilor metabolice ale neuroblastomului ar putea deschide un nou front în sprijinirea regimurilor de terapie standard. Prin urmare, propunem ca o dietă ketogenică și/sau o restricție calorică să fie evaluată în continuare ca o posibilă terapie adjuvantă pentru pacienții care urmează tratament pentru neuroblastom.
Introducere
Neuroblastomul (NB) este cea mai frecventă malignitate solidă extra-craniană din copilărie. Această tumoare a sistemului nervos periferic provine din simpatogonia primitivă care, în mod normal, dă naștere neuronilor postganglionari ai lanțului simpatic și ai medularei suprarenale [1]. Pe baza caracteristicilor biologice și clinice, boala poate fi clasificată în trei categorii de risc. În populația cu pacienți cu risc ridicat, în ciuda eforturilor ample de a îmbunătăți strategiile de tratament, prognosticul este slab, cu o supraviețuire estimată la 5 ani de 50%. Aceasta contrastează cu o rată de supraviețuire globală care depășește 90% în grupurile cu risc mediu și scăzut, în care optimizarea tratamentului s-a orientat către reducerea toxicităților abordării terapiei multimodale [2].
Metabolismul energiei mitocondriale a NB se caracterizează prin proteine și niveluri de activitate generalizate scăzute ale complexelor de fosforilare oxidativă (OXPHOS), împreună cu un număr redus de copii ale genomului mitocondrial (ADNmt). Cu toate acestea, masa mitocondrială, cuantificată prin markeri precum activitatea citratului sintază și conținutul de proteine ale canalului ionic dependent de tensiune (VDAC), este similară cu cea a glandelor suprarenale normale și a țesuturilor renale [3]. Deși mecanismele care induc acest fenotip sunt încă în curs de investigare, datele indică faptul că face parte din reprogramarea metabolică a celulelor NB care permite starea de diferențiere scăzută și capacitate proliferativă ridicată. Modificările funcției mitocondriale s-au dovedit a fi o componentă centrală a inducerii diferențierii în liniile celulare NB. Tratamentul cu acid retinoic, de exemplu, crește semnificativ consumul de oxigen bazal, precum și capacitatea respiratorie [4-6].
Aceste observații sunt în concordanță cu reprogramarea metabolismului celulelor canceroase pentru o utilizare crescută a glucozei, una dintre caracteristicile dezvoltării cancerului [7-9]. Dependența celulelor canceroase de glicoliza anaerobă, chiar și atunci când există suficient oxigen disponibil pentru a transfera piruvatul în calea OXPHOS, este cunoscută sub numele de efect Warburg [10]. Defectele izolate ale enzimelor sistemului OXPHOS pot fi o cauză directă a formării cancerului și a efectului Warburg, după cum se exemplifică în feocromocitoame și paraganglioame (ambele cu defecte în complexul II) sau oncocitoame (defecte în complexul I). Alte tumori solide precum carcinoamele cu celule renale sau NB sunt caracterizate printr-o reducere mai generală a tuturor complexelor OXPHOS [3, 11-18].
KD cu sau fără restricție de calorii (CR) a făcut parte, de zeci de ani, în gestionarea copiilor cu convulsii intratabile [34]. În populația pediatrică, KD este tolerată pe scară largă fără efecte secundare majore și a câștigat atenție în tratarea epilepsiei rezistente la terapie la adolescenți și adulți [35]. Regimurile clasice (cum ar fi protocolul Johns Hopkins) oferă un raport conținut de alimente de grăsimi față de carbohidrați și proteine de 3: 1 sau 4: 1 (în grame). Se aplică în mod obișnuit adaptări la acest regim de bază, cum ar fi combinarea acestuia cu CR variabil sau abordări mai liberale, cum ar fi dieta Atkins modificată [36, 37]. Mai recent, KD a fost sub evaluare pentru indicații alternative, cum ar fi obezitatea, sindromul ovarian polichistic și bolile degenerative ale sistemului nervos [38]. Mecanismul molecular al KD este slab înțeles, dar datele indică adaptări metabolice directe și indirecte multifactoriale, inclusiv o biogeneză mitocondrială crescută și o stare de energie celulară modificată [36, 39].
Metode
Linii telefonice
Liniile celulare SH-SY5Y (ATCC CRL-2266) și SK-N-BE (2) (ATCC CRL-2271) au fost alese pentru studiile cu xenogrefă. SH-SY5Y este o linie celulară de tip sălbatic TP53, care nu este amplificată NMYC, care nu prezintă pierderi de cromozom 1p de heterozigoză și este sensibilă la chimioterapie. Linia celulară SK-N-BE (2) prezintă rezistență ridicată la o gamă largă de agenți chimioterapeutici și se caracterizează prin amplificare NMYC, mutație TP53 (p.C135F) și pierderea cromozomului 1p de heterozigoză [48]. Celulele au fost crescute într-un amestec 1: 1 de mediu minim esențial Eagle și Ham F12 (Sigma), suplimentat cu 10% ser fetal bovin (PAA), Glutamax (Gibco), aminoacizi neesențiali (Sigma) și penicilină/streptomicină/amfotericină (Sigma).
Modele animale și pregătirea probelor
Toate experimentele in vivo au fost efectuate în conformitate cu protocoalele aprobate pentru acest studiu de Comitetul de îngrijire și utilizare a animalelor din Salzburg (Aprobarea studiului nr. 20901-TVG/44/7-2011). Animalele au fost întreținute în condiții specifice fără patogeni și îngrijire conformă cu Legea austriacă privind experimentarea animalelor. Xenogrefele au fost stabilite prin injectarea subcutanată a unei suspensii medii de 200 μl matrigel (BD Bioscience)/ser fără celule NB (2,7 × 107) pe flancul drept al șoarecilor CD-1 femele CD-1 în vârstă de 5 până la 6 săptămâni Charles Râu). După atingerea unei dimensiuni tumorale de 150 mm 3, șoarecii au fost randomizați în patru grupuri de terapie dietetică (n = 8-11).
Volumele tumorale au fost măsurate de două ori pe săptămână folosind etriere și calculate cu formula lățime * înălțime * lungime/2. Greutatea corporală, glicemia și nivelurile cetonice ale corpului (beta-hidroxibutirat) au fost monitorizate de două ori pe săptămână după o perioadă de post de două ore în grupurile hrănite ad libitum sau înainte de hrănire în grupurile cu restricții calorice. Tehnica aplicată este utilizată pe scară largă în diagnosticul clinic de rutină și utilizează metode bazate pe enzimă pentru cuantificare (Precision Xceed, Abbott) [49-51]. După inducerea anesteziei cu sevofluran șoarecii au fost sacrificați prin luxație cervicală în zile predeterminate (ziua 22 SH-SY5Y și ziua 33 SK-N-BE (2)) sau când au fost îndeplinite criteriile de terminare (starea de sănătate, ulcerație tumorală sau volum de 3000 mm 3) . Țesutul cancerului a fost înghețat rapid în azot lichid pentru măsurători OXPHOS și determinarea numărului de copii ADNmt. O bucată de tumoare de 0,5 cm fiecare a fost fixată în formalină și încorporată în parafină pentru analiză histologică.
Compoziția alimentelor și conținutul de energie
Șoarecii au fost hrăniți în conformitate cu patru regimuri diferite: dieta standard ad libitum (SD), dieta standard cu restricție de calorii (CR-SD), dieta ketogenică ad libitum pe bază de acizi grași cu lanț lung (KD) și dieta ketogenică cu restricție de calorii (CR-KD ). Conținutul energetic metabolizabil a fost după cum urmează: SD (kcal: grăsimi 9%, proteine 33% și carbohidrați 58%) și KD pe bază de acizi grași cu lanț lung (kcal: grăsimi 78%, proteine 14% și carbohidrați 8%) (Nr. V1535 -000 și nr. S9139-E02D; Sniff Spezialdiäten GmbH). O listă detaliată a ingredientelor este prezentată în Informații justificative (tabelul S1). Dietele au fost fortificate cu vitamine și suplimente minerale și au diferit ușor între cele două diete. Pentru a determina aportul mediu de calorii, 5 șoareci au fost monitorizați pentru hrănirea ad libitum pe o perioadă de 5 săptămâni (SD: medie 6,22 g ± 0,96/zi/șoarece; KD: 2,7 ± 0,4 g/zi/șoarece). Pentru grupurile CR, aportul de alimente a fost limitat la 2/3 din aportul ad libitum corespunzător. Acest grad de RC corespunde cu cele ale protocoalelor clinice pentru epilepsie rezistentă la terapie [35-37].
Extragerea a 600g omogenat
Un omogenat îmbogățit cu mitocondrie obținut prin centrifugare diferențială a fost utilizat pentru măsurarea activității enzimatice și analiza Western blot a complexelor OXPHOS. Această metodă crește specificitatea și este utilizată și pentru evaluarea bolilor metabolice moștenite [52, 53]. Un dezintegrator tisular (Ultraturrax, IKA) a fost utilizat pentru omogenizarea țesutului xenogref NB (50-100 mg) în tampon de extracție SEKT, pH 7,6 (250 mM zaharoză, 2 mM EGTA, 40 mM KCl, 20 mM Tris-HCl). Membranele celulare au fost apoi tăiate cu un omogenizator de sticlă din teflon acționat cu motor (Potter S, Brown). Centrifugarea omogenatului la 600g timp de 10 minute la 4 ° C produce supernatantul post-nuclear (600g omogenat) conținând fracția mitocondrială.
Măsurători enzimatice
Xenograft 600g omogenizează toate cazurile din grupurile SH-SY5Y (fiecare n = 8-11) și din cazurile reprezentative din grupele SK-N-BE (2) (fiecare n = 5) au fost utilizate pentru măsurători enzimatice. Activitățile tuturor enzimelor individuale ale complexelor OXPHOS I-V) și ale combinațiilor (complexele I + III și complexele II + III) au fost măsurate așa cum s-a descris anterior [3, 11, 54]. În plus, activitatea CS a fost măsurată deoarece este un marker bine stabilit al masei mitocondriale [55]. Toate cuantificările au fost bazate pe măsurători spectrofotometrice (Uvicon 922, Kontron) și efectuate la 37 ° C, cu excepția complexului V, 30 ° C.
Determinarea numărului de copie ADNmt
Pentru determinarea numărului de copii ADNmt, tratamentul cu proteinază K (Roche Diagnostics) a fost efectuat înainte de extragerea ADN-ului total din țesutul tumoral [58]. PCR cantitativă în timp real (iCycler, BioRad) a fost efectuată folosind doi loci ADN mitocondriali independenți (m.6625_6754 și m.9910_10198) și ADN nuclear (POLG și RRM2B). Apoi, conținutul de ADNmt a fost determinat prin calcularea raporturilor valorilor Ct. Numărul de copii MtDNA este dat ca genom n/diploid (secvențele perechilor de primer 1-2 și 3-4 sunt date în tabelul S2) [59].
Analiza Western blot
Omogenate de 600g au fost utilizate pentru analiza Western blot, așa cum s-a descris anterior [3]. Pe scurt, un total de 10 μg proteine au fost separate pe geluri 10% acrilamidă/bis-acrilamidă și transferate în membranele nitrocelulozice (Amersham Biosciences) folosind un tampon CAPS (10 mM acid 3- [ciclohexilamino] -1-propan sulfonic, pH 11 10% metanol). Următorii anticorpi primari au fost diluați în 1% reactiv de blocare vestic (Roche Diagnostics) dizolvat în TBS-T: anti-GAPDH (gliceraldehidă-3-fosfat dehidrogenază, 1: 10000, Trevigen), anti-NDUFS4 (NADH dehidrogenază [ubiquinonă] fier -sulfur protein 4; 1: 2000, Abcam), anti-SDHA (Succinate dehidrogenază [ubiquinonă] flavoproteină subunitate; 1: 5000, Abcam), anti-UQCRC2 (Citocrom b-c1 complex subunit 2; 1: 1000, Sigma), anti-MTCO2 (citocrom c oxidază subunitatea 2; 1: 5000, Abcam), anti-ATP5A (ATP sintază subunitate alfa; 1: 1000, Protein Tech), anti-SCOT (Succinil-CoA: 3-cetoacid coenzima A transferază 1; 1: 1000, Abnova). Anticorpii secundari etichetați cu peroxidază de hrean au fost utilizați la o diluție de 1: 1000 (Dako) și detectarea a fost efectuată cu substrat Lumi-Light POD (Roche).
Colorarea și analiza imunohistochimică
Complexele OXPHOS (complexul I-V) și indicii de proliferare (Ki-67 și PHH3) au fost evaluați în secțiunile tumorale deparafinate ale xenogrefelor NB. Pentru colorarea imunohistochimică s-au utilizat următorii anticorpi: anti-NDUFS4 (1: 1000, Abcam), anti-SDHA (1: 2000, MitoSciences), anti-UQCRC2 (1: 1500, MitoSciences), anti-MTCO2 (1: 1000, MitoSciences), anti-ATP5A (1: 2000, MitoSciences) și anti-VDAC1 (proteina canalului selectiv anionic dependent de tensiune 1; 1: 3000, MitoSciences), anti-Ki-67 (1: 200, Dako) și anti -PHH3 (1: 500, Cellmarque). Toți anticorpii au fost diluați în diluantul anticorpului Dako cu componente care reduc fondul (Dako). Procedurile de colorare și notare pentru complexele OXPHOS au fost efectuate așa cum sa raportat anterior [17, 45]. Proliferarea a fost evaluată prin evaluarea proporției de nuclee colorate pozitiv, marcând cel puțin 500 de celule pe lamă (Ki-67) sau numărând numărul de nuclee colorate pozitiv pe câmp de putere mare (PHH3). Pentru toate tumorile au fost punctate cel puțin cinci regiuni reprezentative, mărirea a fost de 400 de ori.
Statistici
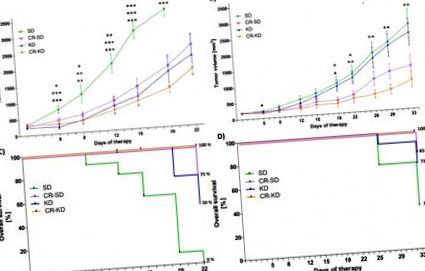
Analiza statistică pentru variabilele continue a fost realizată de ANOVA unidirecțional (p Fig. 1). În timp ce linia celulară SH-SY5Y prezintă caracteristici mai benigne și este sensibilă la chimioterapie, linia celulară SK-N-BE (2) este extrem de rezistentă la o gamă largă de agenți chimioterapeutici. Mai mult, acesta prezintă markeri de prognostic slab, cum ar fi amplificarea NMYC, mutația TP53 și pierderea cromozomului 1p de heterozigoză [48]. Xenogrefele liniei celulare SH-SY5Y au experimentat o inhibare semnificativă a creșterii în toate cele trei grupuri de intervenție dietetică (Fig. 1A). În ziua 19, volumul mediu al tumorii în grupul SD (3541 ± 219 mm 3) a fost semnificativ crescut comparativ cu grupul CR-SD (1884 ± 256 mm 3, p = 0,001), grupul KD (1721 ± 478 mm 3, p 3 p 3 înainte de ziua 22. Supraviețuirea pentru șoareci în SD în ziua 22 a fost 0% comparativ cu 75% pentru CR-SD (p Fig 1C). Creșterea tumorală în grupurile de dietă CR a fost semnificativ inhibată în SK-N-BE (2) xenogrefe (CR-SD 1348 ± 345 mm 3, p = 0,040 și CR-KD 909 ± 240 mm 3 p = 0,004) în comparație cu grupul SD (2661 ± 418 mm 3) Creșterea tumorii în grupul KD nu a fost modificat semnificativ (2395 ± 426 mm 3, p = 0,918) (Fig 1B) Supraviețuirea șoarecilor cu xenogrefe SK-N-BE (2) în SD în ziua 33 a fost de 36% comparativ cu 83% în CR-SD (p = 0,017), 73% pe KD (p = 0,09) și 100% pe CR - KD (p Fig. 1).
După stabilirea tumorilor pe flancul drept al șoarecilor CD-1nu, șoarecii au fost randomizați în grupuri de dietă, după cum sa indicat. Volumul tumorii a fost măsurat de două ori pe săptămână. A) Pentru xenogrefele SH-SY5Y în ziua 19, tumorile tuturor grupurilor de dietă au prezentat o inhibare semnificativă a creșterii în comparație cu grupul SD (CR-SD p = 0,001, KD p 3, ulcerații tumorale sau starea de sănătate afectată. Grupurile de dietă sunt comparate cu SD corespunzător. * p≤0.05; ** p≤0.01; *** p≤0.001.
Intervenția dietetică induce adaptări metabolice
c Raportul glicemiei (BG, mmol/l) la cetonă din sânge (BK, mmol/l), raportat anterior ca indice de cetonă a glucozei [60]. Fiecare grup n = 11. n.a.: Nu se aplică.
Indicii de proliferare sugerează arestarea G0 sau G1 precoce ca mecanism de creștere tumorală redusă
Ambele tipuri de celule SH-SY5Y A) și SK-N-BE (2) C) prezintă copii scăzute consistente ale genomului mitocondrial (figurile medii 2, figurile S1 și S2). Evaluarea enzimatică cuprinzătoare a tuturor complexelor individuale OXPHOS (I-V) și a acidului citric sintazat (CS, indicativ al masei mitocondriale) nu a arătat nicio diferență semnificativă în comparație cu activitatea grupului SD corespunzător (p> 0,05) (figurile S1 și S2).
Analiza complexă Western blot OXPHOS și colorarea imunohistochimică susțin activități enzimatice scăzute
Trei probe reprezentative de tumori din toate grupurile de dietă au fost evaluate pentru nivelurile complexe de proteine I-V (Fig. 4). Activitățile enzimatice scăzute în mod constant, fără modificări semnificative ale nivelurilor enzimatice, sunt susținute de nivelurile de proteine complexe OXPHOS din analiza Western blot. Cuantificarea intensităților de colorare ajustate la încărcare este dată în S3 Fig. Xenogrefele ambelor tipuri de celule prezintă abundență foarte mică de CII. CI, CIII și CIV au arătat o tendință către niveluri crescute de proteine în grupul CR-KD al liniei celulare SH-SY5Y. Nivelurile de proteine CV ale tumorilor SH-SY5Y și CI ale tumorilor SK-N-BE (2) nu au reflectat activitățile enzimatice respective. Acest lucru ar putea reflecta o activitate enzimatică scăzută care nu este legată de stabilitatea proteinelor subunității analizate.
Trei probe din fiecare grup de dietă au fost încărcate conform indicațiilor din partea de sus (SD, CR-SD, KD și CR-KD). Subunitățile reprezentative ale CI-CV au fost sondate așa cum sunt date în stânga. Ambele tipuri de celule prezintă o reglare descendentă puternică a CII, celelalte complexe fiind relativ mai conservate la nivel de proteină. GAPDH este afișat ca control de încărcare. Ca martori (cont1 și cont2), cortexul renal a fost utilizat așa cum este descris în [3]. Cuantificarea intensităților de colorare ajustate la încărcare este dată în S3 Fig.
Analiza imunohistochimică a complexelor individuale OXPHOS (I-V) efectuate în xenogrefele SH-SY5Y a relevat o scădere semnificativă a colorării complexului I în grupul CR-KD în comparație cu grupul SD (Fig 5; p) (53K, pdf)
- Dieta ketogenică ca terapie adjuvantă pentru tratamentul tumorii bucale (P05-020-19)
- Tensiunea arterială crescută cauzată de dieta ketogenică sau de uleiul de nucă de cocos pe forumurile zilnice de diabet
- Cum poate influența o dietă ketogenică Compoziția corpului Blog KetoDiet
- Recenzia lui Ivana (Zagreb, Croația) despre Keto Meal Prep 2018 The Essential Ketogenic Diet Meal Prep
- Scrisoare către editor despre „Compararea eficacității dietei ketogenice clasice și a dietei Atkins modificate