Qinghui Mu
1 Departamentul de Științe Biomedice și Patobiologie, Colegiul de Medicină Veterinară Virginia-Maryland, Virginia Tech, Blacksburg, VA, SUA
Jay Kirby
1 Departamentul de Științe Biomedice și Patobiologie, Colegiul de Medicină Veterinară Virginia-Maryland, Virginia Tech, Blacksburg, VA, SUA
Christopher M. Reilly
2 Edward Via Colegiul de Medicină Osteopatică, Blacksburg, VA, SUA
Xin M. Luo
1 Departamentul de Științe Biomedice și Patobiologie, Colegiul de Medicină Veterinară Virginia-Maryland, Virginia Tech, Blacksburg, VA, SUA
Abstract
Introducere
Microbiota intestinală a atras o atenție intensă în ultimul deceniu (9). Deși oamenii de știință au studiat microbiota intestinală de mai mulți ani, progresele recente în biologia moleculară, inclusiv tehnologia de secvențiere a generației următoare, au permis cercetătorilor să obțină o nouă perspectivă în acest domeniu de cercetare. În timp ce suntem încă departe de a înțelege în mod clar rolurile exacte și modul de efectuare a microbiotei intestinale, dovezile în creștere sugerează că microbiota intestinală este importantă în modularea permeabilității intestinale și a funcțiilor de barieră intestinală. În această revizuire, rezumăm progresele recente în înțelegerea intestinului cu scurgeri, a translocației bacteriene și a disbiozei microbiotei intestinale, cu un accent deosebit pe asocierea lor cu boli autoimune extraintestinale, cum ar fi T1D și LES.
Bariera intestinală
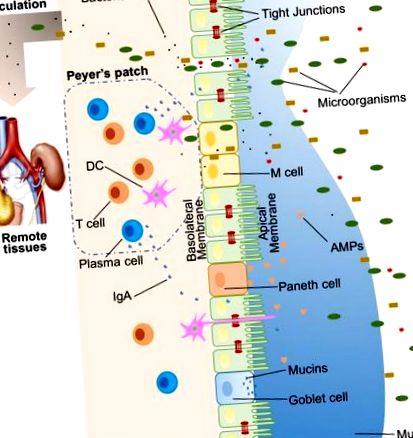
O mare varietate de substanțe exogene colonizează lumenul intestinal, cum ar fi microorganismele, toxinele și antigenele. Fără o barieră intestinală intactă și care funcționează corespunzător, aceste substanțe pot pătrunde în țesuturile de sub căptușeala epitelială intestinală, difuzând circulațiile sanguine și limfatice și perturbând homeostazia tisulară. Cu toate acestea, există un sistem eficient de bariere intestinale cu mai multe fațete, cu componente fizice, biochimice și imunologice, care împiedică intrarea majorității agenților patogeni (Figura (Figura 1). 1). Aceste componente se coordonează între ele pentru a preveni translocarea necontrolată a conținutului luminal în corp. Mai jos este un scurt sinopsis al principalelor componente care cuprind bariera intestinală.
Ilustrarea barierelor intestinale ale gazdei, inclusiv bariera fizică (epiteliu, joncțiuni strânse, mucus, bacterii comensale), barieră biomedicală [proteine antimicrobiene (AMP)] și barieră imunologică (limfocite și IgA). De asemenea, este prezentată translocația microbiană către țesuturile îndepărtate (de exemplu, rinichi și pancreas) în prezența unui intestin cu scurgeri.
Bariera fizica
La om, epiteliul intestinal acoperă o suprafață de până la 400 m 2 (1). Deși doar un singur strat de celule, celulele epiteliale intestinale (IEC) sunt pilonul principal al barierei intestinale și servesc drept barieră fizică (Figura (Figura 1). 1). Există cel puțin șapte tipuri de IEC funcționale - enterocite, celule calice, celule Paneth, celule microfiate (celule M), celule enteroendocrine, celule cupe și celule de tuf, deși funcțiile ultimelor două populații de celule nu sunt bine înțelese.) . Dintre toate aceste tipuri de celule, enterocitele reprezintă majoritatea absolută, reprezentând cel puțin 90% din celulele criptă sau celulele villus. Enterocitele sunt celule absorbante și vitale pentru absorbția nutrienților. Cu toate acestea, dovezi în creștere indică faptul că funcțiile enterocitelor nu se limitează la absorbția nutrienților. De exemplu, enterocitele pot controla abundența bacteriilor Gram-pozitive prin exprimarea RegIIIγ, un tip de proteine antimicrobiene (AMP) (11-13). Toate tipurile de celule epiteliale provin din celulele stem epiteliale intestinale Lgr5 +, care se află în cripte (14). Rata de rotație a IEC este ridicată, iar celulele sunt reînnoite la fiecare 3-5 zile în intestinul mamiferelor (10, 15), cu excepția celulelor Paneth, care au o durată de viață de aproximativ 2 luni.
Căptușeala IEC este continuă, iar contactul dintre IEC este etanșat de TJ (16). Calea paracelulară, spre deosebire de calea transcelulară, permite transportul substanțelor prin epiteliul intestinal prin spațiile dintre IEC. O mare varietate de molecule, în principal proteine, controlează plasticitatea TJ-urilor. Au fost recunoscute peste 40 de proteine TJ, incluzând ocludină, claudine, molecula de aderență joncțională A și tricelulină (17). În diferite condiții patologice, permeabilitatea paracelulară poate fi crescută, rezultând intrarea unor molecule nedorite, potențial dăunătoare.
Deasupra epiteliului intestinal, există două straturi de mucus, straturile interioare și exterioare, care acoperă întreaga căptușeală epitelială intestinală și oferă protecție fizică pentru a separa microorganismele luminale de epiteliu. Organizat de componenta sa majoră, o mucină MUC2 care formează un gel glicozilat, mucusul conține diverse molecule, inclusiv IgA, precum și enzime și proteine, cum ar fi lactoferina (18). Celulele calicice sunt tipul central de celule pentru formarea mucusului. Acestea produc nu numai mucină MUC2, dar secretă și alte componente de mucus, cum ar fi ZG16, AGR2, FCGBP, CLCA1 și TFF3 (19, 20). Colita s-ar dezvolta spontan la șoarecii cu deficit de Muc2, indicând un rol critic pentru MUC2 în protecția mucoasei (21). Pe lângă mucinele care formează gel, există un alt tip de mucină care se află în imediata apropiere a celulelor epiteliale, numite mucine transmembranare. Enterocitele sunt principalii producători de mucine transmembranare (20).
Bacteriile comensale intestinale au fost descrise ca o componentă a barierei fizice intestinale, în principal datorită celor două funcții majore ale acesteia (22). Primul este de a promova rezistența la colonizarea speciilor de bacterii dăunătoare sau patogene, concurând pentru nutrienți, ocupând locurile de atașare și eliberând substanțe antimicrobiene (23, 24). În plus, microbiota intestinală reglează digestia și absorbția nutrienților pentru a furniza energie celulelor epiteliale, care sunt o componentă majoră a barierei fizice (25). Un bun exemplu de aprovizionare directă cu energie este producerea de acizi grași cu lanț scurt de către microbiota intestinală, care sunt utilizați de colonocite pentru dezvoltarea și metabolismul lor (26). Luate împreună, IEC-urile, straturile de mucus și rezidenții microbieni intestinali servesc drept barieră fizică pentru a limita intrarea conținutului luminal neprietenos în țesuturile gazdă.
Bariera biochimică
Moleculele biochimice cu proprietăți antimicrobiene există atât în mucus, cât și în lumen și includ acizi biliari și AMP (27, 28) (Figura (Figura 1). 1). Aceste molecule diverse formează o rețea complicată pentru a reduce încărcătura bacteriilor colonizate și pentru a reduce șansa de contact între antigenele luminale și celulele gazdă. Sunt un bun supliment la bariera fizică și o componentă esențială a funcției de barieră intestinală.
Intestinul subțire proximal găzduiește foarte puține microorganisme (29). Dar, pe măsură ce distanța de stomac crește, pH-ul crește și numărul bacteriilor colonizate se sculează (30). Înfruntând un număr mare de microorganisme, care probabil depășesc numărul de celule gazdă, sunt generate mai multe AMP pentru a lupta împotriva invadatorilor. Aceste AMP sunt împărțite în mai multe tipuri, inclusiv α- și β-defensine, lectină de tip C, catelicidină, lizozimă și fosfatază alcalină intestinală (IAP) (27). Mecanismele lor antimicrobiene detaliate sunt discutate în altă parte (31). Ca producător major, dar nu exclusiv, de AMP, celulele Paneth susțin și mediază funcția de barieră biochimică.
Bariera imunologică
O altă componentă a barierei imunologice este secretorul IgA (SIgA). Fiind cea mai abundentă imunoglobulină din organism, IgA se află în principal pe suprafețele mucoasei intestinale. În timp ce unii oameni cu deficit de IgA selectiv par a fi sănătoși, SIgA este important deoarece interacționează probabil cu bacteriile comensale pentru a oferi protecție împotriva agenților patogeni. O caracteristică unică a SIgA este că este elastic din punct de vedere structural în medii bogate în protează, permițându-i să rămână activ funcțional în comparație cu alte izotipuri de anticorpi de pe suprafețele mucoasei (43). La omul adult, aproximativ 50 mg/kg de SIgA este produs zilnic de celulele plasmatice care locuiesc în lamina propria intestinală. În cele din urmă, SIgA poate fi transcitat prin epiteliu și secretat în lumenul intestinal.
Deși nu sunt menționați aici, factorii auto-modulatori, cum ar fi nervii și citokinele diverse, sunt, de asemenea, importanți pentru menținerea funcțiilor normale ale barierei intestinale.
Microbiota intestinală și bariera intestinală
Microbiota poate fi sesizată de gazdă prin intermediul receptorilor de recunoaștere a modelelor (PRR), cum ar fi receptorii asemănători (TLR) și receptorii asemănători domeniului oligomerizării care leagă nucleotidele (NOD) (NLR). În intestin, comunicațiile bacterie-gazdă sunt în mare măsură dependente de recunoașterea tiparelor moleculare asociate microbilor de către PRR exprimate pe celulele imune și neimune. Anumite microbiote, produse bacteriene și metaboliți afectează funcția de barieră intestinală și sunt responsabili pentru descompunerea ulterioară a homeostaziei tisulare. Când există un intestin cu scurgeri, bacteriile comensale din lumenul intestinal, împreună cu produsele lor, sunt capabile să scape din lumenul intestinului, care poate induce inflamație și poate provoca leziuni sistemice ale țesuturilor dacă sunt translocate în circulația periferică (Figura 1).). Acest proces de translocare se numește translocație microbiană (44).
În plus, există o interacțiune între microbii intestinali și AMP, cum ar fi IAP. Produs predominant de IEC, IAP este activ fie ancorat pe membrana epiteliului, fie secretat în lumenul intestinal (55, 56). La șoarecii cu deficit de IAP, s-a observat că au existat mai puțini microbi și o compoziție modificată a bacteriilor în comparație cu animalele de tip sălbatic de control. În special, cercetătorii au observat o scădere a Lactobacillaceae (57, 58). Activitatea IAP suprareglementată poate crește selectiv bacteriile care suprimă LPS (de exemplu, Bifidobacterium), reducând în același timp bacteriile producătoare de LPS (de exemplu, Escherichia coli) (59). Având capacitatea de a inactiva LPS in vivo, IAP este vital în prevenirea translocației LPS, stimulul proinflamator provenit de la bacterii (60, 61). De remarcat, expresia IAP se bazează pe prezența microbiotei. În peștele zebră GF, colonizarea comensalelor sau chiar furnizarea LPS singură ar putea induce suficient expresia IAP (62). Merită menționat faptul că IAP poate regla și proteinele TJ pentru a spori funcția de barieră prin creșterea expresiei ZO-1, ZO-2 și ocludină (63). Mai mulți alții au raportat, de asemenea, despre diferitele tipuri de AMP-uri și funcția lor în microbiotă (64, 65).
Mecanisme ale intestinului cu scurgeri
O mare varietate de perturbatori ai barierei intestinale și/sau perturbatori ai microbiotei intestinale poate duce la translocație microbiană și inflamații ulterioare la nivel local și sistemic. Acestea includ dieta, infecțiile, consumul de alcool și rănile provocate de arsuri.
Scurgeri intestinale induse de dietă
Scăderea intestinului indusă de stres
Infecțiile pot juca un rol în reglarea barierei mucoasei. Un bun exemplu este Helicobacter pylori, o bacterie Gram-negativă care infectează stomacul uman (104). Se știe că H. pylori crește direct permeabilitatea epitelială prin redistribuirea proteinei TJ ZO-1 (105, 106). În plus, bacteriofagii, care de obicei nu sunt considerați patogeni pentru mamifere, pot avea un impact asupra intestinului cu scurgeri. Când șobolanilor li s-a administrat un cocktail bacteriofag conținând fagi împotriva Salmonella enterica, s-a observat perturbarea integrității barierei intestinale (107). Autorii au speculat că microbiota intestinală ar fi putut fi afectată de bacteriofagi, dar datele de secvențiere nu au fost furnizate pentru a-și susține afirmațiile.
Luată împreună, perturbarea microbiotei intestinale, care poate fi o consecință a intervențiilor diverse, poate duce la creșterea permeabilității intestinale și la translocarea componentelor și produselor bacteriene. O astfel de translocație microbiană poate declanșa ulterior un răspuns imun anormal, provocând inflamații și/sau leziuni tisulare în organele extraintestinale.
Tulburări intestinale și autoimune
Mai multe stări de boală au fost asociate cu disbioză microbiotică intestinală, disfuncție a barierei intestinale și translocație microbiană. Acestea includ boala Alzheimer, ALD, cancerul și tulburările autoimune multiple. Tulburările autoimune se caracterizează prin generarea de autoanticorpi împotriva autoantigenelor care atacă propriile țesuturi ale corpului, rezultând daune. Declanșatorii genetici și de mediu sunt cunoscuți de mult timp ca principalii factori care contribuie la dezvoltarea autoimunității. Dovezi în creștere în ultimii ani sugerează că translocația microbiană și disfuncția barierei intestinale, care pot fi afectate de microbiota intestinală, sunt un alt element cauzal important pentru tulburările autoimune (2-6). T1D și LES sunt exemple discutate mai jos care dezvăluie progrese în înțelegerea mecanismelor din spatele interacțiunii dintre intestinul cu scurgeri și tulburările autoimune.
Diabetul de tip 1
Lupus eritematos sistemic
Inversarea intestinului cu scurgeri ca terapie potențială
Contribuțiile autorului
Toți autorii enumerați au adus o contribuție substanțială, directă și intelectuală la lucrare și au aprobat-o pentru publicare.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Note de subsol
Finanțarea. Pregătirea acestei publicații a fost susținută de Institutul Național de Alergii și Boli Infecțioase al Institutelor Naționale de Sănătate sub numărul de atribuire R03AI117597. Conținutul este exclusiv responsabilitatea autorilor și nu reprezintă neapărat opiniile oficiale ale Institutelor Naționale de Sănătate.
- Scade riscul bolilor cardiovasculare - 🍑 Cel mai bun mod de a slăbi în siguranță Diet Magic Plus
- Postul intermitent poate fi cheia pentru a ajuta la vindecarea unui intestin cu scurgeri
- Bolile de inimă la pisici - Bolile pisicilor Hill s Pet
- Remedii pe bază de plante pentru boli de inimă, tratament ayurvedic
- Boala umană - Boli ale nutriției Britannica