Pankaj G. Jain
1 Institutul de educație și cercetare farmaceutică R. C. Patel, Shirpur, Dist-Dhule-425405, Maharashtra, India
Sanjay J. Surana
1 Institutul de educație și cercetare farmaceutică R. C. Patel, Shirpur, Dist-Dhule-425405, Maharashtra, India
Abstract
Introducere
Maladies ale sistemului cardiovascular sunt un pericol proeminent pentru sănătate care duce adesea la moarte. Stilul de viață sedentar și obiceiurile alimentare eronate care includ consumul de grăsimi și zaharuri rafinate duc la o scădere a activității filamentelor de miozină și actină (Brai și colab., 2007 [7]) accentuează riscul de hiperlipidemie, un factor de risc demn de cunoscut tulburări cardiovasculare, ateroscleroză și complexități cardiovasculare aliate. Aproximativ 17,5 milioane de persoane au murit din cauza bolilor cardiovasculare (BCV), reprezentând 31% din totalul deceselor la nivel mondial și se așteaptă să crească la peste 23,6 milioane până în 2030 (Mozaffarian și colab., 2016 [37]). Se anticipează că proporția persoanelor hipertensive din India va crește de două ori până în 2025 (Brai și colab., 2007 [7]). Boala coronariană ischemică este un factor de risc remarcabil în patogeneza evenimentelor cardiovasculare adverse preoperatorii care sporește riscul de mortalitate la o subpopulație de pacienți cu risc chirurgical ridicat (Howard-Alpe și colab., 2006 [15]).
Profilul colesterolului pacientului joacă un rol decisiv în tratamentul hiperlipidemiei. Numeroase părți antihiperlipidemice, inclusiv statine, fibrate, niacină, acizi biliari, ezitimib etc. scade nivelul colesterolului, deși printr-un mecanism diferit (Durrington, 2003 [12]). În prezent, medicamentele disponibile hipolipidemice oferă ameliorare pentru o fracțiune de pacienți și au fost asociate cu o serie de efecte secundare, inclusiv hiperuricemie, diaree, greață, miozită, agravare gastrică, înroșirea feței, piele uscată și funcția hepatică modificată (Santharam et al., 2015 ([43]).
În cele din urmă, au fost dezvoltate câteva modele experimentale de hiperlipidemie pentru a caracteriza segmente distincte ale formelor fiziopatologice care descriu această boală. În studiul de față, hiperlipidemia la șobolani a fost indusă prin administrarea de HFD pe o perioadă de 60 de zile. S-a dovedit că HFD a determinat o creștere semnificativă a HDL-C în studiile clinice și preclinice (Katan și colab., 1994 [27]; Nevin și Rajamohan, 2009 [38]). Studiul anterior efectuat în laboratorul nostru a constatat că extractul de etanol al Prosopis cineraria (L.) Druce (Leguminosae) (sin. Prosopis spicigera L.) posedă o acțiune puternică anti-hiperlipidemică împotriva hiperlipidemiei induse de dietă bogată în grăsimi (Jain și Surana, 2016 [17]). Cu toate acestea, purificarea, standardizarea și evaluarea activității antihiperlipidemice a extractului de etanol de P. cineraria (ET-PCF) nu sunt încă raportate. Prin urmare, prezentul studiu a fost întreprins cu un obiectiv de izolare și caracterizare a ET-PCF și evaluarea sa pentru efectul antihiperlipidemic asupra șobolanilor experimentali de laborator.
Materiale și metode
Droguri și substanțe chimice
Diferite medicamente și substanțe chimice au fost obținute de la un producător disponibil comercial, cum ar fi HFD (60 kcal% grăsime, # D12492, 5,24 kcal/g, Research Diet Inc., New Brunswick, NJ, SUA). Colesterol, trigliceride, kituri HDL-C și LDL-C (Accurex Biomedical Pvt. Ltd., Mumbai, India), eter de petrol (60:80) și dietil eter (Merck, India).
Colectarea materialului vegetal
Fructele proaspete ale plantei P. cineraria au fost colectate din regiunea Satpuda din Maharashtra, India. Profesorul L. K. Kshirsagar (Taxonomist, Departamentul de Botanică, Colegiul de Științe L. K. Dr. Ghogre din S.S.V.P.S, Dhule, Universitatea North Maharashtra, Jalgaon) autentifica planta.
Un exemplar al acestuia a fost trimis la ierbarul diviziei.
Prepararea extractului de etanol și izolarea
Caracterizarea chimică a moleculei izolate
Tehnica cum ar fi UV, IR, 1H RMN, 13C RMN și LC-MS au fost utilizate pentru a determina structura chimică a compusului izolat. Spectrul IR a fost înregistrat folosind pelete KBr pe un spectrometru IR Perkin-Elmer (Perkin-Elmer, Waltham, MA). Spectrele 1H RMN și 13 C RMN au fost înregistrate folosind CDCl3 ca solvent pe Bruker Advance II 400 RMN și spectrele LC - MS au fost înregistrate la rezoluție înaltă pe un spectrometru de masă (sistemul Perkin Elmer Auto) la spectrometrul SAIF Panjab University, Chandigarh, datele sunt date în valori m/z.
Animale experimentale
Șobolani Sprague-Dawley masculi (180-220 g) au fost obținuți de la casa de animale de la facultate a Institutului R. C. Patel de Educație și Cercetare Farmaceutică, Shirpur, India. Au fost adăpostite în cuști bine ventilate și menținute la o temperatură controlată de 22 ± 2 ° C cu un ciclu de lumină/întuneric de 12 ore și control standard de laborator. Animalele au avut acces gratuit la chow standard pentru pelete (Pranav Agro-Industries Ltd., Sangli, India) și au filtrat apa ad libitum pe tot parcursul protocolului experimental. Comitetul de etică animală instituțională al Colegiului RCPIPER, Shirpur a aprobat protocolul de studiu (IAEC/RCPIPER/2012-13/09).
Dezvoltarea șobolanilor cu hrană bogată în grăsimi
Cele două regimuri dietetice, cum ar fi dieta normală cu pelete (NPD) și dieta bogată în grăsimi (HFD, 58% grăsimi, 25% proteine și 17% carbohidrați, ca procent din kcal total, ad libitum) au fost hrănite șobolanilor pentru prima dată perioada de 60 de zile. Compoziția și prepararea HFD așa cum au fost descrise în altă parte (Jain și Surana, 2016 [17]).
Proiectare experimentală
Studiile au fost efectuate la următoarele grupuri de animale
Grupa I: Șobolani normali: șobolanii au primit dietă normală pe pelete și au fost tratați cu vehicul (10 mg/kg de apă distilată)
Grupa II: Control HFD: șobolanii au primit o dietă bogată în grăsimi și au fost tratați cu vehicul (10 mg/kg de apă distilată)
Grupa III: AT (1,2): șobolanii au primit o dietă bogată în grăsimi și au fost tratați cu atorvastatină (1,2 mg/kg)
Grupa IV: FA (10): șobolanii au primit o dietă bogată în grăsimi și au fost tratați cu acid ferulic (10 mg/kg)
Grupa V: FA (20): șobolanii au primit o dietă bogată în grăsimi și au fost tratați cu acid ferulic (20 mg/kg)
Grupa VI: FA (40): șobolanii au primit o dietă bogată în grăsimi și au fost tratați cu acid ferulic (40 mg/kg).
Doza de FA (10, 20 și 40 mg/kg, p.o.) a fost selectată pe baza unei metode raportate anterior (Balasubashini și colab., 2004 [3]). Vehiculul sau atorvastatina sau FA au fost administrate pe cale orală timp de 60 de zile consecutive. După terminarea tratamentului, șobolanii au postit peste noapte și, după 24 de ore, au fost anesteziați secvențial cu eter anestezic timp de aproximativ 30-40 s. Sângele a fost retras prin puncție retro-orbitală. Fiecare probă de sânge a fost colectată în flacoane separate pentru determinarea parametrilor serici.
Pregătirea probelor de ser și estimări biochimice
Serul a fost separat prin centrifugare folosind o criocentrifugă Eppendorf (modelul nr. 5810, Eppendorf, Hamburg, Germania), menținut la 4 ° C și rulat la o viteză de 7000 rpm timp de 15 minute. Nivelurile de lipoproteine cu densitate mare (HDL), lipoproteine cu densitate mică (LDL), trigliceride (TG) și colesterol total (TC) au fost măsurate cu ajutorul unui spectrofotometru (spectrofotometru vizibil UV, Jasco V-530, Tokyo, Japonia) utilizând kituri de reactivi disponibile comercial conform procedurii furnizate de producător (Accurex Biomedical Pvt. Ltd., Mumbai, India) (Adil și colab., 2015 [1]; Honmore și colab., 2015 [14]).
Prepararea omogenatului hepatic
După recoltarea sângelui, animalul a fost sacrificat prin luxație cervicală și ficatul a fost îndepărtat și omogenizat imediat în 3 ml de tampon PBS răcit cu gheață. O parte din supernatant a fost utilizată pentru măsurarea ulterioară a SOD, GSH, MDA și NO în conformitate cu metodele raportate anterior (Adil și colab., 2015 [1]; Honmore și colab., 2015 [14]). Porțiunea rămasă din supernatantul hepatic a fost utilizată pentru măsurarea ulterioară a HDL, LDL, TG și colesterolului total, utilizând kituri de reactivi disponibile comercial conform procedurii furnizate de producător (Accurex Biomedical Pvt. Ltd., Mumbai, India). Un țesut hepatic din fiecare grup a fost prelucrat pentru examen histopatologic.
Histopatologia țesutului hepatic
Țesutul hepatic a fost fixat în formalină tamponată neutră 10% (v/v) timp de 24 de ore pentru studii histopatologice. A fost procesat timp de 12 ore folosind alcool izopropilic, xilen și parafină încorporate pentru studiu microscopic ușor (Nikon E200, Japonia). Secțiunile de țesut încorporate în parafină tăiate la 5 μm grosime au fost preparate și colorate după deparafinare utilizând colorare hematoxilină și eozină (H&E) pentru a verifica evaluarea morfologică. Fotomicrografiile au fost capturate la o mărire de 40X.
analize statistice
Toate analizele statistice au fost efectuate folosind GraphPad Prism 6.0 (GraphPad Software, Inc, La Jolla, CA, SUA). Datele referitoare la greutatea corporală și măsurătorile biochimice au fost analizate prin ANOVA unidirecțional separat, urmată de testul Dunnett separat pentru fiecare parametru. O valoare de p 1 H RMN, 13 C RMN și LC-MS
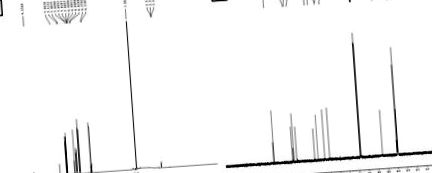
Structura chimică a compusului izolat a fost elucidată prin spectroscopie în infraroșu (IR), rezonanță magnetică nucleară cu protoni (1 H RMN), rezonanță magnetică nucleară cu carbon (13 C RMN) și experiment de cromatografie lichidă-spectrometrie de masă (LC-MS) . Caracterizarea compusului izolat a fost efectuată folosind FT-IR, 1 H RMN (Figura 1A (Fig. 1)), 13 C RMN (Figura 1B (Fig. 1)) și spectre LC-MS (Figura 2). 2 )). Rezultatele acestei caracterizări au sugerat că compusul izolat constă dintr-un singur fragment chimic cu 93% puritate. Compusul izolat obținut a fost solid de culoare galben deschis cristalin (punct de topire 168 ° C până la 172 ° C).
În LC-MS, vârful ionului molecular M + 1 vârf la m/z. 195.42 sugerând una dintre posibilele formule moleculare ca C10H10O4. Spectrul său IR a prezentat o bandă largă caracteristică de absorbție la 3438 cm -1 pentru grupul hidroxil, a prezentat în plus vârfuri largi la 2968 cm -1 pentru grupul acid carboxilic, 1691 cm -1 pentru gruparea carbonil și 1275 cm -1 pentru Grupul CO.
Spectrul său de 13 C RMN a arătat 10 semnale pentru 10 semnale de carbon în următoarea formă: (a) nouă CH, (b) un CH3.
Spectrul 1H RMN a arătat în plus prezența a trei grupări metil la ± 3,9 s, (3H, J¼5,0, 10,0 Hz), 6,2 d, (1H, J¼7,0, 10,0 Hz) de CH, 6,8 d, (1H, CH de inel ar.), 6,9 d, (1 H, CH de inel ar.), 7,1 s, (1 H, CH), 7,5 d, (1 H, CH) și 9,2 s, (1 H, OH) pentru gruparea hidroxil . Din datele RMN și LC-MS, structura compusului a fost confirmată a fi acid ferulic (Singh și colab., 2013 [45]) cu o puritate de 93%.
Efectul acidului ferulic asupra alterării induse de HFD în greutatea corporală și în greutatea ficatului la șobolani
Greutatea corporală și greutatea ficatului au fost semnificativ crescute (p (Tab. 1)). Cu toate acestea, greutatea corporală crescută și greutatea ficatului au scăzut semnificativ (p (Tab. 1)). Tratamentul cu atorvastatină (1,2 mg/kg) produce, de asemenea, o scădere semnificativă (p (Tab. 1)).
Efectul acidului ferulic asupra alterării induse de HFD a profilului lipidic seric și a indicelui aterogen al șobolanilor
Administrarea HFD crește semnificativ (p (Tab. 1)). Administrarea FA (10, 20 și 40 mg/kg) a determinat o scădere semnificativă și dependentă de doză (p (Tab. 1)).
A existat o scădere semnificativă (p (Tab. 1)). Tratamentul cu FA (20 și 40 mg/kg) inhibat în mod semnificativ și dependent de doză (p (Tab. 1)). În comparație cu grupul de control HFD, tratamentul cu atorvastatină (1,2 mg/kg) a produs, de asemenea, o inhibare semnificativă (p (Tab. 1)).
Efectul acidului ferulic asupra alterării induse de HFD a profilului lipidic hepatic și a indicelui aterogen al șobolanilor
Șobolanii martor HFD prezintă o creștere semnificativă (p (Tab. 2)). Administrarea FA (20 și 40 mg/kg) a dus la o inhibare semnificativă (p (Tab. 2)). Tratamentul cu atorvastatină (1,2 mg/kg) a produs, de asemenea, o inhibare semnificativă (p (Tab. 2)).
Efectul acidului ferulic asupra alterării induse de HFD la nivelurile hepatice SOD, GSH, MDA și NO ale șobolanilor
A existat o scădere semnificativă (p (Fig. 3)). Tratamentul cu FA (20 și 40 mg/kg) a crescut semnificativ (p (Fig. 3)). Administrarea de atorvastatină (1,2 mg/kg) a produs, de asemenea, o creștere semnificativă (p (Fig. 3)).
Efectul acidului ferulic asupra alterării induse de HFD în histologia ficatului de șobolan
Celulele inflamatorii moderate până la ușoare (săgeata neagră, gradul 2) au fost prezente la șobolanii tratați cu FA (10 și 20 mg/kg) (Figura 4D (Fig. 4) și Figura 4E (Fig. 4), respectiv și Tabelul 3) (Tab . 3)). Țesutul hepatic de la șobolanul tratat cu FA (40 mg/kg) a reflectat prezența infiltrării celulelor inflamatorii (săgeata neagră, gradul 1), vacuolizarea (gradul 1) și lipsită de orice depunere de grăsime veziculară, precum și necroză, congestie și edem 4F ( Fig. 4) și Tabelul 3 (Tab. 3)).
Discuţie
S-a raportat că producția crescută de NO a jucat un rol vital în inducerea diferitelor boli, inclusiv hiperlipidemia (Aydin, 2015 [2]). Vătămarea țesuturilor a apărut atunci când NO reacționează cu superoxid și formează peroxinitriți și este necesar să se inhibe această producție de NO pentru a ameliora leziunea țesuturilor (Kandhare și colab., 2013 [23], 2012 [24]). În prezenta investigație, HFD a provocat o inducere semnificativă a leziunilor hepatice prin creșterea producției de NO. Administrarea FA a avut ca rezultat o ameliorare semnificativă a producției crescute de NO induse de HFD. S-a raportat că FA a modulat biodisponibilitatea oxidului nitric (NO) și a scăzut sinteza iNO (Suzuki și colab., 2007 [49]). Rezultatul nostru oferă credință descoperirii cercetătorului anterior că FA a provocat inhibarea producției de NO.
S-a raportat că stresul oxidativ crescut contribuie la dezvoltarea sindromului metabolic legat de ateroscleroză (Choi și colab., 2010 [10]). Mai mult, cantități mari de trigliceride serice sunt corelate cu ateroscleroza cu risc crescut de boli de inimă și accident vascular cerebral (Ong și colab., 2009 [40]). Hiperlipidemia indusă de HFD este asociată cu mecanisme de apărare antioxidante modificate. Hipercolesterolemia duce la ateroscleroză, iar inhibarea peroxidării lipidelor inhibă această ateroscleroză (Yokozawa și colab., 2003 [52]). În prezenta investigație, șobolanii administrați cu HFD au prezentat un nivel ridicat de stres oxidativ împreună cu LDL-C și trigliceride care, la rândul lor, au crescut indicele aterosclerotic. Cu toate acestea, administrarea de FA a produs o inhibare semnificativă a indicelui aterosclerotic prin potențialul său antioxidant. Mai mult, rezultatele cercetărilor anterioare au arătat că compușii fenolici sunt eficienți în prevenirea formării și progresiei aterosclerozei, care se datorează în principal potențialului său antioxidant și hipocolesterolemiant (Carew și colab., 1987 [8]). FA este un compus polifenolic natural, posedă atât activitate antioxidantă, cât și hipocolesterolemiantă și care ar putea inhiba progresia aterosclerozei.
Atorvastatina este un agent eficient cu un potențial semnificativ de scădere a lipidelor utilizat pe scară largă în tratamentul hiperlipidemiei, aterosclerozei sau complicațiilor cardiovasculare (cum ar fi bolile coronariene) (Stancu și Sima, 2001 [47]). Are capacitatea de a inhiba enzima HMG-CoA reductază, o enzimă care generează mevalonat prin conversia din HMG-CoA. Această inhibare a enzimei HMG-CoA reductază servește ca o etapă de limitare a ratei în biosinteza colesterolului. Astfel, inhibarea HMG-CoA reductazei, la rândul său, determină o reducere a nivelului de colesterol, LDL-colesterol și colesterol total (Davignon și colab., 1992 [11]). Cu toate acestea, au capacitatea de a reduce concentrațiile de trigliceride, care depinde de nivelurile inițiale de trigliceride. Cu toate acestea, în prezenta investigație, FA a prezentat o reducere semnificativă a colesterolului total și a trigliceridelor din ser și, de asemenea, în țesutul hepatic.
În concluzie, structura chimică a compusului izolat a fost determinată prin experiment 1M RMN, 13C RMN și LC-MS, care a dezvăluit că doar un singur compus a fost izolat dintr-un extract de etanol de P. cineraria și caracterizat ca FA. În cele din urmă, FA izolată pură a fost selectată utilizând modelul de șobolan indus de HFD pentru acțiunea sa hipolipidemică folosind parametri serici și lipidici hepatici. FA (20 și 40 mg/kg) a dus la o reducere semnificativă a TC, TG, LDL, VLDL-C și la o creștere semnificativă a HDL-C în ser, precum și în țesutul hepatic. De asemenea, a avut ca rezultat o ameliorare semnificativă a stresului oxido-nitrozativ hepatic indus de HFD. Un studiu recent a arătat, de asemenea, că FA ameliorează sindromul metabolic indus de o dietă bogată în carbohidrați într-un model de șobolan (Senaphan și colab., 2015 [44]). Astfel, se concluzionează că extractul de etanol din P. cineraria a avut activitate hipolipidemică în principal datorită FA prin inhibarea stresului oxido-nitrosativ crescut. Aceste rezultate cu FA izolată pură și rezultatele anterioare cu extract de etanol de P. cineraria confirmă faptul că P. cineraria este benefic în prevenirea hiperlipidemiei la animalele de laborator. Cu toate acestea, se desfășoară studii suplimentare pentru elucidarea mecanismului de acțiune al FA izolat din P. cineraria la nivel molecular.
Declarație de interes
Autorii nu raportează niciun conflict de interese.
- Activitatea hipolipidemică a Moringa oleifera Lam, Moringaceae, indusă de o dietă bogată în grăsimi
- Activitatea hipolipidemică a Moringa oleifera Lam, Moringaceae, indusă de o dietă bogată în grăsimi
- Există vreo asociere între excesul de greutate, activitatea fizică, aportul de grăsimi și fibre cu
- L-carnitina și tipul de grăsime din dieta maternă în timpul gestației și alăptării modifică acidul gras
- Nanofibre puternic mecanic, lipite de hidrogen, cu activitate antioxidantă reglabilă, aplicate ACS