Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Corespondență: Dr. Kenichi Ikejima, Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, 2-1-1 Hongo, Bunkyo - ku, Tokyo, 113-8421 Japonia. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Corespondență: Dr. Kenichi Ikejima, Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, 2-1-1 Hongo, Bunkyo - ku, Tokyo, 113-8421 Japonia. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Departamentul de Gastroenterologie, Școala de Medicină a Universității Juntendo, Tokyo, Japonia
Abstract
Nu a fost stabilit tratamentul farmacologic pentru steatohepatita nealcoolică legată de sindromul metabolic. Am investigat efectul L-carnitinei, o substanță esențială pentru β-oxidare, asupra steatohepatitei metabolice la șoareci.
Metode
Șoarecii masculi KK - A y au fost hrăniți cu o dietă bogată în grăsimi (HFD) timp de 8 săptămâni, cu supliment de L - carnitină (1,25 mg/ml) în apă potabilă în ultimele 4 săptămâni.
Rezultate
Nivelurile serice totale de carnitină au fost reduse după alimentarea cu HFD, în timp ce nivelurile au fost inversate aproape complet prin suplimentarea cu L-carnitină. La șoarecii cărora li s-a administrat L-carnitină, exacerbarea steatozei hepatice și a apoptozei hepatocitelor a fost prevenită în mod semnificativ, chiar dacă alimentarea cu HFD a fost continuată. Creșterea în greutate corporală, precum și hiperlipidemia, hiperglicemia și hiperinsulinemia, după hrănirea cu HFD, au fost, de asemenea, prevenite în mod semnificativ la șoarecii cărora li sa administrat L - carnitină. Dieta bogată în grăsimi care hrănește niveluri crescute de expresie hepatică a carnitinei palmitoyltransferase 1A mARN; cu toate acestea, producția de β-hidroxibutirat în ficat nu a fost afectată numai de HFD. În schimb, tratamentul cu L - carnitină a crescut semnificativ conținutul de β - hidroxibutirat hepatic la șoarecii hrăniți cu HFD. L - carnitina, de asemenea, a atenuat inducția HFD în proteina de legare a elementului de reglare a sterolului - 1c mARN în ficat. Mai mult, L - carnitina a inhibat fosforilarea serină indusă de HFD a substratului receptorului de insulină - 1 în ficat. L - carnitină a scăzut conținutul de acizi grași liberi hepatici în 1 săptămână, cu îmbunătățirea morfologică a mitocondriilor umflate în hepatocite și creșterea conținutului de adenozină hepatică 5 ’- trifosfat.
Concluzii
L - carnitina ameliorează steatohepatita la șoarecii KK - A y hrăniți cu HFD, cel mai probabil prin facilitarea β-oxidării mitocondriale, normalizarea semnalelor insulinei și inhibarea lipogenezei noi în ficat. Prin urmare, se postulează că suplimentarea cu L-carnitină este o abordare promițătoare pentru prevenirea și tratamentul steatohepatitei nealcoolice legate de sindromul metabolic.
Introducere
Boala hepatică grasă nealcoolică (NAFLD) este un spectru larg de tulburări hepatice caracterizate prin dovezi ale steatozei hepatice fie prin imagistică, fie prin histologie și excluderea adecvată a altor etiologii, cum ar fi consumul intens de alcool, virusurile hepatitei și autoimunitatea. 1 Steatohepatita nealcoolică (NASH) este o formă progresivă a NAFLD, care duce în cele din urmă la ciroză hepatică și cancer. Incidența NASH este în creștere la nivel mondial2 și este în prezent a treia indicație cea mai frecventă pentru transplantul de ficat. 3 Steatohepatita nealcoolică este recunoscută ca manifestare hepatică a sindromului metabolic, deoarece obezitatea, rezistența la insulină și dislipidemia contribuie profund la dezvoltarea NASH. 4-6 Patogeneza NASH rămâne încă complet elucidată, iar farmacoterapia NASH legată de sindromul metabolic nu a fost bine stabilită.
L-carnitina, un constituent proteic asemănător vitaminei, este indispensabilă pentru oxidarea β mitocondrială, prin care acizii grași liberi (FFA) sunt catabolizați. 7 Deficitul sistemic de carnitină primară se caracterizează de obicei prin episoade de hipoglicemie hipoketotică și hepatomegalie datorate steatozei hepatice cu niveluri serice crescute de aminotransferaze și amoniac la sugari, care sunt rezolvate semnificativ prin aportul de L - carnitină. 8 Deficiența dobândită a L-carnitinei este adesea observată la pacienții supuși hemodializei, în care sa efectuat suplimentarea L-carnitinei pentru a spori eficacitatea eritropoietinei asupra anemiei renale și pentru a ameliora simptomele intradialytice. 9, 10 Epuizarea L-carnitinei apare, de asemenea, în urma tratamentului pe termen lung cu anumite medicamente, cum ar fi promedicamentele care generează pivalat și acidul valproic, iar suplimentarea cu L-carnitină s-a dovedit a îmbunătăți hiperamonemia la pacienții psihiatrici care primesc acid valproic. 9, 11 11 Unele studii clinice au sugerat recent eficacitatea potențială a L - carnitinei la pacienții cu NAFLD. 12, 13 S-a raportat că L-carnitina previne steatohepatita indusă de streptozotocină și hepatocarcinogeneza ulterioară într-un model murin (șoareci STAM); Cu toate acestea, efectul L-carnitinei asupra NASH legat de sindromul metabolic este încă neclar.
Șoarecii KK - A y sunt o tulpină generată de la șoarecii KK diabetici prin introducerea mutației galbene letale (A y), care determină expresia aberantă a genei agouti pe cromozomul 2. Șoarecii KK - A y prezintă un fenotip similar sindromului metabolic uman, inclusiv obezitatea, dislipidemie și rezistență la insulină, în combinație cu dezvoltarea spontană a steatohepatitei; astfel, acest animal este potențial util ca model de NAFLD/NASH. 15 Am raportat că șoarecii KK - A y prezintă o susceptibilitate crescută la metionină și colină - dieta cu deficit de steatohepatită indusă, 16 și leziuni hepatice induse de acetaminofen. 17 Am raportat, de asemenea, că șoarecii KK - A y prezintă modificări proporționale și funcționale ale celulelor T ucigătoare naturale hepatice, 18 și afectate de regenerarea ficatului după hepatectomie parțială. 19 KK - Șoarecii hrăniți cu o dietă bogată în grăsimi (HFD) dezvoltă steatohepatită mai severă, 20, 21 asemănătoare cu sindromul metabolic asociat cu NASH.
Prin urmare, scopul nostru în acest studiu a fost de a investiga efectul L-carnitinei asupra steatohepatitei legate de sindromul metabolic în șoarecii KK - A y hrăniți cu HFD.
Metode
Experimente pe animale
Protocoalele experimentale au fost aprobate de Comitetul animalelor de laborator în conformitate cu orientările instituționale. Bărbații, șoareci de 7 săptămâni KK - A y au fost cumpărați de la CLEA Japonia (Tokyo, Japonia). Șoarecii au fost adăpostiți în spații de animale specifice, fără patogeni, cu aer condiționat, cu iluminare de la 0800 la 2000 pe tot parcursul acestui studiu și li s-a oferit acces nerestricționat la un chow de laborator standard și apă în timpul perioadei de aclimatizare de 1 săptămână. După aclimatizare, șoarecii KK - A de 8 săptămâni au fost hrăniți cu HFD (HFD32; CLEA Japonia) (Tabelul 1) timp de 8 săptămâni. După o perioadă inițială de hrănire de 4 săptămâni, unele animale au fost tratate cu soluție de clorhidrat de L - carnitină (1,25 mg/ml în apă potabilă; Otsuka Pharmaceutical Co., Ltd., Tokyo, Japonia) timp de 4 săptămâni. KK - Șoarecii hrăniți cu chow normal timp de 4 săptămâni au fost folosiți ca martori. După tratamentul dietetic cu/fără supliment de L - carnitină, șoarecii care au postit peste noapte au fost uciși prin exanguinare din vena cavă inferioară sub anestezie cu eter și s - au obținut probe de ficat și ser. Probele de ser și țesut pentru prepararea ARN au fost menținute congelate la -80 ° C până la testare.
| Cazeină din lapte | 24.500 e cel mai frecvent | Lactoză | 6.928 e cel mai frecvent |
| Trei albume | 5.000 | Zaharoza | 6.750 este cel mai frecvent |
| L-cistină | 0,430 | Amestec de vitamine | 1.400 |
| Grăsime de vită | 15.880 e cel mai frecvent | Amestec de minerale | 5.000 |
| Ulei de șofrănel | 20.000 | Bitratrat de colină | 0,360 |
| Celuloză | 5.500 | Butilhidrochinona | 0,002 |
| Maltodextrină | 8.250 e cel mai frecvent |
Analiza histologică și imunohistochimie
Pentru evaluarea histologică, țesuturile hepatice au fost fixate în formalină tamponată 10% și încorporate în parafină și s-a efectuat colorarea hematoxilinei-eozină. Produsul de scindare Caspase al citokeratinei (ccCK) 18 a fost detectat prin imunohistochimie utilizând anticorp monoclonal M30 CytoDEATH (Roche, Basel, Elveția) așa cum s-a descris anterior. 22 Pe scurt, secțiunile de țesut deparafinat au fost incubate cu un anticorp monoclonal anti-M30 și imunoglobulină G anti-șoarece biotinilată secundară, iar legarea specifică a fost vizualizată cu soluție complex avidin-biotină urmată de incubare cu o soluție de 3, 3 - diaminobenzidină tetrahidroclorură folosind o Kit Vectastain Elite ABC (Vector Laboratories, Burlingame, CA, SUA). Eșantioanele au fost observate la microscop optic (DM7000; Leica, Wetzlar, Germania) echipate cu o cameră digitală cu microscop (MC120HD; Leica), iar imaginile digitale au fost capturate.
Analiza microscopului electronic
O porțiune de specimen de ficat a fost scufundată în fixativ conținând glutaraldehidă 3% în 0,1 mol/L tampon fosfat (pH 7,4) la 4 ° C timp de 24 ore. Au fost pregătite secțiuni ultrasunete de ficat și observate prin microscopie electronică prin transmisie așa cum s-a descris anterior. 23
Biochimia sângelui
Nivelurile serice de aspartat aminotransferază, alanină aminotransferază, trigliceride și glucoză au fost determinate folosind un sistem Fuji DRI-CHEM (Fuji Film Medical Co. Ltd., Tokyo, Japonia).
Măsurarea carnitinei
Carnitina totală serică și cea liberă au fost măsurate prin metoda ciclului enzimatic folosind truse comerciale (KAINOS Laboratories Inc., Tokyo, Japonia) urmând instrucțiunile producătorului. Acil-carnitina a fost calculată ca diferență între carnitina totală și cea liberă.
Măsurarea FFA
Conținutul seric și hepatic de FFA au fost măsurate printr-o metodă bazată pe enzime folosind kitul gratuit de cuantificare a acizilor grași (BioVision, Milpitas, CA, SUA) urmând instrucțiunile producătorului. Cantitatea de conținut de FFA hepatic a fost normalizată în funcție de greutatea probelor de țesut.
Măsurarea corpurilor cetonice
β-Hidroxibutiratul din țesutul hepatic a fost măsurat folosind un kit de analiză fluorometrică β-hidroxibutirat (corp cetonic) (Cayman Chemical Company, Ann Arbor, MI, SUA). Pe scurt, 50 mg de țesut hepatic au fost omogenizate într-un tampon de 300 ml folosind un omogenizator de teflon. Omogenatul a fost amestecat cu volumul echivalent al acidului metafosforic 1 mol/L și centrifugat la 10.000 g timp de 5 min. Peleta a fost dizolvată în 60 pl de soluție de carbonat de potasiu de 5 mol/L. După centrifugare la 10.000 g timp de 5 minute, supernatantul a fost colectat și 25 μL de supernatant a fost apoi amestecat cu același volum de soluție de β-hidroxibutirat dehidrogenază. După 30 de minute de incubație la 37 ° C, fluorescența a fost măsurată folosind un spectrofotometru de fluorescență cu lungime de undă de excitație și emisie de 530-540 nm și respectiv 585-595 nm. Cantitatea de conținut hepatic de β-hidroxibutirat a fost normalizată din greutatea probelor de țesut.
Măsurarea adenozinei 5 ’- trifosfat
Conținutul de adenozină 5 ’- trifosfat (ATP) din țesutul hepatic a fost măsurat prin testul luciferazei folosind un kit de testare ATP pentru țesuturile animale (TOYO B - Net Co., Ltd., Tokyo, Japonia) urmând instrucțiunile producătorului.
Test legat de imuno absorbția enzimelor
Nivelurile serice de insulină au fost măsurate utilizând setul de testare imunosorbentă legată de enzima de șoarece (ELISA) (Institutul Morinaga de Științe Biologice, Inc., Kanagawa, Japonia). Fosforilarea cu serină a substratului receptorului de insulină (IRS) -1 în țesutul hepatic a fost determinată folosind PathScan Phospho - IRS-1 (Ser307) Sandwich ELISA Kit (Cell Signaling Technology, Danvers, MA, SUA).
Pregătirea ARN și transcrierea inversă în timp real - reacția în lanț a polimerazei
analize statistice
Analizele morfometrice și densitometrice au fost efectuate folosind Scion Image (versiunea Beta 4.0.2; Scion Corp., Fredrick, MD, SUA). Datele au fost exprimate ca medie ± eroare standard a mediei. Diferențele statistice între medii au fost determinate folosind anova unidirecțională sau Kruskal-Wallis anova pe ranguri, urmată de o procedură de comparație multiplă în perechi (metoda Student - Newman - Keuls), după caz. P
Rezultate
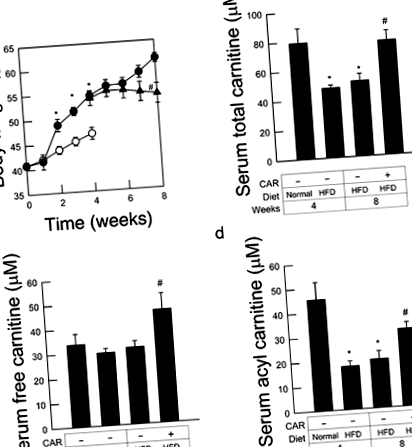
L - carnitina blunt creșterea în greutate corporală și crește nivelul seric de carnitină la șoarecii KK - A y
Șoarecii KK - A și hrăniți cu diete bogate în grăsimi au crescut rapid greutatea corporală, valorile ajungând la 54,5 ± 0,9 g și 61,4 ± 0,9 g după 4 și respectiv 8 săptămâni. Tratamentul cu L - carnitină, început după 4 săptămâni de pre-alimentare, a împiedicat în mod semnificativ creșterea în greutate corporală aproape complet, cu valori la 8 săptămâni după hrănirea cu HFD atingând doar 54,2 ± 2,0 gP
Pentru a evalua starea insuficienței de carnitină, am măsurat nivelurile serice totale și de carnitină liberă. Nivelurile totale de carnitină au fost semnificativ mai mici la șoarecii KK - A y hrăniți cu HFD timp de 4 săptămâni, comparativ cu șoarecii hrăniți cu o dietă de control. Cu toate acestea, nivelurile de carnitină fără ser, care reflectă cantitatea de aport alimentar și sinteza în ficat/rinichi, 9 nu au fost reduse după alimentarea cu HFD. La rândul său, nivelurile serice de acil-carnitină au fost semnificativ mai mici la șoarecii hrăniți cu HFD, indicând faptul că consumul sistemic de carnitină a fost crescut prin hrănirea cu HFD. Așa cum era de așteptat, nivelurile totale de carnitină au fost ridicate la niveluri aproape bazale atunci când șoarecii au primit L-carnitină timp de 4 săptămâni consecutive. Tratamentul cu L - carnitină a crescut în mod semnificativ atât acilul, cât și carnitina liberă (Fig. 1b - d).
L-carnitina ameliorează steatoza hepatică la KK-A și șoareci
Așa cum era de așteptat, acumularea masivă de grăsime în hepatocite cu degenerescență cu balon a fost observată la 8 săptămâni după hrănirea cu HFD, care a fost prevenită dramatic prin administrarea de L - carnitină (Fig. 2a - d). Raportul ficat/corp a crescut la 8 săptămâni după hrănirea cu HFD, în timp ce nivelurile au fost semnificativ reduse la șoarecii cărora li s-a administrat L-carnitină (P
L-carnitina previne apoptoza indusă de HFD a hepatocitelor la șoareci KK - A y
Pentru a evalua apoptoza hepatocitelor, s-a efectuat colorarea imunohistologică pentru ccCK18 folosind un anticorp M30 CytoDEATH. Hrana cu diete bogate în grăsimi a crescut numărul de celule pozitive ccCK18 la 20,9 ± 1,8 pe câmp la 4 săptămâni, urmată de o creștere suplimentară la 41,6 ± 0,9% după 8 săptămâni (P
L - carnitina previne hiperlipidemia după inhibarea lipogenezei de novo și activarea β-oxidării
La șoarecii KK - A y, hrănirea cu HFD timp de 8 săptămâni a crescut semnificativ nivelurile de FFA și trigliceride serice la 170,1 ± 14,9 μmol/L și 347,0 ± 66,8 mg/dL, care au fost semnificativ scăzute prin tratamentul cu L - carnitină la 65,1 ± 7,1 μmol/L și, respectiv, 71,0 ± 4,3 mg/dL (P 25 și producția de β-hidroxibutirat în ficat au fost evaluate. Expunerea la HFD a crescut semnificativ expresia mARN-ului CPT1A (Fig. 4d), dar nu a crescut β-hidroxibutiratul în ficat după 8 săptămâni. Tratamentul cu L-carnitină a crescut semnificativ β-hidroxibutiratul la valori mai mari de două ori decât la șoarecii hrăniți cu HFD timp de 8 săptămâni (P
L - carnitina îmbunătățește hiperglicemia și hiperinsulinemia la șoarecii KK - A y hrăniți cu HFD
Hrana cu diete bogate în grăsimi a crescut semnificativ nivelul glucozei și insulinei la jeun la 468,8 ± 64,5 mg/dL și 37,3 ± 5,5 ng/ml la 8 săptămâni, respectiv, care au fost reduse semnificativ prin tratamentul cu L - carnitină la 217,2 ± 30,0 mg/dL și respectiv 4,4 ± 1,3 ng/mL (P
L-carnitina reduce conținutul de FFA și îmbunătățește morfologia mitocondrială și producția de ATP în ficat
După 1 săptămână de tratament, L - carnitina a redus semnificativ conținutul de FFA hepatic crescut prin hrănirea cu HFD (P
Discuţie
L-carnitina a prevenit în mod semnificativ supraexprimarea ARNm-ului SREBP-1c indus prin hrănirea HFD (Fig. 4c), care este principalul factor de transcripție care reglează lipogeneza de novo. Deoarece calea de semnalizare a insulinei care implică IRS - 2/fosfoinozidă 3 - kinază reglează pozitiv expresia SREBP1c, 29 hiperinsulinemia contribuie cel mai probabil la reglarea în sus a SREBP1c în ficatul de șoarece KK - A y. Prin urmare, se presupune că L - carnitina scade expresia SREBP1c, cel puțin parțial, prin normalizarea hiperinsulinemiei (Fig. 5b).
În concluzie, L - carnitina ameliorează semnificativ steatohepatita dietetică la șoarecii KK - A y, în paralel cu îmbunătățirea anomaliilor metabolice. Mecanismele care stau la baza implică cel mai probabil creșterea L-carnitinei a β-oxidării mitocondriale, care reduce conținutul excesiv de FFA hepatic, atenuând astfel lipotoxicitatea care determină anomalii metabolice și leziuni celulare în hepatocite. Prin urmare, se postulează că suplimentarea cu L - carnitină este o abordare promițătoare pentru prevenirea și tratamentul NASH legat de sindromul metabolic.
- Efectele metabolice ale complexului de gel de aloe vera la prediabetul obez și la diabetul netratat timpuriu
- Indicele de masă corporală scăzut în endometrioză este promovat de disregularea genei metabolice hepatice la șoareci
- Ingineria metabolică a lactatului dehidrogenază salvează șoarecii din acidoză Rapoarte științifice
- MD Medical Group deschide un nou spital în Novosibirsk 17 februarie 2017 - MD Medical Group Mother and
- Cum să ajute un câine obez să piardă în greutate