Subiecte
Abstract
Acidoza cauzează milioane de decese în fiecare an și sunt necesare strategii pentru normalizarea pH-ului sanguin la pacienții cu acidoză. Calea lactatului dehidrogenază (LDH) are un potențial mare pentru tratarea acidozei datorită capacității sale de a transforma protoni și piruvat în lactat și, prin urmare, de a crește pH-ul din sânge, dar a provocat dezvoltarea unei terapii, deoarece nu există abordări farmaceutice pentru ingineria metabolică. căi in vivo. În acest raport demonstrăm că fluxul metabolic al căii LDH poate fi modificat cu compusul acid 5-amino-2-hidroximetilfenil boronic (ABA), care leagă lactatul și accelerează consumul de protoni prin transformarea piruvatului în lactat și creșterea NAD Raportul +/NADH. Am demonstrat aici că ABA poate salva șoarecii din acidoză indusă de metformină, prin legarea lactatului și creșterea pH-ului sângelui de la 6,7 la 7,2 și a raportului NAD +/NADH din sânge de 5 ori. ABA este prima clasă de molecule care poate proiecta metabolic calea LDH și are potențialul de a avea un impact semnificativ asupra medicamentelor, având în vedere numărul mare de pacienți care suferă de acidoză.
Introducere
Acidoza are o rată de mortalitate de 50% în rândul pacienților cu afecțiuni critice. Acidoza este cauzată de disfuncția mitocondrială în producția de ATP, ceea ce duce la acumularea de protoni 1. Terapia actuală pentru acidoză lactică este tratamentul cu bicarbonat, care este ineficient din cauza numeroaselor sale efecte secundare toxice, cum ar fi modificarea tensiunii arteriale, declanșarea apoptozei și modificarea nivelurilor de pH intracelular 2,3,4,5. Dicloracetatul este un tratament potențial pentru acidoză, care îmbunătățește activitatea piruvat dehidrogenazei și blochează producția de lactat, totuși nu este eficient, deoarece provoacă neuropatie 6. Prin urmare, există o mare nevoie pentru dezvoltarea unor strategii care pot crește pH-ul sanguin la pacienții care suferă de acidoză 6,7,8,9 .
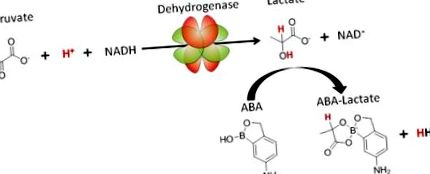
În acest raport prezentăm o nouă strategie pentru tratarea acidozei pe baza compusului ABA, care leagă lactatul și normalizează pH-ul sângelui prin creșterea consumului de protoni pe calea LDH. Mecanismul prin care ABA tratează acidozele este prezentat în Figura 1. ABA formează un complex bivalent cu lactat și, prin urmare, scade concentrația intracelulară de lactat, deplasând echilibrul către producția de mai mult lactat, rezultând consumul de protoni prin hidrogenarea piruvatului. Important, ABA este specific pentru lactat în comparație cu alți metaboliți, cum ar fi glucoza, datorită orto-hidroxilului său, care îl împiedică să se lege de cis-dioli 10. În plus, ABA crește și raportul NAD +/NADH, care are și numeroase efecte terapeutice, precum protecția împotriva apoptozei și suprimarea inflamației.
Acidul 5-amino-2-hidroximetilfenil boronic (ABA) proiectează metabolic calea lactatului dehidrogenază și este o terapie pentru acidoză lactică.
ABA leagă lactatul și normalizează pH-ul sângelui prin deplasarea echilibrului căii LDH către consumul de protoni (prezentat în roșu), piruvat și generarea de NAD + .
Rezultate
ABA a fost identificat ca fiind terapeutic pentru acidoză datorită capacității sale potențiale de a lega lactatul. Prin urmare, am efectuat experimente pentru a determina dacă ABA formează un complex stabil cu lactatul. Complexul ABA-lactat a fost format prin amestecarea a 100 μmoli de ABA și lactat în 1 ml de metanol timp de 10 minute. Complexul ABA-lactat a fost apoi izolat folosind TLC preparativă, în acetat de etil și spectrometria de masă ESI a fost efectuată pe complexul izolat ABA-lactat. S-a obținut o greutate moleculară experimentală de 220,0786, care s-a corelat cu m/z prevăzută de 220,0786 și, prin urmare, sugerează că ABA formează un complex stabil cu lactatul.
De asemenea, am investigat dacă ABA ar putea lega lactatul în prezența altor metaboliți prezenți în ser, utilizând rezonanța magnetică nucleară cu bor (RMN). ABA și L-lactat de sodiu au fost adăugate la 500 μL de ser bovin fetal 10% în mediul modificat Eagle (DMEM) al Dulbecco și analizate prin RMN de bor. Figura 2B demonstrează că ABA leagă lactatul în prezența metaboliților prezenți în serul bovin fetal și DMEM. De exemplu, borul aromatic al ABA din ser are un vârf RMN la δ = 29 și acesta se deplasează la δ = 9 în prezența lactatului și a serului, demonstrând o complexare specifică cu lactatul. Schimbările de vârf obținute în urma acestor experimente s-au corelat cu schimbările de vârf obținute din RMN de bor a unui standard sintetic ABA-lactat (izolat prin TLC preparativă). Aceste date demonstrează că ABA complexează în mod specific lactatul și nu leagă niciunul dintre metaboliții prezenți în mod normal în ser și DMEM 10 .
ABA leagă lactatul, crește raportul NAD +/NADH și consumul de piruvat.
(A) RMN de bor al complexului izolat ABA-lactat. ABA liber are un vârf de bor la δ = 29 (vârf albastru), care se deplasează la δ = 9 pentru complexul ABA-lactat (vârf roșu). (B) ABA leagă lactatul de sodiu în prezență de 10% ser determinat de RMN de bor. ABA liber în ser are un vârf de bor la δ = 29 (vârf albastru), care se deplasează la δ = 9 în prezența lactatului echimolar (vârf roșu). (C) ABA crește raportul NAD +/NADH de două ori în celulele RAW 264,7. Celulele au fost incubate cu 0,1 M PBS sau 5 mM ABA timp de 5 min, lizatele celulare au fost recoltate și s-a măsurat raportul NAD +/NADH în lizatele celulare. (D) ABA scade nivelurile de piruvat de două ori în celulele RAW 264,7. Celulele au fost incubate cu 0,1 M PBS sau 5 mM ABA timp de 5 min, lizatele celulare au fost recoltate și nivelurile de piruvat din lizatele celulare au fost măsurate.
Pentru ca ABA să proiecteze în mod eficient calea LDH, trebuie să intre în celule. Prin urmare, am măsurat Logul D al ABA utilizând măsurători de absorbanță la 330 nm într-un test de partiție octanol/apă. ABA are un jurnal D de 0,80 ± 0,03, ceea ce sugerează că ABA ar trebui să fie permeabilă la membrana celulară. Capacitatea ABA de a spori piruvatul și consumul de NADH a fost investigată în celulele RAW 264.7. 10 6 celule RAW 264,7 au fost incubate cu 5 mM ABA, timp de 5 min și celulele au fost lizate, omogenizate și separate de proteine pentru a analiza conținutul de piruvat, NAD + și NADH. Figura 2C demonstrează că ABA crește raportul NAD +/NADH de două ori și figura 2D demonstrează că nivelurile de piruvat sunt scăzute de 2 ori, sugerând astfel că ABA poate cataliza detoxifierea protonilor.
ABA este conceput pentru a epuiza nivelurile de lactat în timpul acidozei prin legarea lactatului și prin aceasta direcționând calea metabolică LDH către consumul de protoni în exces. Prin urmare, am investigat dacă ABA poate lega lactatul in vivo și îi poate reduce concentrația de sânge. 11 µmoli de ABA în 100 µL de soluție salină au fost injectați la șoareci prin vena cozii și după 10 minute sângele lor a fost analizat pentru lactat și comparat cu martorii. Figura 3A demonstrează că ABA poate reduce nivelurile de lactat din sânge, de exemplu, nivelurile de lactat din sânge la șoarecii sănătoși au fost de 2 ± 0,5 mM, cu toate acestea, șoarecii tratați cu ABA au avut o reducere de 3 ori a nivelurilor de lactat din sânge și au fost reduse la 500 ± 200 μM . ABA poate reduce nivelul de lactat extracelular de trei ori în decurs de 10 minute, acest efect rapid este esențial pentru tratarea acidozei datorită intervalului de timp rapid în care nivelurile crescute de protoni din sânge cauzează moartea. Important, la această doză ABA nu a cauzat pierderea în greutate la șoareci pe o perioadă de trei zile și nu am observat modificări ale nivelului de lactat/piruvat al creierului, de nivelurile NAD +/NADH sau ale pH-ului din sânge (figurile 3B, 4C).
ABA scade nivelurile de lactat in vivo și are o toxicitate minimă.
(A) ABA scade nivelul lactatului din sânge la șoarecii sănătoși. 11 μmoli de ABA în PBS sau PBS au fost injectați intravenos la șoareci și după 10 minute plasma a fost izolată și s-au determinat nivelurile de lactat. (B) ABA are o toxicitate minimă pentru șoareci. Șoarecii au fost injectați cu 100 mg/kg de ABA în 100 μL PBS sau 100 μL PBS, prin vena cozii și pierderea în greutate a fost studiată pe parcursul a trei zile. Abaterea standard este prezentată ca medie ± s.d. n = 3. n.s. = nu semnificativ.
ABA salvează șoarecii din acidoză indusă de metformină.
Discuţie
Tratamentul acidozei lactice este o provocare centrală în medicină, iar povara medicală cauzată de acidoză lactică este comparabilă cu cancerul și HIV, dar în prezent nu există medicamente disponibile pentru tratarea acidozei. Abordările farmaceutice tradiționale pentru tratarea acidozei s-au concentrat pe inhibarea ratei producției de lactat, prin inhibarea ciclului Krebs și au avut probleme cu toxicitatea datorită rolului central al ciclului Krebs în metabolism. În plus, tamponarea pH-ului din sânge prin introducerea bicarbonatelor nu a reușit din cauza efectelor secundare toxice. Prin urmare, este foarte necesară dezvoltarea unor strategii farmaceutice care pot crește pH-ul sanguin la pacienții care suferă de acidoză.
În acest raport demonstrăm că acidoză lactică poate fi tratată prin ingineria fluxurilor metabolice ale protonilor și piruvatului, prin complexarea lactatului cu derivatul acidului fenil boronic ABA. ABA injectat intravenos a fost capabil să salveze șoarecii de acidoză indusă de metformină prin creșterea nivelurilor de pH și a raportului NAD +/NADH din sânge. Prin urmare, ABA poate oferi un tratament potențial pentru acidoză lactică, datorită capacității sale unice de a lega lactatul și de a restabili pH-ul sângelui. ABA este prima clasă de molecule care poate proiecta metabolic calea LDH și are potențialul de a avea un impact semnificativ asupra medicamentului, având în vedere numărul mare de pacienți care suferă de acidoză.
Metode
ABA leagă lactatul cu specificitate
Capacitatea ABA de a lega lactatul și de a face un complex stabil a fost determinată prin RMN de bor și spectrometrie de masă. 100 μmoli de ABA și L-lactat de sodiu au fost amestecați în 1 ml de metanol și TLC preparativă a fost efectuată în acetat de etil. Banda de silice care conține complexul ABA-lactat (Rf = 0,1) a fost îndepărtată și complexul a fost extras în apă și concentrat folosind un evaporator rotativ. Ionizarea cu electrospray într-un mod cu ioni negativi a fost efectuată pe complexul izolat, pentru a obține masa acestuia (QB3/Chemistry Mass Spectrometry Facility de la Universitatea din California, Berkeley). De asemenea, am efectuat RMN de bor pe complexul izolat ABA-lactat, pentru a genera spectre RMN de bor de referință (figura 2A). Complexul preparativ TLC izolat ABA-lactat a fost resuspendat în 500 μL de apă. Această soluție a fost apoi adăugată într-un tub RMN de cuarț (Fisher Scientific) și RMN de bor a fost efectuată utilizând un RMN Bruker de 400 MHz (n = 8 scanări).
Capacitatea ABA de a lega lactatul în prezența altor metaboliți a fost determinată de RMN de bor. 11 μmoli de ABA și 11 μmoles de L-lactat de sodiu au fost dizolvați în 500 μL de ser bovin fetal 10% în mediul Eagle modificat (DMEM) al Dulbecco. Această soluție a fost apoi adăugată într-un tub de cuarț RMN (Fisher Scientific) și RMN de bor a fost efectuată utilizând un RMN Bruker de 400 MHz (n = 8 scanări). Ca un control, 11 μmoli de ABA au fost dizolvați în 500 μL de ser bovin fetal 10% în mediul Eagle modificat (DMEM) al Dulbecco, iar RMN de bor a fost efectuată pe un RMN Bruker de 400 MHz (n = 8 scanări).
ABA este o membrană celulară permeabilă
Jurnalul D al ABA a fost măsurat folosind un test de partiționare a octanolului/apei. 500 μL de ABA în PBS 0,1 M la o concentrație de 1 mg/ml au fost adăugate la 500 μL de octanol (Sigma Aldrich) într-un tub eppendorf și sonicate într-o baie de sonicare timp de 1 oră. Tubul a fost apoi centrifugat timp de 5 minute la 1000xGs și incubat timp de 16 ore la temperatura camerei. 100 μL de PBS și octanol au fost pipetate în godeuri separate ale unei plăci cu 96 de godeuri (VWR), absorbanța a fost măsurată la 330 nm folosind un cititor de plăci Tecan i4 și s-a determinat logul D (n = 3).
Cultura celulară generală
Celulele RAW 264,7 au fost cultivate în baloane T-25 în medii de cultură celulară constând din DMEM și 10% ser fetal bovin. Celulele au fost trecute la fiecare a treia zi prin resuspendarea celulelor folosind un răzuitor de celule (Fisher Scientific) și centrifugarea celulelor la 300XGs timp de 5 minute. Supernatantul a fost îndepărtat și celulele au fost apoi resuspendate în mediul de cultură celulară. Celulele au fost numărate folosind un hemocitometru (Fisher Scientific) și utilizate pentru alte experimente descrise mai jos.
ABA consumă piruvat și crește raportul NAD +/NADH
Capacitatea ABA de a consuma piruvat și de a crește raportul NAD +/NADH a fost determinată prin incubarea ABA cu celule RAW 264,7. 5 mM de ABA în 200 μL de mediu de cultură celulară s-au adăugat la 106 celule RAW 264,7 și s-au incubat timp de 5 min. Celulele au fost apoi centrifugate la 300XGs timp de 5 min și supernatantul a fost aruncat. Celulele au fost lizate folosind 500 μL de tampon de liză celulară furnizat cu trusa de cuantificare NAD +/NADH (Sigma Aldrich). Celulele au fost apoi filtrate printr-un filtru de centrifugă de 10 KDa (Millipore) prin centrifugare la 10.000 XGs timp de 5 min. Piruvatul din filtrat a fost cuantificat utilizând un kit de cuantificare piruvat (Abcam Inc.), iar raportul NAD +/NADH a fost cuantificat utilizând un kit de cuantificare NAD +/NADH urmând protocolul producătorului. Un cititor de plăci Tecan i4 a fost utilizat pentru a măsura citirile absorbantei și fluorescenței.
ABA scade nivelurile de lactat in vivo
Șoareci C57BL6/j femele în vârstă de 6-8 săptămâni au fost utilizate pentru toate studiile în conformitate cu protocolul animal R348 aprobat de Universitatea din California. 100 μL de PBS conținând 11 μmoles de ABA au fost injectate în șoareci prin vena cozii. După 10 min puncție cardiacă a fost efectuată la șoareci și sângele lor a fost extras și centrifugat la 10.000 XGs timp de 10 min pentru a izola plasma. Un kit de testare a lactatului (Abcam Inc.) a fost utilizat pentru a măsura concentrația de lactat în plasmă.
ABA reduce nivelurile de lactat din sânge în acidoză lactică indusă de metformină
Analize statistice
Analizele statistice au fost efectuate folosind un test t student și valorile p pentru fiecare experiment au fost determinate folosind pachetul software Excel (Microsoft Office 2010). Date semnificative statistic (pag
Referințe
Hochachka, P. W. și Mommsen, T. P. Protoni și anaerobioză. Science 219, 1391–1397 (1983).
Kozeny, G. A. și colab. Efectele in vivo ale modificărilor acute ale osmolalității și ale concentrației de sodiu asupra contractilității miocardice. Am Heart J. 109, 290–296 (1985).
Cooper, D. J., Walley, K. R., Wiggs, B. R. & Russell, J. A. Bicarbonatul nu îmbunătățește hemodinamica la pacienții cu boli critice care au acidoză lactică. Un studiu clinic prospectiv, controlat. Ann Intern Med. 112, 492–498 (1990).
Grundler, W., Weil, M. H. și Rackow, E. C. Gradiente de dioxid de carbon arteriovenos și pH în timpul stopului cardiac. Tiraj 74, 1071–1074 (1986).
Kette, F., Weil, M. H., von Planta, M., Gazmuri, R. J. & Rackow, E. C. Agenții tampon nu inversează acidoza intramio-cardică în timpul resuscitării cardiace. Tiraj 81, 1660–1666 (1990).
Kaufmann, P. și colab. Dicloracetatul provoacă neuropatie toxică în MELAS: un studiu clinic randomizat, controlat. Neurologie 66, 324-330 (2006).
Fall, P. J. & Szerlip, H. M. Acidoza lactică: de la laptele acru la șocul septic. J Terapie Intensivă Med. 20, 255-271 (2005).
Luft, D., Deichsel, G., Schmulling, R. M., Stein, W. & Eggstein, M. Definiția acidozei lactice relevante clinic la pacienții cu boli interne. Sunt J Clin Pathol. 80, 484–489 (1983).
Renda, F. și colab. Acidoza lactică asociată metforminei care necesită spitalizare. Un sondaj național de 10 ani și o revizuire sistematică a literaturii. Eur Rev Med Pharmacol Sci., 45–49 (2013).
Sartain, F. K., Yang, X. & Lowe, C. R. Complexarea L-lactatului cu acizi boronici: o soluție și o analiză holografică. Chimie 14, 4060–4067 (2008).
Peters, N. și colab. Acidoza lactică asociată metforminei într-o unitate de terapie intensivă. Crit Care 12, R149 (2008).
Misbin, R. I. și colab. Acidoza lactică la pacienții cu diabet tratați cu metformină. N Engl J Med. 338, 265–266 (1998).
Snell, A. M. și Roth, G. M. Acidul lactic al sângelui în boala hepatică. J Clin Invest. 11, 957–971 (1932).
Fendt, S. M. și colab. Metformina scade oxidarea glucozei și crește dependența celulelor canceroase de prostată de metabolismul reductiv al glutaminei. Cancer Res. 73, 4429–4438 (2013).
Mulțumiri
Această lucrare a fost susținută de următoarele subvenții acordate NM de la NIH, 1R01HL096796-02, U01 268201000043C-0-0-1, 1R01HL090601-02, 1R21AI098799-01, R01 AI088023-03.
Informatia autorului
Afilieri
306 Stanley Hall, Departamentul de Bioinginerie, Universitatea din California, 306 Stanley Hall, Berkeley, California, 94720
Abhinav P. Acharya, Mohammad Rafi, Elliot C. Woods, Austin B. Gardner și Niren Murthy
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Contribuții
A.P.A. au efectuat studii de legare, experimente in vitro, experimente in vivo și pregătirea manuscriselor. DOMNUL. efectuate experimente in vivo. A.B.G. și E.C.W. efectuat studii de legare. N.M. a dirijat cercetarea și a contribuit la pregătirea manuscriselor. Toți autorii au discutat rezultatele și au comentat manuscrisul.
Declarații de etică
Interese concurente
Autorii declară că nu există interese financiare concurente.
- L - carnitina previne steatohepatita metabolică la KK diabetic obez - Șoareci Ay - Kon - 2017 -
- Indicele de masă corporală scăzut în endometrioză este promovat de disregularea genei metabolice hepatice la șoareci
- Aici; s Cum uleiul de pește face ca șoarecii să piardă în greutate
- Hill s® Prescription Diet® Metabol Feline - conservat
- Hill's Prescription Diet Metabolism Weight Management with Ocean Fish Dry Cat Food - Comentarii clienți