ANXA1 ar putea acționa ca un supresor tumoral în stadiile incipiente ale cancerului, datorită posibilității că pierderea ANXA1 ar putea face o celulă normală instabilă genetic, crescând șansa de a obține avantajul insidios al capacității proliferative nelimitate [32].
Termeni asociați:
- Leucemie cu celule păroase
- Neoplasm
- Serozita
- Peptidă
- Proteină
- Mutaţie
- Anexină
- Neutrofil
Descărcați în format PDF
Despre această pagină
Anexa A1
Abstract
Anexina A1 este o proteină monomerică de 37 kDa cu distribuție tisulară largă, dar selectivă. Este abundent în unele tipuri de celule cheie ale sistemului imunitar înnăscut și adaptativ și al sistemului neuroendocrin. Semnificația acestei proteine pentru răspunsul la stres este că sinteza și eliberarea acesteia sunt reglementate de glucocorticoizi (GC). Odată eliberată din celulele țintă, proteina extracelulară poate acționa într-un mod autocrin sau paracrin utilizând receptori de suprafață celulară din familia formilpeptidelor pentru a produce acțiunile sale biologice. Multe dintre efectele acute ale GC în sistemul imunitar și neuroendocrin pot fi explicate prin funcționarea acestei căi.
Progres în terapii pentru artrita reumatoidă
Flavio A. Amaral,. Mauro M. Teixeira, în Reechilibrarea imună, 2016
2.5.2 Anexa A1
Anexina A1, o proteină indusă de glucocorticoizi de 37 KDa și peptida activă derivată Ac2-26 au același receptor al LXA4, FPR2/ALX. 62 Activarea acestui receptor declanșează o serie de acțiuni proresolutive, inclusiv scăderea interacțiunii leucocitelor cu celulele endoteliale, 63 creșterea apoptozei neutrofilelor, 64 și îmbunătățirea eferocitozei. 65.66 În plus, folosind un model umanizat de artrită, supraexprimarea anexinei A1 în linia celulară monocitară U937 și-a redus capacitatea de a migra către țesutul sinovial RA implantat la șoareci imunodeficienți combinați severi. 40 Astfel, anexina A1 este o moleculă care influențează activ biologia leucocitelor și ar putea fi o țintă pentru controlul inflamației în condiții clinice.
Prezența anticorpului anti-anexină A1 a fost raportată în serul pacienților cu RA tratați cu hidrocortizon. 67 De asemenea, sinoviocitele asemănătoare fibroblastelor RA aveau site-uri de legare reduse pentru anexaină A1. Aceste studii ar putea oferi o explicație pentru anumite cazuri de rezistență la glucocorticoizi la pacienții cu RA. Mai multe studii preclinice au sugerat că anexina A1 are un rol foarte important în controlul inflamației în contextul artritei experimentale. La șobolani, administrarea anticorpului anti-anexină A1 a inversat efectele benefice ale dexametazonei asupra artritei induse de antigen, inclusiv o creștere a producției de TNF și PGE2 în țesutul sinovial. 69 Aceste date au fost coroborate folosind șoareci cu deficiență de anexină A1 (AnxA1 -/-). Deși nu a existat nicio diferență în intensitatea artritei între șoarecii AnxA1 -/- și șoareci de tip sălbatic, tratamentul cu dexametazonă a fost afectat la șoarecii AnxA1 -/-. 70 Prin urmare, așa cum se vede pentru LXA4 și anexaină A1, utilizarea agoniștilor pentru FPR2/ALX ar putea fi o terapie alternativă pentru RA și alte boli inflamatorii cronice.
Anexina-A1 peptida Ac2–26
Receptoare pentru Anx-A1 și N-acetil 2-26
Native Anx-A1 și peptidele sale N-terminale bioactive exercită acțiuni extracelulare asupra celulelor pentru a imita unele dintre efectele glucocorticoizilor atât in vivo, cât și in vitro. Prin urmare, a fost o presupunere rezonabilă că există un receptor de suprafață celulară pentru proteine.
Primele dovezi experimentale pentru un astfel de receptor au apărut din observația faptului că existau site-uri de legare discrete, saturabile pentru Anx-A1 recombinant uman pe suprafața monocitelor și neutrofilelor din sângele periferic uman, 10 care au dispărut în timpul răspunsului inflamator și care au coprecipitat cu Anx- A1 din extracte de membrană. Proteinele asemănătoare receptorilor au fost descrise ulterior în celulele hipofizare endocrine. 5
Un articol cheie din Walther și colab. 33 a condus câmpul într-o altă direcție prin implicarea receptorului peptidic formilat (f-Met-Leu-Phe; FMLP) (FPR) în transducția semnalului Anx-A1 în leucocite. FPR este un membru al unei familii de receptori cuplați cu proteina G, exprimați în celulele migratoare și în multe alte țesuturi. La om, există trei specii cunoscute: FPR în sine (acum cunoscut sub numele de FPR1), FPRL-1 (FPR-like-1, numit și FPR2 sau ALXR) și FPRL-2 (acum cunoscut sub numele de FPR3). Deși FPR1 mediază probabil efectele proinflamatorii ale tri-peptidei bacteriene FMLP, FPR2/ALX este legarea mai promiscuă a lipoxinei A4, un mediator antiinflamator generat din acid arahidonic, precum și amiloid seric A, o proteină de fază acută derivată din ficat . 4
Anx-A1 și peptida Acetil 2-26 induc tranzitorii de calciu în neutrofilele umane, sugerând că efectele lor sunt mediate prin FPR1 însuși. 33 Cu toate acestea, spre deosebire de FMLP, peptidele legate de Anx-A1 nu stimulează generarea de superoxizi la concentrații care provoacă fluxuri de calciu și eliminarea L-selectinei, iar FMLP nu concurează cu legarea Anx-A1 în celulele transfectate cu FPR1 uman.
Antagoniștii „Boc” (Boc-Met-Leu-Phe și Boc-Phe-D-Leu-Phe-D-Leu-Phe) din familia de receptori FPR inhibă fluxurile de calciu induse de Anx-A1 și eliminarea L-selectinei de către PMN și, de asemenea, previn inhibarea indusă de acetil 2-26 a aderenței și emigrației leucocitelor la modelele inflamatorii murine și în alte părți. 17 Cu toate acestea, acestor antagoniști le lipsește specificitatea între membrii familiei FPR, ceea ce face dificilă determinarea subtipului utilizat. Acetilul 2-26 păstrează, de asemenea, activitatea antiinflamatorie la șoarecii nul FPR1 14, sugerând că, deși familia FPR mediază unele efecte Anx-A1, este puțin probabil ca receptorul responsabil să fie FPR1 însuși.
Dintre cele trei produse ale grupului de gene FPR la om, doar FPR2/ALXR leagă lipoxina antiinflamatoare A4. Această legare poate fi deplasată de SAA și concentrații mari de FMLP sau peptida sintetică MMK1. 4 Atât Anx-A1, cât și Acetil 2-26 se leagă, de asemenea, de FPR2/ALX în PMN uman și concurează în mod specific cu lipoxina A4. Co-imunoprecipitat endogen Anx-A1 și FPR2 din PMN uman și murin. 25 La fel ca lipoxina A4, Acetil 2-26 păstrează capacitatea de a promova detașarea leucocitelor aderente la șoarecii nul FPR1, sugerând din nou că receptorul pentru Anx-A1 nu este FPR1, ci un alt subtip. 14
La șoarece, grupul de gene fpr a suferit expansiune diferențială și au fost identificate șase gene. 11 Două nu sunt exprimate, iar altul se găsește numai în mușchiul scheletic. Celelalte trei gene (denumite acum Fpr1, Fpr2 și Fpr3) sunt exprimate în leucocite, splină și plămâni și sunt, prin urmare, potențiali receptori murini candidați pentru Anx-A1. Cu toate acestea, la mouse, funcțiile FPR2/ALX umane par a fi împărțite între Fpr2 și Fpr3. Este probabil ca ARNm pentru Fpr2 și Fpr3 să fie format prin transcriere diferențială a aceleiași gene.
Dufton și colab. 11 a generat o tulpină nulă de șoarece de Fpr2/3 și a folosit acest lucru pentru a evalua rolul acestor receptori în acțiunea Anx-A1 și a acetilului 2-26. Acești șoareci transgenici nu reușesc să răspundă peptidei N-terminale Acetil 2-26 și altor agoniști de la acești receptori și prezintă un răspuns inflamator îmbunătățit în comparație cu cel de la animalele de control WT. Aceste rezultate amintesc de comportamentul șoarecelui nul Anx-A1 și au luat, împreună cu alte rezultate, 2 indică existența unei bucle antiinflamatorii centrate pe acest receptor.
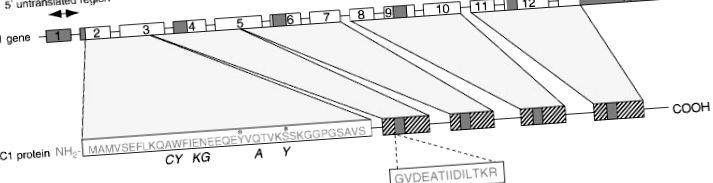
Anexină *
Structura lipocortinei 1
Figura 1. Diagrama schematică a structurii lipocortinei umane 1 și a genei sale de codificare. *, potențiale situri de fosforilare; ▨, unități repetate cu 25-35% omologie de secvență; ▪, secvență consens în unitate repetată. Cursivele reprezintă secvența corespunzătoare la șobolan.
Neutrofile
Alte molecule care rezolvă inflamația
După activarea neutrofilelor, anexina A1 (lipocortina) este eliberată ca răspuns la chimiotratanți, reglând în jos transmigrarea și promovând apoptoza și clearance-ul neutrofilelor. 82 Activități similare au fost atribuite peptidelor derivate din chemerină. 83 Neutrofilele activate produc, de asemenea, antagonist al receptorilor IL-1 (IL-1ra). 84 Eficacitatea terapiei recombinante cu IL-1ra (anakinra) în bolile autoinflamatorii subliniază importanța sa clinică în suprimarea inflamației. De asemenea, a fost identificat un mecanism de rezoluție inflamatorie mediat de MMP. MMP derivate din macrofage, cum ar fi MMP-1, MMP-3 și MMP-12, scindează chemokinele CXC, provoacă pierderea activității lor de recrutare a neutrofilelor și diminuează afluxul de celule. 85
Limfom din zona marginală splenică
| Anexina-A1 | Negativ | Dacă este pozitiv, luați în considerare HCL |
| Bcl-2 | Pozitiv | Negativ în celulele GC reziduale |
| Bcl-6 | Negativ | Pozitiv în celulele GC reziduale; poate fi pozitiv în SMZL transformat |
| CD5 | Negativ | De obicei negativ; diminuează pozitivitatea în subsetul mic |
| CD20 | Pozitiv | Expresie strălucitoare |
| CD21 | Negativ | Repere celulele FDC în centrele nodulilor albi ai pulpei |
| CD23 | Negativ | Pozitiv în rețelele FDC; dacă celulele limfomului sunt pozitive, luați în considerare CLL |
| CD43 | Negativ | Dacă este pozitiv, luați în considerare CLL sau MCL |
| Ciclina-D1 | Negativ | Dacă este pozitiv, luați în considerare MCL |
| Ciclina-D3 | Negativ | Dacă este pozitiv, luați în considerare SDRPSBCL |
| DBA44 | Pozitiv | Pozitiv în aproximativ 20% din cazuri |
| Ki-67 | Nu se aplică | Limfomul are de obicei o rată mică de proliferare; GC rezidual ridicat Ki-67 |
| pax-5 | Pozitiv |
HCL = leucemie cu celule păroase; GC = centru germinal; SMZL = limfom din zona marginală splenică; FDC = celule dendritice foliculare; CLL = leucemie limfocitară cronică; MCL = limfom cu celule de manta; SDRPSBCL = pulp roșu splenic difuz limfom cu celule B mici.
| CD3 | Negativ | |
| CD5 | De obicei negativ | Pozitivitate slabă în ± 20% din cazuri |
| CD10 | Negativ | Dacă este pozitiv, luați în considerare limfomul folicular |
| CD11c | Pozitiv în ∼ 50% | |
| CD20 | Pozitiv | Luminos |
| CD22 | Pozitiv | Luminos |
| CD23 | De obicei negativ | Pozitiv în aproximativ 30% din cazuri |
| CD25 | De obicei negativ | Pozitiv în ∼ 25% din cazuri |
| CD79b | De obicei pozitiv | |
| CD103 | Negativ | Pozitiv în aproximativ 10% din cazuri |
| CD123 | Negativ | |
| FMC7 | Pozitiv | Pozitiv în majoritatea cazurilor |
| IgM | Pozitiv | Cele mai multe cazuri |
| IgD | Pozitiv | ∼ 60% din cazuri |
Anexine (lipocortine)
Diversitate în familia anexinei
Tabelul 1. Familia anexină (lipocortină)
| Anexa I. | Calpactin II, Chromobindin 9, GIF, p35 | Substraturi ale kinazei receptorului EGF |
| Anexa II | Calpactin I, Chromobindin 8, p36, PAP-IV, Protein I | Substraturi Src-kinază |
| Anexa III | Calcimedin 35-a, Calfobindin III, PAP-III | |
| Anexa IV | Calcimedin 35-β, Calelectrin 32,5K, Chromobindin 4, Endonexină I, PAP-II, PP4-X, Proteină II | Proteina care leagă F-actina |
| Anexina V | Anchorin CII, Calelectrin 35K, Calphobindin I, Calcimedin 35-γ, Endonexin II, IBC, VAC-α, PAP-I, PP4 | Proteina anticoagulantă |
| Anexa VI | Calcimedin 67K, Calelectrin 67K, Calphobindin II, Chromobindin 20, p68, p70, 73K, Protein III, Synhibin | |
| Anexa VII | Synexin | |
| Anexa VIII | Anticoagulant vascular (VAC-β) | |
| Anexa IX | Drosophila melanogaster annexin | |
| Anexina X | Drosophila melanogaster annexin | |
| Anexa XI | Anexină asociată cu calciclină (CAP) -50 | |
| Anexa XII | Hydra vulgaris annexin | |
| Anexa XIII | Anexină specifică intestinului (ISA) |
Rezultatele analizei genomice sugerează că genele anexinei pot fi derivate dintr-o genă strămoșe comună și că evoluția și diversificarea familiei au apărut prin două duplicări consecutive ale unei secvențe de ADN care codifică o proteină asemănătoare unei singure repetări. Structura tuturor genelor anexinei este bine conservată. Regiunea de flanșare 5 ′ a genelor de anexină conține secvențe pentru siturile de legare a mai multor factori transcripționali, indicând reglarea transcripțională prin stimulare mitogenică, steroizi și metale, în timp ce regiunea de flanșare 5 ′ demonstrează repetări asemănătoare cu alu. Prezența siturilor potențiale de îmbinare și a structurii ADN-ului Z în regiunea nucleului C-terminal produce diferite izoforme de anexine.
Inflamație și vindecare1
Mediatori antiinflamatori
- Metabolismul uman - o prezentare generală Subiecte ScienceDirect
- Malva parviflora - o prezentare generală Subiecte ScienceDirect
- Maltitol - o prezentare generală Subiecte ScienceDirect
- Masă de in - o prezentare generală Subiecte ScienceDirect
- Naringin - o prezentare generală Subiecte ScienceDirect