Yanhong Guo
un Departament de Medicină Internă, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Wenmin Yuan
b Departamentul de Științe Farmaceutice, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Bilian Yu
un Departament de Medicină Internă, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Rui Kuai
b Departamentul de Științe Farmaceutice, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Mergând Hu
un Departament de Medicină Internă, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Emily E. Morin
b Departamentul de Științe Farmaceutice, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Minerva T. Garcia-Barrio
un Departament de Medicină Internă, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Jifeng Zhang
un Departament de Medicină Internă, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
James J. Moon
b Departamentul de Științe Farmaceutice, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
c Institutul Biointerfaces, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
d Departamentul de Inginerie Biomedică, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Anna Schwendeman
b Departamentul de Științe Farmaceutice, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
c Institutul Biointerfaces, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Y. Eugene Chen
un Departament de Medicină Internă, Universitatea din Michigan, Ann Arbor, MI 48109, Statele Unite
Date asociate
Abstract
1. Introducere
Deoarece particulele HDL servesc ca acceptori ai efluxului de colesterol celular și deoarece nucleul lor hidrofob prezintă un mediu favorabil pentru medicamentele lipofile, HDL reconstituit a fost investigat ca sistem de administrare a medicamentelor (Duivenvoorden și colab., 2014). Recent, am dezvoltat un nou sistem de eliberare a medicamentelor mediat cu nanoparticule bazat pe HDL sintetic (sHDL), compus din fosfolipide și o peptidă ApoA-I-mimetică 22-aminoacidă (22A) (Kuai și colab., 2016, Tang și colab., 2017). Această peptidă 22A, utilizată în sinteticul HDL ETC-642 (Di Bartolo și colab., 2011), a fost inițial dezvoltată ca tratament perfuzabil acut pentru a mobiliza rapid colesterolul din aterom, a reduce volumul plăcii și a reduce probabilitatea unui al doilea eveniment cardiac. . Studii recente au demonstrat că ETC-642 prezintă efect antiinflamator la modelele animale (Iwata și colab., 2011, DI Bartolo și colab., 2011).
În acest studiu, am investigat efectele nanoparticulelor sHDL (NPs) care încapsulează agonistul LXR T0901317 (T1317) asupra regresiei aterosclerozei și a metabolismului lipidelor. În acest sistem de eliberare a medicamentului mediat cu nanoparticule, sHDL în sine acționează atât ca vehicul de eliberare a medicamentului, cât și ca acceptor de colesterol, în timp ce agonistul LXR încapsulat activează transportorii ABC în macrofage, vizând astfel simultan cel puțin două componente critice în calea RCT. Mai mult, spre deosebire de compusul T1317 în sine, livrarea mediată de sHDL a T1317 nu prezintă unele efecte secundare, cum ar fi hipertrigliceridemia și acumularea de trigliceride în ficat.
2. Materiale și metode
2.1. Materiale
ApoA-I peptidele mimetice 22A cu capetele neacoperite, PVLDLFRELLNELLEALKQKLK, au fost sintetizate de Genscript Inc. (Piscataway, NJ). Puritățile peptidei au fost determinate a fi peste 95% prin HPLC în fază de rezervă. Fosfolipidele 1-palmitoil-2-oleoil-sn-glicero-3-fosfocolina (POPC) și 1,2-dimiristoil-sn-glicero-3-fosfocolina (DMPC) au fost achiziționate de la NOF America Corporation. T0901317 (T1317, PubChem CID: 447.912, puritate> 98%, achiziționat de la Cayman Chemical). T1317 a fost dizolvat în DMSO ca soluție stoc la 10 mg/ml. Pentru studii pe animale, soluția stoc T1317 a fost diluată cu PBS la o concentrație finală la 0,15 mg/ml și T1317 a fost administrat la 1,5 mg/kg prin injecție intraperitoneală (IP) imediat. Concentrația finală de DMSO în cultura celulară nu a depășit 0,1% pe tot parcursul studiului. Toate celelalte materiale au fost obținute din surse comerciale.
2.2. Prepararea nanoparticulelor sHDL
Nanoparticulele sHDL au fost preparate folosind metoda de omogenizare descrisă (Tang și colab., 2017), iar compoziția sHDL a fost peptidă 22A, combinată cu DMPC și POPC (Kuai și colab., 2016, DI Bartolo și colab., 2011). Lipidele și 22A s-au dizolvat în acid acetic și compusul T1317 s-a dizolvat în metanol, acele soluții au fost amestecate și uscate prin congelare timp de 24 de ore. Apoi pulberea liofilizată a fost hidratată cu PBS (pH 7,4) și plasată într-o baie de apă la 3 cicluri termice (50 ° C timp de 3 minute - baie de apă cu gheață timp de 3 minute) pentru a forma nanoparticule sHDL. PH-ul soluției de sHDL a fost ajustat la 7,4 cu NaOH. Peptida liberă și compusul T1317 au fost îndepărtate utilizând 5 ml 7 K MWCO (Sigma). Coloanele Zeba Spin Desalting (ThermoFisher) și soluția au fost sterile filtrate și depozitate congelate la - 20 ° C până la utilizare. Concentrațiile finale pentru 22A, DMPC, POPC și T1317 sunt 3, 3, 3 și 0,15 mg/ml. SHDL-DiD a fost preparat utilizând aceeași metodă și proba finală conținea 20 μg/ml DiD.
2.3. Analiza nanoparticulelor sHDL
Omogenitatea și puritatea nanoparticulelor sHDL și sHDL-T1317 au fost analizate prin cromatografie cu permeație pe gel (GPC) cu detectare UV la 220 nm folosind coloana Tosoh TSK gel G3000SWx 7,8 mm × 30 cm (Tosoh Bioscience, King of Prussia, PA) pe ape Sistem Breeze Dual Pump. Diametrele sHDL au fost determinate prin împrăștierea dinamică a luminii, utilizând un Zetasizer Nano ZSP (Malvern Instruments, Westborough, MA). Morfologia nanoparticulelor sHDL a fost observată prin transmisie prin microscopie electronică după diluarea corectă a probelor originale cu soluție de acetat de uranil 1% colorare negativă. Puritatea, dimensiunea și rata de eliberare a nanoparticulelor sHDL au rămas neschimbate după 3 cicluri de îngheț-dezgheț.
2.4. Analiza eliberării compuse
Nanoparticulele sHDL-T1317 au fost diluate în medii de eliberare conținând PBS (cu 0,02% (g/v) NaN3, pH 7,4), iar concentrația finală de 22A a fost de 5 mg/ml. Pentru a separa T1317 eliberat de nanoparticulele sHDL-T1317, s-au adăugat 100 mg de adsorbant Bio-Beads ™ SM-2 (Bio - Rad Laboratories) în mediu de eliberare de 400 μl pentru a genera o „stare de eliberare a chiuvetei”, în care T1317 liber a fost absorbit pe adsorbant imediat după eliberare. T1317 reținut în sHDL și peptida 22A în mediul de eliberare au fost cuantificate prin HPLC. Pentru metoda de cuantificare HPLC, o coloană C18 (Higgins PROTO 300, dimensiunea paticulei de 5 μm, 250 × 4,6 mm) și peptida T1317 și 22A au fost separate prin eluare în gradient și detectate prin absorbție UV 220 nm.
2.5. Analiza Efluxului Colesterolului Celular
Au fost efectuate studii de eflux de colesterol, așa cum s-a descris anterior (Schwendeman și colab., 2015; Guo și colab., 2015). Macrofagele murine J774.1 (ATCC, Manassas, VA) au fost însămânțate în plăci cu 48 de godeuri timp de 24 de ore. Celulele au fost marcate cu 1 μCi/ml [1,2-3 H] -colesterol (Perkin Elmer, SUA) în DMEM (Life Technology. Inc) conținând 0,5% albumină serică bovină fără acizi grași (BSA) și 5 μg/ml Inhibitor ACAT Sandoz 58-035 (Sigma) peste noapte. Apoi celulele au fost spălate de două ori cu PBS și tratate cu control, nanoparticule sHDL sau compus T1317 timp de 16 ore. După colectarea mediului, celulele au fost apoi incubate cu DMEM/0,5% BSA conținând 50 μg/ml HDL comercial sau 10 μg/ml ApoA-I ca acceptori pentru 5 H. Mediul a fost colectat și filtrat pentru a îndepărta celulele detașate și efluxul a fost cuantificat prin scintilație lichidă și exprimat ca procent din conținutul total de celule 3 H - colesterol.
2.6. PCR cantitativ în timp real
Sângele a fost colectat prin sângerări retro-orbitale cu capilare acoperite cu EDTA. Globulele roșii din sânge au fost lizate cu tampon de liză a globulelor roșii (Sigma Aldrich). ARN-ul total a fost purificat din celulele albe din sânge și din țesutul hepatic cu reactiv TRIzol (Life technologies. Corp.), urmat de transcriere inversă cu un kit SuperScript III (Invitrogen). qPCR a fost efectuat cu iQ SYBR Green Supermix (Bio-Rad). Abundența relativă de mARN a fost normalizată la media de 18sARN și Ppia, controlul menajului.
2.7. Teste biochimice de sânge
Testele LDL-colesterolului direct (LDL-c), HDL-colesterolului direct (HDL-c) și enzimatic-colorimetric utilizate pentru determinarea colesterolului total plasmatic (TC) și a trigliceridelor (TG) au fost efectuate la Laboratorul de chimie al diabetului Michigan. Centrul de Cercetare și Instruire.
2.8. Studiu de regresie a aterosclerozei
2.9. Colorare roșie uleioasă a țesutului hepatic
Ficatele șoarecilor au fost fixate cu paraformaldehidă 4%, iar secțiunile hepatice înghețate (10 μm) au fost colorate cu 5% ulei roșu O (Sigma-Aldrich) timp de 15 minute și apoi colorate cu hematoxilină. Secțiunile au fost apoi examinate la microscopie cu lumină.
2.10. Determinarea conținutului de lipide hepatice
Concentrațiile de trigliceride și colesterol ale țesutului hepatic au fost măsurate folosind seturi de cuantificare (Biovision, Mountain View, CA). Țesuturile hepatice au fost omogenizate într-un tampon 5% NP-40 pentru a extrage trigliceridele. Lipidele din țesuturile hepatice au fost extrase cu cloroform: alcool izopropilic: Nonidet P-40 (7: 11: 0,5). Probele extrase au fost analizate în conformitate cu instrucțiunile producătorului. Absorbanța a fost măsurată pe un cititor multimod GloMax-Multi Microplate.
2.11. Analize statistice
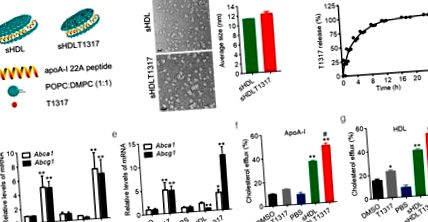
Comparații statistice și analize între două grupuri au fost efectuate de testul Student cu două cozi nepereche și între trei grupuri sau mai multe, cu analiza unică a varianței urmată de un test Newman-Keuls. O valoare p Fig. 1 a). Diametrul nanoparticulelor sHDL în formă de discoidă a fost de aproximativ 11,8 ± 0,3 nm, așa cum a fost determinat prin difuzie dinamică a luminii și microscopie electronică de transmisie (Fig. 1 b, Fig. S1a, b). Nanoparticulele sHDLT1317 au prezentat formă și dimensiuni similare (12,1 ± 0,8 nm) comparate cu nanoparticulele sHDL (Fig. 1 b). T1317 este insolubil în apă (solubilitatea estimată în apă la pH 7,4 este 9,4E-05 mg/ml) și nu a fost găsit niciun precipitat solid în soluția de nanoparticule sHDL. Eficiența medie a încapsulării T1317 a fost de 84 ± 2% în trei loturi de preparare. Eliberarea in vitro T1317 din sHDL NPs a fost investigată în condiții fiziologice (PBS, pH 7,4, 37 ° C) și a atins eliberarea de 50% și 80% la 2,4 și respectiv 8 ore de incubație (Fig. 1 c).
Reprezentarea schematică a formulărilor de nanoparticule sHDL și a testelor de eficacitate. Structura schematică a NP-urilor sHDL încapsulate T1317 (a). Imagini reprezentative TEM ale sHDL și dimensiunea medie a sHDL și sHDLT1317 (b). Bara de dimensiuni corespunde la 20 μm. (c) Profilul de eliberare in vitro al T1317 din sHDL NPs. Cuantificarea nivelurilor de Abca1 și Abcg1 în celulele normale J774A.1 (d) și celulele cu spumă J774A.1 încărcate cu colesterol (e). sHDL la 50 μg/ml și T1317 la 0,1 μM. Efluxul de colesterol a fost măsurat ca procentul de [3H] -colesterol în mediu după 6 ore de incubație cu APOA-I la 10 μg/ml (f) sau HDL comercial la 50 μg/ml (g). Datele sunt medii ± S.E.M.; n = 3-5 pentru fiecare grup; * P Fig. 1 d, e, FIG. S2c). Așa cum era de așteptat, tratamentul cu T1317 și sHDLT1317 a reglat semnificativ expresia Abca1 și Abcg1 atât în macrofage, cât și în celule de spumă încărcate cu colesterol (Fig. 1 d, e). Deși T1317 și sHDL au indus un eflux crescut de colesterol comparativ cu controalele, tratamentul sHDLT1317 a îmbunătățit semnificativ efluxul total de colesterol fie la HDL, fie la acceptorii ApoA-I (fig. 1 f, g) în macrofage, comparativ cu tratamentul T1317 sau sHDL, deoarece sHDL în sine acționează ca colesterol acceptor. Nivelurile de colesterol celular au fost semnificativ reduse în celulele tratate cu T1317 și sHDL și au scăzut în continuare în celulele tratate cu sHDLT1317 (Fig. S2c), chiar și după o incubare suplimentară cu acceptori HDL sau ApoA-I (Fig. S2d, e), indicând faptul că vizând atât acceptorii de colesterol, cât și transportorii ABC, rezultă un efect sinergic asupra efluxului de colesterol.
3.3. Localizarea nanoparticulelor sHDL în plăcile aterosclerotice
Pentru a evalua capacitatea sHDL de a-și livra încărcătura (vopsea fluorescentă sau compus T1317) către plăcile aterosclerotice, șoarecilor cu deficit de ApoE plasate pe o dietă bogată în colesterol ridicat în grăsimi (HFHC) li s-a injectat 1,1′-dioctadecil-3,3, 3 ', 3'-tetrametilindodicarbocianină (DiD) încărcate cu sHDL NPs (sHDL-DiD) și realizate cu ajutorul IVIS. Am confirmat acumularea de DiD fluorescent în aorta la 4 ore după injectarea intraperitoneală (IP) de sHDL-DiD (Fig. 2 a), sugerând că sHDL ar putea livra și T1317 pe placă. Apoi, am investigat dacă livrarea de agonist LXR mediată de sHDL ar putea regla expresia genei țintă LXR în plăcile aterosclerotice, iar expresia Abca1 și Abcg1 a fost determinată în aorta toracică. Ambele T1317 și sHDLT1317 au crescut semnificativ expresia Abca1 și Abcg1 în aortă (Fig. 2 b, c), indicând faptul că sHDL a livrat cu succes T1317 la aterom și a activat expresia genelor țintă LXR în plăcile aterosclerotice.
- Nanomateriale Nanoparticule Fe3O4 gratuite cu text integral pentru livrare complexă și neutron de bor
- Ficat de vițel în felii Skylark, 16 oz
- Rata în creștere a bolilor hepatice grase nealcoolice crește cazurile de carcinom hepatocelular - U
- Definiție NASH; Prevalenta; American Liver Foundation
- Factori de risc pentru NAFLD - Boală hepatică grasă nealcoolică - Bibliotecă NCBI