Hyder Said
1 Cercetare, West Los Angeles, VA Medical Center
3 Colegiul de Litere și Științe, Universitatea din California, Los Angeles, Los Angeles, CA, 90073
Izumi Kaji
1 Cercetare, West Los Angeles, VA Medical Center
4 Departamentul de Medicină, Universitatea din California, Los Angeles, Los Angeles, CA, 90073
Jonathan D. Kaunitz
1 Cercetare, West Los Angeles, VA Medical Center
2 Servicii medicale, West Los Angeles, VA Centrul Medical
4 Departamentul de Medicină, Universitatea din California, Los Angeles, Los Angeles, CA, 90073
5 Departamentul de chirurgie, Universitatea din California, Los Angeles, Los Angeles, CA, 90073
Abstract
Scopul revizuirii
Pentru a evidenția evoluțiile recente în domeniul apărării mucoasei gastroduodenale, cu accent pe interacțiunile lumen-intestin.
Descoperiri recente
A existat un interes crescând pentru funcțiile fiziologice ale chemosensorilor luminali prezenți de la limbă la colon care detectează molecule organice din conținutul luminal asociat cu ingestia de nutrienți, de obicei asociate cu celule specializate, în special celulele enteroendocrine. Acești receptori transduce eliberarea hormonilor peptidici, în special a produselor derivate din proglucagon, cum ar fi peptidele asemănătoare glucagonului (GLP), care au efecte profunde asupra funcției intestinale și asupra metabolismului. Chemosensorii luminali transduce eliberarea GLP ca răspuns la schimbările din mediul celular, ca parte a mecanismului chemosensingului nutrienților. GLP-2 are efecte trofice importante asupra mucoasei intestinale, inclusiv creșterea ratei de proliferare a celulelor stem și reducerea permeabilității transmucoase la ioni și molecule mici, pe lângă creșterea ratei de secreție de bicarbonat duodenal. GLP-1, deși este considerat în mod tradițional o incretină care îmbunătățește efectul insulinei asupra țesuturilor periferice, are și efecte trofice asupra epiteliului intestinal.
rezumat
O mai bună înțelegere a mecanismelor care mediază eliberarea GLP poate ilumina și mai mult importanța chimiosensării nutrienților ca o componentă importantă a mecanismului care mediază efectele trofice ale nutrienților luminali. GLP-1 și -2 sunt deja în uz clinic pentru tratamentul diabetului și a insuficienței intestinale. Înțelegerea îmbunătățită a controlului eliberării lor și a efectelor lor asupra organelor finale va identifica noi indicații clinice și intervenții care le sporesc eliberarea.
Introducere
Observația veche de zeci de ani că intestinele se atrofiază în timpul foametei servește ca bază pentru conceptul de „hrană trofică” în care cantități mici de nutrienți luminali previn atrofia mucoasei, chiar și atunci când starea nutrițională generală este inadecvată. Mecanismul pe care se bazează acest concept a fost atribuit de obicei componentelor dietetice, cum ar fi glutamina, care servește drept „combustibili” direcți pentru enterocite, bazată în mare parte pe studii in vitro [1]. Cu toate acestea, numeroase observații susțin un concept alternativ, în care efectele trofice ale moleculelor luminale sunt mediate în principal de mecanisme hormonale. Tema noastră generală va fi să evidențiem unele dintre publicațiile recente care susțin această ipoteză.
Odată cu clonarea și dezorfanizarea mai multor receptori cuplați cu proteine G (GPCR) activate de molecule organice care sunt fie componente ale unei mese, fie sunt generate sau secretate ca răspuns la ingestia de masă, s-a generat un interes nou în conceptul de luminal chemosensing, datorită caracterizării moleculare a senzorilor luminali implicați. Deși au existat cinci gusturi diferite asociate clasic cu cavitatea bucală, tractul gastro-intestinal exprimă în cea mai mare parte receptori gustativi dulci, amari și umami (proteici) (familii TAS1R și TAS2R), care sunt compuși din heterodimeri GPCR. Combinațiile unice ale acestor subtipuri de receptori din cadrul fiecărei familii conferă funcționalități diferite și, astfel, percepții ale gustului. Receptorii gustului dulce utilizează o combinație de TAS1R2 și TAS1R3, în timp ce receptorii umami sunt compuși din TAS1R1 și TAS1R3 [7]. Receptorii gustului amar utilizează această a doua familie de receptori gustativi, TAS2R, care au peste 25 de subtipuri cunoscute [7].
Datorită afluxului unei multitudini de compuși organici intacti și parțial digerați care însoțesc ingestia de masă, este de un interes deosebit să se studieze chemosensorii de dinainte pentru acești compuși prezenți în intestinul superior. Până în prezent, GPCR-urile activate de FA cu lanț lung (FFA1 și 4, cunoscute și sub denumirea de GPR40 și 120), SCFA (FFA3 și 2, cunoscute și ca GPR41 și 43) și acizii biliari (GPBAR, de asemenea, cunoscut sub numele de GPR131 sau TGR5) au au fost identificate în membrana luminală intestinală [8].
Activarea TASR, FFAR și GPBAR eliberează mai multe peptide bioactive, inclusiv familia GLP, care sunt generate prin activitatea prohormonei convertazei 1/3, care scindează proteolitic proglucagonul pentru a produce GLP-1 și GLP-2 în celulele L enteroendocrine [ 9 *]. GLP-1 este o incretină importantă eliberată de celulele L distribuite pe tot tractul gastro-intestinal, considerat în mod convențional că ajută la medierea controlului glicemic. GLP-2 are efecte trofice importante asupra epiteliului intestinal, incluzând modularea adâncimii cripto-villusului, rata de proliferare a celulei criptelor și lungimea și greutatea intestinală [10 *]. Mai mult, GLP-2 este exprimat în alte tipuri de celule din tractul gastro-intestinal și sistemul nervos central [11], susținând funcția sa ca intermediar important în multe căi de semnalizare celulară. GLP-urile sunt metabolizate în principal de dipeptidil peptidaza IV (DPP-IV), a cărei inhibare a fost utilizată clinic pentru a spori efectele hormonilor endogeni, în special în tratamentul diabetului [12 *].
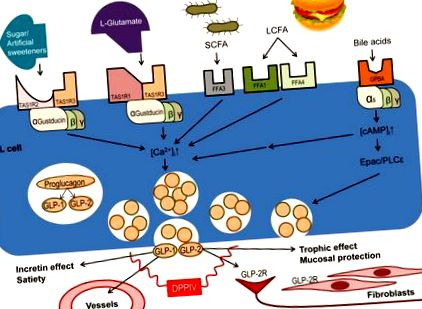
Astfel, aceste GPCR-uri, exprimate în special pe celulele L, au fost implicate în transpunerea efectelor ingestiei de masă în multe efecte metabolice postprandiale. O diagramă schematică care prezintă activarea GPCR-urilor orientate spre lumina exprimate pe celulele enteroendocrine și funcțiile fiziologice ale acestora este prezentată ca Figura 1 .
Mai multe GPCR cu sensibilitate la nutrienți sunt exprimate pe membrana apicală a celulelor L. Activarea receptorului eliberează GLP mediat de o creștere a concentrației intracelulare de calciu ([Ca 2+] i). Receptorii de gust (heterodimeri TAS1R) sunt cuplați cu α-gustducină, în timp ce receptorul acidului biliar (GPBAR) este cuplat cu Gαi, îmbunătățind semnalul mediat de TAS1R. GLP-1 și GLP-2 eliberate au multe funcții mediate prin receptori diferiți exprimați pe organe țintă, cum ar fi neuroni enterici și miofibroblaste subepiteliale.
Eliberarea GLP-urilor legate de receptor
Cei trei receptori ai gustului sunt GPCR care sunt cuplați cu proteina G specifică semnalului gustului α - subunități α-gustducin și/sau α-transducin, pentru a regla răspunsul intestinal la conținutul luminal prin mecanismul chimiosensibil al nutrienților (Fig. 1). ).
Receptorul gustului dulce (TAS1R2/TAS1R3) este un senzor major de glucoză, important pentru reglarea toleranței la glucoză și a efectelor insulinei. Gustducin, TAS1R2 și TAS1R3, toate coexprimate pe celule L producătoare de GLP-2, sunt implicate în răspunsul hormonal funcțional fiziologic la liganzii receptorului gustului dulce [13 *]. La șoareci knockout TAS1R3, Murovets și colab. [14 *] a raportat că toleranța la glucoză a fost redusă, însoțită de o rezistență crescută la insulină, indicând faptul că această componentă a receptorului dulce este implicată în căile de detectare a zahărului din intestin, implicând probabil eliberarea afectată a GLP-1. Distribuția largă a TAS1R3, cu abundență mare în special în sistemul nervos central și pancreas, susține totuși căi extraintestinale. Date noi de Shirazi-Beechey și colab. sugerează că, pe lângă faptul că sunt exprimate în celule K, TAS1R2 și TAS1R3 sunt co-localizate cu GLP-2 în celule L, susținute de o creștere raportată a eliberării GLP-1 și GLP-2 datorită activării TAS1R2 și TAS1R3 [15 ** ].
Receptorul umami (TAS1R1/TAS1R3), asociat cu α-gustducin și α-transducin, este activat de glutamatul monosodic al ligandului umami reprezentativ și îmbunătățit alosteric de inozitol monofosfat, care activează funcțiile intestinale locale. Constatări de Kendig și colab. sugerează că receptorii umami, care sunt foarte exprimați în celulele enteroendocrine colonice, în special celulele L, accelerează mișcarea peletelor colonice și reflexul peristaltic [16 *]. În foregut, perfuzia luminală a liganzilor receptorilor umami crește eliberarea de GLP-2, ceea ce crește rata de secreție de bicarbonat, un mecanism de protecție stabilit al mucoasei foregut, implicând chemosensarea nutrienților în îmbunătățirea mecanismelor de apărare a mucoasei [17]. Mai mult decât atât, secreția de bicarbonat prin activarea receptorului umami a unei căi mediate de GLP-2, care atenuează leziunile intestinale induse de AINS, după cum a raportat Inoue și colab., Este îmbunătățită prin inhibarea DPP-IV care crește concentrațiile circulante de GLP-2 prin scăderea acesteia metabolism [18].
În cele din urmă, receptorii gustului amar (TAS2R) există în peste 25 de subtipuri diferite, care sunt prezenți fie în forme monomerice, fie în forme homo-multimerice. Varietatea pe scară largă a receptorilor gustului amar este probabil legată de importanța pentru organisme de a evita toxinele, care sunt de obicei gust amar. Puterea gustului amar se corelează direct cu cât de mare este prezent un homomultimer de TAS2Rs [19 *]. Receptorii gustului amar sunt exprimați în numeroase tipuri de celule enteroendocrine - niciun studiu nu a reușit să le localizeze la un anumit tip de celulă in situ - cu o expresie extrem de ridicată în liniile celulare de cultură STC-1 și NCI-H716 pe bază de enteroendocrine, ambele co-exprimă α-gustducin și GLP-1 [20 *, 21 *]. Subunitatea α a proteinei G cuplată cu receptorii gustului amar, cum ar fi receptorii dulci și umami, este, de asemenea, α-gustducina, pe care Kim și colab. au raportat creșterea activității fosfolipazei C și scăderea nivelurilor intracelulare de AMPc, cu o creștere rezultată în aval a nivelurilor de calciu intracelular și a eliberării GLP-1 [21 *]. Acest mod de eliberare a incretinei GLP-1 oferă baza pentru noi terapii pentru diabet în care receptorul gustului amar servește ca țintă moleculară.
Receptor de acid gras (FFAR) - Eliberare mediată de GLP
În plus față de receptorii gustativi, FFA au fost implicați recent ca mediatori importanți ai eliberării GLP (Fig. 1). FFA sunt foarte exprimate pe celulele L, implicând implicarea lor în eliberarea peptidelor derivate din proglucagon. Liganzii FFA1, cum ar fi acidul oleic, activează calea proteinei kinazei activate mitogen/kinazei extracelulare cu reglare a semnalului (MAPK/ERK) pentru a păstra viabilitatea joncțiunilor strânse din epiteliul intestinal [22 *]. Miyamoto și colab. a raportat că GLP-2 afectează funcția proteinelor structurale joncționale zonula occludens (ZO) 1-3, ocludină și claudine, prin calea MAPK/ERK pentru a crește rezistența paracelulară la permeabilitatea ionilor și a moleculelor mici, crescând integritatea epitelială [ 22 *].
FFA1 și FFA4 exprimate ileal au fost implicate în medierea eliberării GLP-2 la pacienții cu boala Crohn [23 *], ceea ce este important deoarece GLP-2 are efecte antiinflamatorii asociate. Deși activarea FFAR1 a crescut eliberarea GLP-2, factorul de necroză tumorală mediator pro-inflamator (TNF) -α a activat FFA4 care a atenuat efectele antiinflamatorii benefice ale eliberării GLP-2 dependente de FFA1, indicând un mecanism de feedback pentru a inhiba GLP-2 în exces producție [23 *].
În duoden, lanțul lung FFAR FFA1 și lanțul scurt FFAR FFA3 cresc rata secreției de bicarbonat epitelial printr-un mecanism dependent de GLP-2 [24 **], implicând în continuare GLP-2 în mecanismele citoprotectoare. Tanaka și colab. au raportat că inhibarea DPP-IV combinată cu activarea FFA1 crește sinergic eliberarea insulinei dependente de glucoză și concentrația plasmatică a GLP-1 [25 *] și Akiba și colab. au raportat rezultate similare folosind un sistem de perfuzie duodenal [24 *]. Aceste rezultate indică faptul că FFA1 mediază eliberarea ambelor GLP-uri care mențin integritatea intestinului. Mai mult, Kawaguchi și colab. a raportat că exendin-4, un analog GLP-1 rezistent la DPPIV, a fost un tratament extrem de eficient pentru steatohepatită la modelele murine [26 *], care paralelizează în continuare GLP-1 și GLP-2 ca molecule importante în reglarea inflamației, în special în organele digestive. Fie că este vorba de un gust sau de un mecanism de chimiosensibilizare mediat de receptorul acidului gras, eliberarea GLP-1 și GLP-2 sunt factori importanți implicați în apărarea mucoasei și controlul glicemic.
Receptorul acidului biliar (GPBAR)
Acizii biliari sunt metaboliți endogeni ai colesterolului secretați în lumenul duodenal la concentrații mM ca răspuns la ingestia mesei. GPCR selectiv legat de membrană la acidul biliar denumit GPBAR este exprimat în celule L. Suplimentarea orală a unui agonist GPBAR sintetic a prevenit inflamația la un model de colită de șoarece prin intermediul unei căi mediate de GLP-2 [27 *]. Spre deosebire de TASR și FFA, GPBAR este cuplat cu Gαs, activând o proteină intracelulară de schimb de cAMP activată direct de calea de semnalizare cAMP (Epac) care precede eliberarea GLP [28,29 *], care poate spori eliberarea GLP evocată de glucoză sau L-glutamat [28,30], implicând GPBAR în modularea chimiosensibilizării nutrienților în celulele L (Fig. 1). Deoarece GPBAR este exprimat pe scară largă în multe alte organe, cum ar fi în vezica biliară, orientarea unui agonist GPBAR către receptorii intestinali ar fi probabil necesară pentru aplicațiile terapeutice ale noilor agoniști [31 *].
GLP în tulburările gastrointestinale comune
În timpul digestiei, eliberarea GLP-1 este asociată cu satierea [32 *], acționând în esență ca un mecanism de feedback pentru a inhiba consumul excesiv de alimente, prin activarea receptorilor de sațietate centrală prezenți, dar fără a se limita la nucleii hipotalamici paraventriculari și arcuați. Nguyen și colab. a raportat că în obezitatea morbidă, eliberarea GLP-1 ca răspuns la perfuzia intraduodenală de glucoză a fost diminuată chiar dacă insulina și eliberarea unei alte incretine, polipeptidă insulinotropă gluco-dependentă (GIP), a crescut, cu hiperinsulinemie și hiperglicemie [33 *]. Aceste rezultate sugerează că un defect primar care stă la baza obezității morbide ar putea fi lipsa de sațietate post-prandială din cauza eliberării afectate a GLP-1.
Exprimarea receptorului GLP-2 (GLP-2R) în colon și ileon este diminuată la subiecții cu boală inflamatorie intestinală (IBD) [34 *]. Deoarece GLP-2 exercită efecte antiinflamatorii și crește, de asemenea, integritatea barierei mucoasei, după cum a raportat Walker și colab. [35 *], exprimarea GLP-2R diminuată ar putea explica în parte funcția de barieră și inflamația diminuate observate în boala Crohn și colita ulcerativă [36]. Mai mult, Pedersen și colab. au raportat recent că GLP-2R nu se exprimă pe epiteliul intestinal, ci, mai degrabă, pe neuronii enterici, pe lângă miofibroblastele subepiteliale [37 *], care au fost implicate în reglarea inflamației în IBD [38 *].
Administrația Statelor Unite pentru Alimentație și Medicamente (FDA) a aprobat recent teduglutidul analogic rezistent la DPP-IV GLP-2 pentru tratamentul insuficienței intestinale. În studiile clinice, teduglutida a îmbunătățit în mod convingător absorbția lichidului intestinal și a electroliților [39,40 **]. La purceii cu insuficiență intestinală experimentală, tratamentul cu teduglutide a crescut greutatea intestinală totală pe lungime și ratele de sinteză a proteinelor intestinale, în concordanță cu funcțiile trofice ale GLP-2 [41 *], datorită eliberării factorilor de creștere, cum ar fi factorul de creștere a keratinocitelor (KGF) .și factorul de creștere asemănător insulinei (IGF) de la miofibroblaste subepiteliale intestinale care exprimă receptori GLP-2 [42]. Deși cea mai mare parte a beneficiului pentru teduglutidă a fost atribuită efectelor sale intestinotrofice, efectele sale antiinflamatorii și de întărire a barierei pot fi de un beneficiu suplimentar în terapia afecțiunilor inflamatorii cronice, menționând că teduglutida nu este aprobată de FDA pentru tratamentul afecțiunilor inflamatorii.
Îndulcitori artificiali
Administrarea analogă GLP-2 exogenă, cu beneficii dovedite în insuficiența intestinală, poate, după cum sa discutat mai sus, să aibă beneficii suplimentare în IBD, boala funcțională a intestinului (FBD) și alte boli. Terapia analogică GLP-2 exogenă este de obicei necesară pe o perioadă prelungită și poate fi destul de costisitoare. În timp ce administrarea analogă exogenă a GLP-2 a fost studiată cu atenție, creșterea eliberării endogene a GLP-2 a primit mult mai puțină atenție clinică. O metodă practică de a elibera fiziologic GLP-2 endogen este prin ingestia liganzilor pentru receptorii exprimați pe membrana apicală a celulelor L care eliberează GLP-2 atunci când este activat. În acest sens, îndulcitorii artificiali, care sunt pur și simplu liganzi cu afinitate ridicată pentru receptorul gustului dulce (TASR1R2/3), eliberează GLP-1 și GLP-2 [8,14 **], cu efecte benefice asupra controlului glicemic și asupra mucoasa intestinala. Întrucât îndulcitorii artificiali sunt în uz clinic obișnuit și sunt recunoscuți ca aditivi alimentari de către FDA, utilizarea lor non-aprobată de FDA în diabet, FBD și IBD merită studii suplimentare, deși unele studii epidemiologice sugerează că aceste substanțe pot fi ineficiente sau chiar dăunătoare [43]. ].
Rezumat și direcții viitoare
Baza mecanicistă pentru observația că SCFA și alți nutrienți și non-nutrienți din lumenul intestinal după masă sunt intestinotrofe a fost dezvăluită de studii experimentale recente în care compușii luminali activează chimioenzorii nutrienți exprimați pe celulele L. Acest tip specific de celule eliberează hormoni trofici în circulația portală și limfatice pentru a activa receptorii exprimați pe miofibroblaste epiteliale care eliberează factori de creștere și astfel activează receptorii exprimați de enterocite, crescând rata de proliferare a celulelor stem intestinale. Descoperirea multor senzori de nutrienți luminali a oferit numeroase ținte moleculare pe care se pot baza noi terapii cu risc scăzut de efecte secundare pentru insuficiență intestinală, diabet, obezitate, FBD și IBD.
Puncte cheie
Receptorii de gust (TASR) sunt exprimați pe tot tractul gastro-intestinal și mediază eliberarea GLP
Acizii grași liberi (FFA) exprimați pe celulele L modulează eliberarea GLP și acționează ca regulatori importanți ai chimiosensibilizării nutrienților
Receptorul acidului biliar membranar (GPBAR) exprimat pe celulele L modifică eliberarea GLP activată de TASR și FFA.
Peptidele de tip glucagon (GLP) sunt responsabile pentru menținerea integrității și creșterii intestinale, precum și pentru absorbția zahărului
Mulțumiri
Sprijin financiar și sponsorizare
Această lucrare a fost susținută de subvenții de cercetare din cadrul Departamentului Afacerilor Veteranilor și al Institutelor Naționale de Sănătate.
Note de subsol
Conflicte de interes
- Efectele nutriției enterale timpurii asupra motilității gastrointestinale și a barierei mucoasei intestinale
- Gale Academic OneFile - Document - Mecanismele bolii este osteoporoza, obezitatea osoasă
- Dezvoltarea mecanismelor obezității și a fiziologiei - PubMed
- Legăturile genetice dintre dietă și durata de viață au împărțit mecanismele de la drojdie la oameni Nature Reviews
- Harta și graficul produselor alimentare din cabane - Fondul de apărare juridică de la fermă la consumator