* Autorul corespunzator:
Abstract
Revizuirea oferă o perspectivă asupra proprietăților biologice inerente ale metaboliților bacterieni - acizi fenilcarboxilici cu greutate moleculară mică (PCA), inclusiv acid benzoic (BA), acid p-hidroxifenilactic (HPLA), acid fenilactic (PLA), acid p-hidroxifenilacetic ( HPAA)), acid fenilacetic (PAA) și acid fenilpropionic (PPA). S-a demonstrat că bacteriile din microflora umană - predominant anaerobe - pot metaboliza aminoacizii aromatici în PCA, iar PCA sunt capabile să suprime creșterea și propagarea altor bacterii, intrând în interacțiuni competitive în cadrul asociațiilor microbiene. Autorii sugerează că în colonul uman, unde concentrațiile de metaboliți microbieni ating nivelul biologic activ, PCA-urile pot exercita nu numai efecte locale, ci și sistemice, astfel orice abatere de la compoziția existentă a asociațiilor microbiene poate duce la defalcarea echilibrului PCA-urilor obișnuite și apariția APC cu proprietăți biologice opuse. Datele publicate disponibile, precum și rezultatele cercetărilor proprii ne-au permis să fundamentăm o abordare nouă orientată spre dezvoltarea de noi strategii terapeutice bazate pe reglarea echilibrului local și sistemic al metaboliților aromatici microbieni în corpul uman.
Cuvinte cheie
ABREVIERI
PCA - Acizi fenilcarboxilici
BA - acid benzoic
HPLA - acid p-hidroxifenilactic
PLA - Acid fenilactic
HPAA - acid p-hidroxifenilacetic
PAA - Acid fenilacetic
PPA - Acid fenilpropionic
BAA - Acid benzaminoacetic
AMM - Metaboliți microbieni aromatici
ATP - Trifosfat de adenozină
SB - Benzoat de sodiu
ROS - Specii reactive de oxigen
LPS - Lipopolizaharidă
iNOS - NO-sintază inductibilă
MCT - Transportoare monocarboxilate
MFS - Facilitator major Super Family
HA - Acid hipuric
NOAEL - Niciun nivel de efect advers observat
MIC - Concentrație minimă inhibitoare
MBC - Concentrație bactericidă minimă
MFC - Concentrație fungicidă minimă
INTRODUCERE
În procesul de evoluție s-a format o comunicație biologică bine stabilită și bine echilibrată între macro și microorganisme. Între timp, acest fenomen este greu de luat în considerare în contextul cercetării clinice, întrucât în mod tradițional atât cercetarea, cât și descrierile proceselor biochimice și de semnalizare se fac separat pentru macroorganism și locuiesc în microflora acestuia. Se datorează mai ales inertității științei medicale care continuă să reproducă percepția eronată a căilor de reglare biochimice divergente ale organismelor pro și eucariote, neglijând co-evoluția lor continuă.
Credem că progresul ulterior în știința clinică este imposibil fără a lua în considerare rolul activităților vitale ale microflorei umane, habitabilitatea și intercomunicarea cu metabolismul uman, fără a descoperi căi de semnal comune care să prevadă rolurile cheie ale metaboliților microbieni în patogeneza atât a infecțioase, cât și a celor neinfecțioase (cum ar fi boli oncologice, endocrine, psihice etc.). Microecologia clinică, un domeniu nou în știința medicală, este cel mai potrivit termen, care cuprinde toate aspectele enumerate mai sus.
Acest deficit de cunoștințe despre microecologie este cel mai dureros evident în anestezie și în medicina critică și de urgență. Sepsisul rămâne principala cauză directă de deces în unitățile de terapie intensivă, în ciuda utilizării intensive a monitorizării pe mai multe niveluri și a mai multor componente, cele mai puternice antimicrobiene și tehnologiile de înlocuire a organelor hitech [1-5]. Cercetarea activă a metaboliților microbieni aromatici și rolul lor potențial în tanatogeneză se desfășoară în Laboratorul de metabolizare umană în stări critice (MCS), Institutul de cercetări științifice Negovsky de reanimatologie generală [6].
S-a demonstrat că compușii chimici simpli acționează ca molecule de semnal și bio-regulatori în comunitatea microbiană, reprezentând cel mai arhaic mecanism de autoreglare și comunicare intercelulară, așa-numitul quorum sensing [7]. În procesul de evoluție, compușii cu greutate moleculară mică și-au asigurat rolul principal în metabolismul uman, este suficient să menționăm unii hormoni (cum ar fi catecolaminele endogene, hormoni tiroidieni), neurotransmițători (serotonină, acid γ-aminobutiric), regulatori autocrini ai metabolismului țesuturilor și mitocondriilor. (NU) etc.
Compușii chimici simpli pot juca un rol important de legătură în intercomunicarea dintre metabolismul bacterian și cel uman. De exemplu, adrenalina și alte catecolamine s-au dovedit a fi implicate în comunicarea interbacteriană, precum și în interacțiunea bacteriană cu macro-organismul [8,9]. Datele preliminare privind profilurile stabilite ale microorganismelor vii exometaboliți în serul uman sunt deja publicate [6,10,11]. Studiile cuprinzătoare ale metaboliților microbieni în lichidele și țesuturile biologice umane par a fi cea mai promițătoare abordare pentru viitoare perspective mai profunde asupra impactului potențial al tulburărilor microecologice asupra organismului uman care se manifestă instantaneu prin echilibrul exometaboliților.
ACIDI FENILCARBOXILIC RELEVANȚI CLINIC
Mai mult, am stabilit o corelație directă între conținutul seric cumulativ de PCA și severitatea bolii [10]. Cuantificarea anumitor PCA-uri a fost utilizată cu succes în practica clinică pentru verificarea sepsisului (brevetul de invenție nr. 2423704 RU), deși înțelegeri mai profunde și o mai bună înțelegere a rolurilor specifice și a mecanismelor de acțiune ale exometaboliților microbieni în metabolismul uman sunt încă în față [14-17 ].
Acidul benzoic - reprezentat la maximum în publicațiile disponibile - a fost ales ca model pentru analiza teoretică a diverselor proprietăți biologice ale APC.
Acid benzoic
Proprietăți biologice: Acid benzoic pur (Nr. CAS 65-85-0;? 6? 5. Greutate moleculară 122.13) este o substanță cristalină incoloră și albă cu 122º? topire și 249º? puncte de fierbere, slab solubile în apă (2,9 g se dizolvă în 1 L de apă la tº = 20º?). Acidul benzoic (BA) și sărurile sale sunt în mod obișnuit detectate prin spectrofotometrie, metode de cromatografie cu gaze și lichide [18].
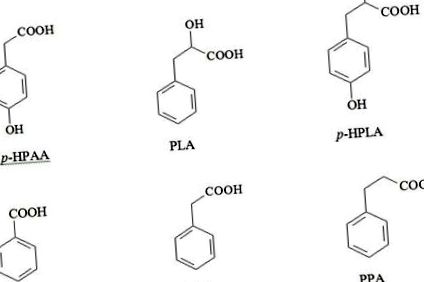
BA este sintetizat în mod natural de bacterii, plante și ciuperci. Concentrații mari de BA se găsesc în produsele lactate fermentate, cantități considerabile de BA sunt produse de lactobacili din acid hipuric și se acumulează ca produs final al biodegradării fenilalaninei (Figura 2) [15,18,19].
Figura 3: Relația dintre căile catabolice endogene și microbiene ale sintezei PCAS din fenilalanină și tirozină la oameni [14].
Deși, bacteriile utilizează unele PCA, în special acidul hidroxifenilpropionic (HPAA) și acidul p-hidroxifenilpropionic (p-HPPA) ca precursori pentru sinteza fenilalaninei, tirozinei și triptofanului [32].
S-a demonstrat că organismele superioare își pierd capacitatea de a produce unii metaboliți în coabitarea strânsă cu microflora în procesul de co-evoluție. Figura 3 arată exemplul de formare anaerobă a acizilor cinamici, hidroxicinamici, fenilpropionici și hidroxifenilpropionici exclusiv de bacterii.
efecte antimicrobiene
| Microorganism | pH | MIC, mg/L |
| Escherichia coli [33] | 6.0 | 100-200 |
| Lactobacillus spp [15] | 4.3-6.0 | 300-1800 |
| Pneumonie Klebsiella [33] | 6.0 | 100-200 |
| Pseudomonas aeruginosa [34] | 5.0/7.0 | 250/1000 |
| Pseudomonas aeruginosa [33] | 6.0 | 200-500 |
| Staphylococcus aureus [34] | 5.0/7.0 | 500/1000 |
| Staphylococcus aureus [33] | 6.0 | 50-100 |
| Streptococcus spp [15] | 5.2-5.6 | 200- 400 |
| Candida albicans [34] | 5.0/7.0 | 130 /> 1000 |
| Zygosaccharomyces bailii [33] | 4.8 | 4500 |
| Zygosaccharomyces bailii [33] | 4.0 | 1200 |
Tabelul 1: Concentrații minime de inhibitori BA pentru unele specii bacteriene și fungice, mg/L.
Datorită proprietăților antiseptice inerente BA și sărurile sale sunt utilizate în mod obișnuit ca conservanți (E210-? 213) în industria alimentară și cosmetică.
Efectul bacteriostatic potențial BA și bactericid asupra microflorei tractului GIT superior a fost demonstrat în studii experimentale pe purcei. Studiile bacteriologice ale potențialului PCA-urilor de a inhiba culturile pure de tulpini semnificative clinic au arătat că BA, precum și acidul fenilacetic (PAA) și acidul fenilpropionic (PPA), inhibau în cea mai mare măsură creșterea? coli, cu ATCC 25992 nepatogen? colistrain fiind mai rezistent la BA/PCA decât enteropatogen? 157: H7 E. coli. Un efect neglijabil al PCA-urilor cu una sau două grupări hidroxil (3-hidroxi-4-hidroxil-3, 4-dihidroxi-substituite PCA) în inelul aromatic a fost documentat cu tulpină enteropatogenă și niciun efect cu tulpina ATCC 25992 nepatogenă la ( Concentrații de 1000 mg/L. Acizii hidroxibenzoici s-au dovedit a fi mai puternici decât BA în inhibarea lactobacililor, în timp ce BA și derivații au fost cei mai eficienți inhibitori ai Staphylococcus aureus patogen (tulpina EP167). PAA și PPA par să fie inhibitorii supremi - în comparație cu derivații lor de hidroxil - ai lactobacililor și S. aureus [35].
Pseudomonas aeruginosa PAO1 din familia gram -ve a prezentat rezistență la BA și la alte PCA la concentrația de 1000 mg/L. BA și PPA la 1000 mg/L doar parțial (cu 16% și respectiv 29%) au inhibat? Andida albicans MY1055. Autorii au sugerat că sensibilitatea diferitelor microorganisme la PCA depinde în principal de structura specifică a peretelui celular [36]. Este important de menționat faptul că toate PCA-urile din această revizuire au inhibat propagarea microorganismelor la valori ale concentrației cuprinse într-o singură ordine, ceea ce implică mecanisme similare de acțiune a acestora, conform teoriei acizilor organici slabi (vezi mai jos).
S-a sugerat că BA aparține așa-numitelor alelochimice, exprimând alelopatia, adică suprimând sau inhibând creșterea altor organisme din mediu [37]. Acest lucru poate fi bine aplicabil altor PCA-uri. Sugerăm ca APC să regleze într-o oarecare măsură diversitatea și ritmurile de propagare ale microflorei umane [36].
Jenner AM și colab., Au identificat cantități semnificative de PCA-uri diferite în apele fecale umane cu predominant PAA-479 µa, PPA -166 µa, p- HPPA - 68 µa, acid 3,4-dihidroxi-cinamic - 52 µa; BA - 51 ua, acid 3-hidro-fenilacetic- 46 uM; p-HPAA - 19 u? și 3,4-dihidroxi-PAA - 7 ua. De importanță, monitorizarea pe termen lung a profilului APC colonice la voluntarii participanți a arătat persistența consecventă a nivelurilor de BA, variind între 23-25 µ? în probe zilnice consecutive [31].
Rezultatele studiilor proprii confirmă, de asemenea, potențialul bacteriilor anaerobe derivate din microflora umană de a produce PCA [38]. Mai mult, profilul PCA identificat a fost în concordanță cu cel al lui Jenner AM și colab. (Masa 2). De importanță, unele ACP din culturile anaerobe au fost acumulate până la niveluri, declarate de alți autori ca concentrații care inhibă propagarea microbiană.
155,7 mg/L (1036,8 u?)
Jenner AM [31]
35,4 mg/L (213 u?)
Beloborodova NV și colab. [38]
200-3500 u? Gerez CL [39]
Mecanisme de penetrare a PCA intracelulare
| Microorganism | BA | Acid acetic | Acid lactic |
| ?. cereus ATCC11778 | 296 | 2020 | 3480 |
| B. subtilis ATCC6633 | 192 | 105 | 8320 |
| E. coli ATCC25922 | 316 | 1550 | 3720 |
| L. fermentum ATCC14931 | 2500 | 26300 | 25300 |
| L. plantarum EH22G | 2610 | 27500 | 30700 |
Efecte asupra metabolismului celular
Într-un studiu anterior asupra culturii mitocondriale murine, BA la o concentrație de 0,1 µM s-a demonstrat că reduce potențialul membranei și conținutul de calciu într-o măsură semnificativă, suprimând respirația mitocondrială (complexul I al lanțului respirator) și inhibând oxidarea piruvatului probabil datorită blocării piruvatului dehidrogenazei. Aceste efecte ale benzoatului, considerate toxice, au fost atenuate de menadionă și ditiotreitol datorită oxidării grupărilor tiol [38,54]. S-a constatat, de asemenea, că BA și alte PCA inhibă producția de specii reactive de oxigen (ROS) în neutrofile, în timp ce se știe că ROS afectează activitatea fagocitară [38]. Aceste rezultate sunt în concordanță cu alte date publicate [55,56].
Benzoat de sodiu la 0,5-2 u? a fost raportat că suprimă în mod semnificativ producția indusă de lipopolizaharide (LPS) a unor citokine (TNF-α, IL-1β), NF-κB și iNOS (NO-sintază inductibilă) de către microglia. Deși timpul de expunere la Benzoat de sodiu (SB) (adică, durata incubării celulelor microgliei cu SB) înainte de LPS, în plus față de mediul de cultură, a fost de o importanță critică pentru realizarea efectelor SB [57]. Grupul spaniol a raportat, de asemenea, efectul inhibitor al altor metaboliți bacterieni 3,4-dihidroxi-fenilpropinici și 3,4-dihidroxi-fenilacetici asupra producției de citokine pro-inflamatorii (TNF-a, IL-1b și IL-6) în celule mononucleare [58].
Adăugarea SB la cultura celulară de microglia a fost asociată cu expresia reglementată în jos a markerilor D superficiali și a complexului de histocompatibilitate majoră de clasa II (M ? II). Fenomene similare au fost raportate în experimente cu astrocite umane [57].
Inhibarea marcată a oxidării acizilor grași a fost indusă în cadru experimental de către SB adăugată la ficatul murin omogenizat la 0,5-2 µa, între timp administrarea parenterală de 5-10 mmol/kg (1220-2440 mg/kg) SB la șobolani a dus la o reducere semnificativă de ATP,? oA și acetil-? oA și niveluri crescute de amoniu în țesutul hepatic [59].
Transportul prin membrană al metaboliților cu greutate moleculară mică
Menținerea valorii constante a pH-ului intracelular în mediul în schimbare este una dintre funcțiile celulare principale pentru a asigura supraviețuirea celulei.
Lin J și colab., Au raportat rezistența bacteriană indusă de glutamat la mediul acid ca mecanism mai eficient decât rezistența dependentă de arginină utilizată de? inch [60]. Aceste mecanisme nu au fost încă clarificate, dar experimentele cu E. coli au stabilit o expresie îmbunătățită a mai mult de 30 de proteine ca răspuns la provocarea BA [61].
Membrana? + - ATPaza este responsabilă pentru îndepărtarea protonilor din spațiul intracelular din Saccharomyces cerevisiae. Acest proces este intensificat instantaneu după adăugarea BA la mediile de cultură [50]. Saccharomyces cerevisiae, spre deosebire de Zygosaccharomyces bailii, nu poate metaboliza anioni BA, deci expulzează anioni BA din celulă de către purtători de transport. Inducerea sintezei transportorului Pdr12p este considerată a fi mecanismul principal al adaptării Saccharomyces cerevisiae la BA, asigurând îndepărtarea benzoatului prin mecanism de transport activ [51].
Transportorul de membrană Pdr12p aparține super-familiei transportoarelor ABC (casetă care leagă ATP) și, în afară de benzoat, transportă și alți anioni de acizi organici slabi, inclusiv p-HPAA? Anioni PAA [17]. . -transportorii au fost găsiți atât în procariote, cât și în eucariote, inclusiv în oameni [62,63]. Transportorii ABC joacă un rol cheie în rezistența bacteriană la antimicrobieni în organismele procariote, în timp ce la om - în rezistența la medicamente anticancer [64].
Transportul de anioni BA la mamifere și oameni este executat de transportorii de monocarboxilat dependenți de protoni (MCTs) și de transportorii de monocarboxilat de sodiu dependenți (SMCT) din super-familia MFS (Super Facilitator Major Family). Familia MCT este reprezentată de cel puțin 14 proteine de membrană, responsabile pentru transportul acizilor monocarboxilici cu greutate moleculară mică, a hormonilor tiroidieni și atât de importanți pentru monocarboxilații metabolici bazali precum lactatul, piruvatul și acetoacetatul. SMCT, valorificarea gradientului de sodiu, transportul corpurilor lactate, piruvate și cetonice din mediul extracelular în epiteliul și creierul intestinal și renal [65-67].
MCT1 este un transportor universal pentru majoritatea țesuturilor și organelor, inclusiv BBB (bariera hematoencefalică), în timp ce alte MCT sunt caracterizate prin specificitatea organelor. MCT-urile mențin pH-ul intracelular prin eliminarea din citosol a acizilor organici, produși prin glicoliză și alte procese metabolice. Celulele musculare, eritrocitele și celulele canceroase sunt extrem de dependente de MCT datorită glicolizei active și producției intensive de acizi organici [68]. Ficatul și rinichii pot utiliza lactatul pentru gluconeogeneză, în timp ce mușchii scheletului neted cardiac și dezlipit folosesc lactatul pentru „respirație” [69,70]. În funcție de țesut și de activitatea funcțională, MCT-urile îndepărtează acizii organici monocarboxilați din celulă sau îi transportă în celulă. În general, transportul specific al mono- și β4-dicarboxilaților joacă un rol cheie în metabolismul energetic al celulelor eucariote, legând procesele metabolice intracelulare și sistemice din întregul organism [71]. S-a demonstrat acum că acizii aromatici, cum ar fi BA și fenilpiruvic, pot inhiba MCT-urile și pot interfera cu capacitatea celulară pentru a menține valoarea pH-ului intracelular optim sub concentrație intracelulară ridicată de PCA, schimbând astfel căile enzimatice din interiorul celulei [68,72- 76].
- Extractul de cafea verde este un miracol de slăbire
- Lăcomia este cheia pentru a pierde în greutate
- Gwen Stefani îl obligă pe Blake Shelton să piardă în greutate
- Ultimul magazin pentru pastile de pierdere în greutate neagră - Managementul HazMat
- Pastile de slăbit Herbalife - funcționează pentru slăbit