Ulrika Beitnere
1 Departamentul de farmacologie, Facultatea de Medicină, Universitatea din Letonia, Riga, Letonia
Thomas van Groen
2 Departamentul de biologie celulară, de dezvoltare și integrativă, Universitatea din Alabama la Birmingham, Birmingham, Alabama
Ashish Kumar
2 Departamentul de biologie celulară, de dezvoltare și integrativă, Universitatea din Alabama la Birmingham, Birmingham, Alabama
Baiba Jansone
1 Departamentul de farmacologie, Facultatea de Medicină, Universitatea din Letonia, Riga, Letonia
Vija Klusa
1 Departamentul de farmacologie, Facultatea de Medicină, Universitatea din Letonia, Riga, Letonia
Inga Kadish
2 Departamentul de biologie celulară, de dezvoltare și integrativă, Universitatea din Alabama la Birmingham, Birmingham, Alabama
Abstract
S-a demonstrat anterior că Mildronatul, un medicament congener de carnitină, oferă neuroprotecție într-un model de șoarece de neurotoxicitate indus de azidotimidină și într-un model de șobolan în boala Parkinson. Scopul acestui studiu a fost de a investiga efectele tratamentului cu mildronat asupra cogniției și patologiei la șoarecii model de boală Alzheimer (AD) (APPSweDI). Mildronatul a fost administrat i.p. zilnic la 50 sau 100 mg/kg timp de 28 de zile. La sfârșitul tratamentului, animalele au fost testate comportamental și cognitiv, iar creierele au fost evaluate pentru patologia asociată cu AD, inflamația, markerii sinaptici și acetilcolinele-terase (AChE). Datele arată că tratamentul cu mildronat a îmbunătățit semnificativ performanța animalelor în labirintul de apă și testele de recunoaștere socială, a redus depunerea amiloid-β în hipocamp, a crescut expresia markerului microgliei Iba-1 și a scăzut colorarea AChE, deși nu a modificat expresia proteinelor implicat în plasticitatea sinaptică (GAP-43, sinaptofizină și GAD67). Luate împreună, aceste descoperiri indică capacitatea mildronatului de a îmbunătăți cunoașterea și de a reduce patologia β-amiloidă la un model de șoarece de AD și posibila sa utilitate terapeutică ca medicament care modifică boala la pacienții cu AD.
Boala Alzheimer (AD) este asociată cu declinul cognitiv, ducând la afectarea funcțională și pierderea independenței. S-a recunoscut pe scară largă că AD reprezintă o provocare pentru societate și pentru furnizorii de servicii medicale (Wimo și colab., 2011). Prin urmare, nevoia de a dezvolta terapii eficiente pentru a trata și/sau a întârzia apariția acestei boli rămâne urgentă.
Cele două caracteristici patologice ale creierelor AD sunt acumularea extracelulară a peptidei amiloide-β (Aβ) în plăcile neuritice și încurcăturile neurofibrilare intracelulare compuse din proteină tau hiperfosforilată (Karran și colab., 2011). Mai mult, se observă o reducere a numărului de neuroni, în special în hipocamp și cortex entorhinal (Lippa și colab., 1992; West și colab., 1994) și sinapse (Terry și colab., 1991), cu modificări neurochimice care afectează colinergic. căi (Craig și colab., 2011). În plus, procesele inflamatorii și disfuncția mitocondrială pot juca un rol important în progresia bolii (Ballard și colab., 2011).
Medicamentele existente pentru Alzheimer oferă în prezent unele beneficii simptomatice timp de până la 12 luni, dar încă nu sunt disponibile tratamente care să modifice boala (Corbett și colab., 2012). Recent, eșecurile a numeroase terapii noi de modificare a bolii în studiile clinice indică faptul că o strategie complementară bazată pe repoziționarea medicamentelor care sunt aprobate pentru alte indicații ar putea fi mai promițătoare. Repoziționarea medicamentului este aplicarea compușilor medicamentoși consacrați la noi indicații terapeutice și a stat la baza terapiilor de succes (Hubsher și colab., 2012), în special cu înregistrarea lor de siguranță stabilită, care este un avantaj esențial față de compușii noi (Ashburn și Thor, 2004).
Prezentul studiu a investigat pentru prima dată efectul mildronatului la șoarecii AD transgenici APPSweDI. Acești șoareci exprimă proteina precursor amiloid uman (APP) cu mutații suedeze, olandeze și Iowa pe un fundal C57BL/6. Acest model de șoarece dezvoltă acumularea timpurie și o acumulare robustă de Aβ în creier cu o asociere ridicată cu microvasele cerebrale și dezvoltă, de asemenea, deficite cognitive timpurii (Davis și colab., 2004). Am testat șoarecii în diferite sarcini comportamentale (câmp deschis, zero labirint) și cognitive (recunoaștere socială și labirint de apă). Mai mult, patologia AD a fost evaluată în hipocampus imunohistochimic și prin Western blot. Patologia AD a fost evaluată pentru Aβ, GFAP, Iba-1, glutamat decarboxilaza 67 (GAD67), proteina asociată creșterii 43 (GAP-43), sinaptofizină și acetilcoline-terasă (AChE). Tratamentul de 28 de zile cu mildronat a îmbunătățit semnificativ performanța cognitivă în labirintul de apă și sarcinile de recunoaștere socială și a scăzut patologia Aβ și expresia AChE.
MATERIALE ȘI METODE
Animale
Șoarecii Tg APPSweDI originali au fost obținuți de la Dr. Van Nostrand (SUNY Stony Brook, Stony Brook, NY) și sunt întreținute local într-o colonie. Pentru acest studiu, am folosit trei grupuri de șoareci femele în vârstă de 4 luni (n = 36). Animalele au fost adăpostite cu fibre pe cușcă într-un mediu controlat de la Universitatea Alabama la Birmingham Animal Care Facility (temperatura 22 ° C, umiditate 50-60%, cu un ciclu de lumină/întuneric de 12 ore); hrana și apa erau disponibile ad libitum. S-au făcut toate eforturile pentru a reduce la minimum suferința animalelor și pentru a reduce numărul animalelor utilizate. Experimentele au fost efectuate în conformitate cu ghidurile Comitetului instituțional instituțional de îngrijire și utilizare a animalelor (IACUC).
Produse chimice
Mildronatul [3- (2,2,2-trimetilhidraziniu) propionat dihidrat] a fost obținut de la Societatea pe acțiuni „Grindex” (Riga, Letonia), dizolvat în soluție salină și preparat sub formă de soluție stoc 1%.
Proiectare experimentală
Șoarecii au fost randomizați la unul dintre cele trei grupuri experimentale cu greutate (n = 12/grup); greutatea medie a fost de 21 ± 2 g; iar mildronatul la doze de 50 mg/kg (grup M50) sau 100 mg/kg (grup M100) sau martor (ser fiziologic) a fost administrat intraperitoneal (i.p.) în fiecare zi timp de 28 de zile. La două săptămâni după începerea tratamentului, animalele au fost testate în două sarcini comportamentale, adică testul în câmp deschis și labirint zero. În săptămâna următoare au fost testați în testele de recunoaștere socială și labirint de apă. La sfârșitul testării comportamentale, adică la 4 săptămâni după începerea tratamentului, animalele au fost sacrificate pentru analize histopatologice și biochimice.
Șoarecii au fost profund anesteziați și sacrificați printr-o perfuzie transcardică cu soluție salină rece. Creierele au fost îndepărtate imediat după decapitare și tăiate în jumătate în plan sagital. Emisfera stângă a fost disecată în patru bucăți (cortexul rostral, cortexul caudal, hipocampul și trunchiul central/creierului) și stocată la -80 ° C pentru analiza Western blot (WB). Emisfera dreaptă a fost fixată prin imersiune în paraformaldehidă 4% timp de 24 de ore, crioprotejată în zaharoză 30% în tampon fosfat 0,1 M pentru încă 24 de ore și depozitată în soluție antigel la -20 ° C până la momentul secționării.
Evaluarea comportamentală și cognitivă
Pe scurt, testul de câmp deschis și labirint zero au fost utilizate pentru a evalua locomoția, activitatea exploratorie și anxietatea. Recunoașterea socială și testul labirintului de apă au fost folosite pentru a măsura abilitățile cognitive ale animalelor. Animalele au fost puse în arenă și observate cu un sistem de urmărire condus de cameră, adică Ethovision (Noldus, Olanda). Labirintul în câmp deschis este o arenă de 42 x 42 cm pătrat, cu laturi transparente din plexiglas (20 cm înălțime). Arena este împărțită în două zone, zona centrală deschisă și partea laterală de perete. Acest test măsoară activitatea și anxietatea, adică timpul petrecut în centrul „deschis” vs. partea „sigură”. Labirintul zero constă dintr-un labirint circular (70 cm diametru) care este ridicat cu 40 cm deasupra mesei și împărțit în patru părți egale. Două părți au laturi înalte de 15 cm din material netransparent și două părți au doar un perete înalt de 0,5 cm, adică două zone deschise și două zone închise. Testul măsoară anxietatea la animal; adică cât timp petrece animalul în aer liber vs. zonele închise, „sigure”?
Recunoașterea socială a fost testată într-o cutie dreptunghiulară cu trei camere din policarbonat transparent. Cuantificarea intrărilor și durata în camere a fost înregistrată automat timp de 10 minute în prima zi și timp de 4 minute în a doua zi. Animalele utilizate ca subiecți de testare au fost șoareci masculi C57BL6 care au fost așezați sub o cană de sârmă în fiecare cameră laterală. În prima zi, doi șoareci „subiecți” erau prezenți sub cupele de sârmă din arenă; în ziua următoare, unul dintre șoarecii „vechi” și un șoarece de testare „nou” erau prezenți sub cupele de sârmă. Măsurătorile luate au inclus timpul petrecut în fiecare cameră, timpul petrecut adulmecând fiecare șoarece de testare și numărul de intrări în camerele de testare.
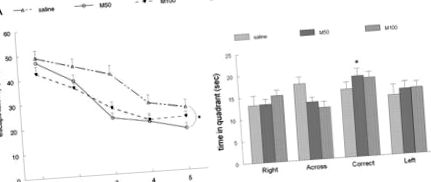
Versiunea noastră a labirintului de apă a constat dintr-un rezervor circular albastru de apă limpede (23 ° C ± 1 ° C). În testul labirintului de apă, șoarecii au fost antrenați pentru trei probe de 60 de secunde pe zi pentru a înota dintr-unul din cele trei puncte de plecare ale bazinului pentru a găsi o platformă fixă, ascunsă, scufundată sub apă (0,5 cm) într-unul din cadranuri a bazinului. Dacă animalul nu a localizat platforma în timpul respectiv, acesta a fost plasat pe ea de către experimentator și lăsat acolo timp de 10 secunde. Odată ce șoarecele a învățat sarcina (ziua 5, proba 15), a fost dat un proces de sondare în ziua 8. În procesul de sondare (de exemplu, procesul 16), platforma a fost scoasă din piscină și animalelor li s-a permis să înoate 60 sec. Șoarecii cu funcție de memorie intactă rămân de obicei în căutarea unui timp mult mai lung în cadranul „corect”, în timp ce șoarecii afectați ar explora mai uniform între cei patru cadrani. Toate testele comportamentale au fost efectuate de o persoană care a fost orbită de grupurile de tratament ale animalelor. Datele au fost analizate de ANOVA unidirecțional, iar testul post-test al Bonferroni a fost efectuat pentru a determina sursa efectului principal principal sau a interacțiunii.
Imunohistochimie
Cuantificare
Trei grafice liniare care prezintă curbele de învățare ale celor trei grupuri de șoareci. A: Performanță medie zilnică în labirintul de apă; în ziua 5, grupul M50 (50 mg/kg mildronat) a găsit în mod semnificativ platforma de evacuare (* P Fig. 3. AA, B). În mod similar, s-a înregistrat o scădere semnificativă a depunerii Aβ în girusul dentat din grupul M50 (M50 vs. soluție salină; P Fig. 3. AA, B). Densitatea medie în grupuri a fost 174,4 ± 2,3, M50 183,2 ± 1,5, M100 186,6 ± 1,9, cu o diferență semnificativă între grupurile M50 și grupurile saline (P Fig. 3. AA, B) nu au prezentat diferențe semnificative între grupuri în densitatea medie a expresiei GFAP (ser fiziologic 179,3 ± 2,4, M50 173,5 ± 1,6, M100 176,9 ± 1,6). De asemenea, nu a existat nicio diferență semnificativă între densitatea medie de colorare AChE, măsurată în strat radiatum (soluție salină 174,5 ± 2,0, M50 165,7 ± 3,9, M100 169,5 ± 3,4) în hipocampus. Cu toate acestea, densitatea medie de colorare pentru AChE în stratul piramidal a fost semnificativă (P Fig. 3. AA, B).
Analiza BM
Pentru a înțelege baza moleculară care a dus la îmbunătățirea cognitivă, s-a întreprins analiza WB pentru GAD67, sinaptofizină și GAP43. Analiza WB nu a relevat modificări semnificative între serul salin și grupurile de tratament în oricare dintre aceste proteine (Fig. 4).
Pete Western reprezentative de omogenizați hipocampici din soluție salină (sal) -, șoareci tratați cu M50 (50 mg/kg mildronat) - și M100 (100 mg/kg mildronat) colorate pentru GAD67, GAP43, sin-aptofizină și α-tubulină. Nu au existat diferențe semnificative în niciunul dintre acești markeri între serurile saline și grupurile de tratament.
DISCUŢIE
Scopul principal al acestui studiu a fost de a evalua dacă mildronatul ar fi capabil să îmbunătățească cunoașterea la șoarecii transgenici APPSweDI și să atenueze patologia creierului. Ration-ale pentru efectuarea unui astfel de studiu a fost că mildronatul a fost demonstrat anterior că are proprietăți de îmbunătățire a memoriei; în mod similar, s-a demonstrat că promovează proliferarea celulelor progenitoare neuronale și sporește expresia sinaptică a proteinelor (Klusa și colab., 2013). Tratamentul cu Mildronat a scăzut expresia proteinelor legate de inflamație și apoptoză, dar a crescut expresia de chaperonă endogenă Hsp70, într-un model de șobolan al bolii Parkinson (Isajevs și colab., 2011) și într-un model de neurotoxicitate azidotimidină la șoareci (Pupure și colab., 2010).
În mod similar, la șoarecii transgenici care supraexprimă doar transgenul APP, un număr redus de plăci și niveluri reduse de markeri de inflamație IL-1β și GFAP au fost găsite după tratamentul cu ibuprofen (Lim și colab., 2000). În studiul nostru, mildronatul nu a afectat expresia GFAP. Cu toate acestea, este posibil ca variația relativ mare a densității de colorare pentru GFAP între animale să ne împiedice să vedem diferențe semnificative între grupuri.
Mildronatul nu a modificat nivelurile oricăruia dintre markerii de plasticitate sinaptică pe care i-am măsurat (adică, GAP-43, sinaptofizină și GAD67). Cel mai probabil, nu au fost prezente modificări semnificative, deoarece Western blots au fost efectuate pe întregul hipocamp, iar modificările care au fost măsurate în imunohistochimie au fost prezente doar în anumite părți ale zonelor hipocampului, de exemplu, stratum oriens de CA1 sau strat pyramidale din CA1.
Semnalizarea colinergică disregulată este un semn distinctiv timpuriu al AD și este cauzată de pierderea neuronilor colinergici, probabil din cauza acumulării de Aβ în hipocamp (Craig și colab., 2011). Enzima AChE este responsabilă pentru descompunerea acetilcolinei la sinapsă neuronală și joacă un rol important în transmiterea sinaptică. Blocarea activității acestei enzime a fost prima abordare pentru atenuarea deficitelor de memorie în AD (Martorana și colab., 2010). În studiul nostru, mildronatul a afectat nivelurile de AChE numai în zona CA1 la șoarecii care au fost tratați cu M50, dar nu și în grupul M100. Acest lucru, totuși, se corelează cu o cunoaștere îmbunătățită în acest grup în comparație cu grupul M100. Scăderea expresiei AChE în zona CA1 determină probabil niveluri mai ridicate de acetilcolină și, prin urmare, o mai bună funcționare a zonei CA1 în învățarea spațială și în memorie, după cum se indică prin performanțe semnificativ îmbunătățite în labirintul de apă din grupul M50. În mod similar, un număr scăzut de fibre nervoase AChE-pozitive a fost găsit anterior la șobolani tratați cu mildronat care și-au îmbunătățit performanța în testul de răspuns la evitare condiționat (CAR) (Klusa și colab., 2013).
Alternativ, este de conceput că mildronatul acționează prin alte căi pentru a îmbunătăți abilitățile cognitive la șoarecii model AD. Una dintre posibilități este că mildronatul mărește fluxul sanguin cerebral și, prin aceasta, îmbunătățește fluxul de Aβ solubil din creier. În sprijinul acestui concept sunt date de la Sjakste și colab. (2005), care sugerează că efectele SNC ale mildronatului ar putea fi mediate prin stimularea producției de NO în endoteliul vascular prin modificarea γ-butirobetainei și a piscinelor sale de esteri.
O altă posibilitate este că mildronatul afectează rețeaua de vitagene. Recent, L-carnitina și metabolitul său acetil-L-carnitină s-au dovedit a fi neuroprotectoare prin activarea căilor hormetice, inclusiv a vitagenelor (Calabrese și colab., 2012). Punem în evidență asemănarea structurală a carnitinei și mildronatului, ceea ce ne face să-l considerăm pe acesta din urmă ca un analog al carnitinei. În plus, merită menționată capacitatea mildronatului de a stimula expresia HSP70 în striatul și substanța neagră cu leziuni 6-OHDA (Isajevs și colab., 2011). Genele Vita codifică proteinele de șoc termic, iar acțiunea neuroprotectoare poate fi explicată cel puțin parțial prin activarea răspunsului la stres și a căilor hormetice. Cu toate acestea, nu avem date despre (sau cum) mildronatul reglează sistemul HSP la animalele model AD, dar se poate aștepta la un efect similar evocat de acetil-L-carnitina, care reglează în sus HSP și protejează neuronii corticali împotriva oxidantului mediat de Aβ42 stres și neurotoxicitate (Abdul și colab., 2006).
Având în vedere rezultatele studiului actual, sugerăm că doza de 50 mg/kg este mai eficientă în îmbunătățirea cogniției și în scăderea patologiei legate de AD la șoarecii noștri model AD. În majoritatea seturilor de date din studiul actual, se pare că M50 are un rezultat mai pozitiv decât grupul M100, indicând faptul că doza de M100 ar putea fi prea mare și să aibă efecte secundare nedorite. Aceste efecte ar putea fi legate de specii; s-a demonstrat că dozele de până la 200 mg/kg la șobolani au efecte protectoare la modelele de accident vascular cerebral de șobolan (Svalbe și colab., 2011).
Datele arată că mildronatul are mai multe efecte pozitive la șoarecii model AD, inclusiv îmbunătățirea recunoașterii sociale și a învățării spațiale în labirintul de apă și o reducere a încărcăturii cu Aβ. Mai mult, microglia este activată la șoarecii tratați cu mildronat, iar expresia AChE este scăzută în zona CA1. Împreună, aceste descoperiri indică faptul că mildronatul ar putea avea utilitate terapeutică ca medicament care modifică boala la pacienții cu AD. Șoarecii noștri model AD la această vârstă nu au patologie tau, astfel încât în studiile ulterioare va fi important să se evalueze dacă tratamentul cu mildronat la modelele AD de șoarece cu patologie tau ar avea efecte similare. În plus, au fost necesare studii viitoare în modele preclinice de AD pentru a înțelege mai bine mecanismele moleculare prin care mildronatul acționează pentru a îmbunătăți cunoașterea și a reduce patologia.
Mulțumiri
Sponsor al contractului de finanțare: Baltic American Freedom Foundation; Sponsor al grantului contractului: NIH, numărul grantului contractului: P30 NS47466.
Autorii nu au conflicte de interese de declarat.
- Boala metabolică a oaselor la puii de leu de la Grădina Zoologică din Londra, în 1889, modelul original de rahitism
- Suplimentul caloric neproteic îmbunătățește aderența la dieta cu conținut scăzut de proteine și exercită beneficii
- Bara de nutriție îmbunătățește funcția pulmonară la adolescenții supraponderali și obezi cu astm
- Suplimentarea cu Fucoxantină cu alge îmbunătățește parametrii obezității la subiecții japonezi cu obezitate ușoară
- Monitorizarea bolilor hepatice grase cu RMN după o intervenție chirurgicală bariatrică Un centru prospectiv, dual