Jin-Ming Wu
1 Departamentul de Chirurgie, Spitalul Universitar Național din Taiwan și Colegiul Național de Medicină al Universității din Taiwan, Taipei, Taiwan, ROC
Te-Wei Ho
1 Departamentul de Chirurgie, Spitalul Universitar Național din Taiwan și Colegiul Național de Medicină al Universității din Taiwan, Taipei, Taiwan, ROC
Ching-Yao Yang
1 Departamentul de Chirurgie, Spitalul Universitar Național din Taiwan și Colegiul Național de Medicină al Universității din Taiwan, Taipei, Taiwan, ROC
Po-Huang Lee
1 Departamentul de Chirurgie, Spitalul Universitar Național din Taiwan și Colegiul Național de Medicină al Universității din Taiwan, Taipei, Taiwan, ROC
Yu-Wen Tien
1 Departamentul de Chirurgie, Spitalul Universitar Național din Taiwan și Colegiul Național de Medicină al Universității din Taiwan, Taipei, Taiwan, ROC
Abstract
fundal
Acest studiu bazat pe populație a evaluat modificările metabolismului glucozei după pancreatectomia distală (DP).
Metode
Datele din baza de date națională de cercetare a asigurărilor de sănătate din Taiwan au fost colectate în perioada 2001-2010. Din 1.980 de pacienți care au suferit DP, 507 au avut diabet, iar 1.410 nu.
Rezultate
Dintre cei 1.410 pacienți non-diabetici pre-DP, 312 (22,1%) au dezvoltat diabet nou diagnosticat după DP. Analiza de regresie logistică multiplă a arătat că dislipidemia [raportul de pericol = 1.940; Interval de încredere 95% = 1.362-2.763; Cuvinte cheie P: pancreatectomie distală, pancreatită cronică, dislipidemie, metabolismul glucozei, bază de date la nivel național
INTRODUCERE
Pancreatectomia distală (DP) este procedura chirurgicală standard pentru rezecția leziunilor neoplazice și neoplazice ale corpului și cozii pancreatice [1]. Numărul procedurilor DP a crescut recent din cauza îmbunătățirilor în detectarea neoplasmelor pancreatice chistice și limită (cele mai multe se dezvoltă în pancreasul distal) [2, 3] și a creșterii indicațiilor de intervenție chirurgicală pancreatică pentru tumorile maligne benigne sau de grad scăzut. . [4]. În plus, DP poate oferi ameliorarea durerii asociate cu pancreatita cronică (CP) în pancreasul stâng și astfel poate îmbunătăți calitatea vieții [5].
Pancreasul joacă un rol major în metabolismul glucozei prin intermediul hormonilor endocrini și secretă diferite sucuri digestive în duoden sub forma unei glande exocrine [6]. Ca atare, DP poate duce la deteriorarea homeostaziei glucozei și a insuficienței pancreatice exocrine (EPI) din cauza pierderii parenchimului pancreatic. Diabetul zaharat asociat pancreatectomiei (DM) este definit ca debutul DM după pancreatectomie (DM pancreatogenă). American Diabetes Association clasifică acest tip de DM ca „un alt tip specific de diabet zaharat” [7]. Ratele DM pancreatogene (tip 3c) variază de la 9% la 39%, în funcție de amploarea DP, precum și de boala de bază [1, 8]. Mai mult, EPI asociat după pancreatectomie poate duce la deteriorarea stării nutriționale, care la rândul său deteriorează metabolismul glucozei [9].
Incidența insuficienței endocrine pancreatice după DP poate crește, deoarece perioada de urmărire după intervenția chirurgicală devine mai lungă și se efectuează mai multe DP pentru bolile non-maligne la pacienții mai tineri care au speranță de viață lungă. În plus, DP efectuat pentru CP poate fi asociat cu o incidență mai mare a insuficienței pancreatice din cauza pierderii țesuturilor pancreatice și a deteriorării anterioare/în curs a parenchimului pancreatic rezidual [10]. Cu toate acestea, unele rapoarte au indicat faptul că mulți pacienți au post-operatorii cu nivel normal de glicemie postoperator după DP și că există un efect redus asupra funcției exocrine pancreatice [5, 11]. Mai mult, subiecții DM pre-DP pot prezenta deteriorarea metabolismului glucozei după DP din cauza pierderii parenchimului pancreatic. Până în prezent, puține studii au investigat incidența DM pancreatogenă post-DP după rezecția bolilor pancreatice benigne sau maligne cu o perioadă lungă de urmărire.
Scopul acestui studiu a fost de a examina retrospectiv modificările pe termen lung ale funcției endocrine pancreatice după DP folosind datele din baza de date națională de cercetare a asigurărilor de sănătate din Taiwan (NHIRD).
REZULTATE
Incidența insuficienței pancreatice endocrine la subiecții non-DM după DP
tabelul 1
DISCUŢIE
Acest studiu a constatat că 22,1% dintre pacienții care au suferit DP au dezvoltat DM. CP și dislipidemia sunt doi factori semnificativi care contribuie la insuficiența endocrină pancreatică post-DP. CP este o boală caracterizată prin inflamație pancreatică progresivă și leziuni fibrotice, care provoacă leziuni parenchimale ireversibile și care duc la pierderea funcției endocrine și exocrine [14]. Mai mult, rezecția pancreatică pentru CP deteriorează în continuare metabolismul glucozei, care este în mod clar asociat cu gradul de rezecție a parenchimului și, de asemenea, cu progresia pancreatitei subiacente [15]. Comparativ cu DP pentru CP, rezecția tumorilor pancreatice este aparent asociată cu o incidență mai mică a disfuncției endocrine. Rata de debut nou DM după DP la pacienții fără pancreatită este relativ scăzută, la aproximativ 5% –9% [1, 11, 16]. Pentru pacienții cu CP, riscul raportat de DM după DP este de aproximativ 22% -50%, ceea ce este similar cu constatările noastre [5, 17-19].
În plus, rezultatele acestui studiu au arătat că dislipidemia este un factor de risc pentru DM post-DP. Dislipidemia este un factor de risc pentru dezvoltarea bolii pancreasului gras nealcoolic, care poate reduce funcția celulelor β, probabil prin lipotoxicitate [20]. Unele studii clinice susțin asocierea dintre un pancreas gras și un risc crescut de DM [21, 22]. În schimb, alte studii, în care tomografia computerizată a fost utilizată pentru a evalua severitatea pancreasului gras, nu susțin asocierea dintre un pancreas gras și DM [23, 24]. Aceste constatări incoerente pot fi legate de definiția unui pancreas gras pe baza metodei imagistice, a rasei, a duratei de urmărire și a sindroamelor metabolice asociate [25].
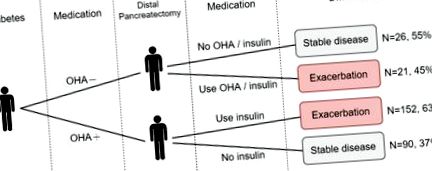
Mai mult, au fost analizate modificările metabolismului glucozei ale DM pre-DP fără utilizarea insulinei, care au arătat deteriorarea metabolismului glucozei la 59,9% dintre pacienți după DP. Deși s-a anticipat că astfel de cazuri au o disfuncție relativă a metabolismului glucozei înainte de DP, deteriorarea metabolismului glucozei a fost semnificativă din punct de vedere clinic după aceea, clinicienii ar trebui să informeze pacienții despre aceste informații, să monitorizeze îndeaproape parametrii zahărului din sânge și să ajusteze în mod adecvat strategiile anti-hiperglicemice.
Odată cu avansarea metodelor de calcul și tehnice în metabolom, ambii metaboliți derivați de aminoacizi/acizi grași au fost aprobați pentru a fi asociați cu patogeneza diabetului și factorii de risc asociați [28]. Creșterile nivelurilor plasmatice de aminoacizi cu lanț ramificat și aromat au fost considerate nu numai ca un marker al rezistenței la insulină, ci și ca un risc predictiv pentru dezvoltarea diabetului de tip 2 [29, 30]. În schimb, nivelurile plasmatice de glicină și glutamină au scăzut la pacienții cu rezistență la insulină [31, 32]. Dintre metabolomul lipidic, acizii grași cu lanț lung și acilcarnitinele cu lanț scurt și impar au contribuit la afectarea fiziopatologică a metabolismului glucozei [33, 34]. Din punct de vedere clinic, vor fi necesare studii suplimentare pentru a integra pe deplin aceste descoperiri în descoperirea fiziopatologiei diabetului zaharat la pacienții cu DP.
Măsuri finale
Rezultatele acestui studiu au fost insuficiența endocrină pancreatică a cazurilor pre-DP non-DM și deteriorarea metabolismului glucozei în cazurile pre-DP DM fără utilizarea insulinei. Insuficiența endocrină a fost definită ca un nou diagnostic de DM după DP. În scopul acestui studiu, DM a fost definită ca două sau mai multe vizite de ambulatoriu sau o singură internare cu un cod de diagnostic de DM (ICD-9-CM cod 250) [42]. Această definiție a DM a fost validată într-un studiu anterior NHIRD în care sensibilitatea a fost de 93,2% și valoarea predictivă pozitivă a fost de 92,3% [44]. Utilizarea agenților antihiperglicemici orali (OHA) și a insulinei a fost, de asemenea, examinată din baza de date cu prescripții farmaceutice. Deteriorarea metabolismului glucozei a fost definită fie ca pre-DP DM tratată cu un medicament hipoglicemiant oral, dar fără utilizarea unui medicament antihiperglicemic (AHM; OHA sau insulină) sau pre-DP DM tratat cu OHA și insulină după DP.
Covariate
De asemenea, au fost colectate date de comorbiditate ale pacienților înainte de DP. Comorbiditățile au fost identificate prin următoarele coduri ICD-9-CM: splenectomie concomitentă în timpul DP (41,5), boala ulcerului peptic (531-535), dislipidemie (272,0-272,2), CP (577,1), insuficiență renală (584.x - 586 .x), hipertensiune (401.x - 405.x) și cancer pancreatic (157.0–157.9). Acuratețea diagnosticului cancerului a fost confirmată de Registrul pentru baza de date a pacienților cu boli catastrofale, o sub-parte a NHIRD [42]. Indicele de comorbiditate Charlson a fost calculat pentru a evalua severitatea comorbidităților pentru fiecare pacient [45]. Caracteristicile demografice investigate au fost sexul, vârsta (≤49, 50−64 și ≥65 de ani) și venitul lunar (noul dolar taiwanez ≤22.798 sau> 22.798).
- Alterarea metabolismului monoaminei în modificările neuropsihiatrice induse de dieta bogată în grăsimi la șobolani OMICS
- Glucidele din nutriția peștilor afectează creșterea, metabolismul glucozei și enzimele hepatice - HEMRE
- Evaluarea efectelor unei băuturi de hrișcă asupra metabolismului glicemiei postprandiale asupra sănătății și T2D
- Un nou studiu relevă faptul că brânza vă poate reduce nivelul colesterolului
- Utilizări de anason, beneficii; Efecte secundare - Baza de date pe bază de plante