Jayashree A Chandrasekharan
Laboratoarele de cercetare a cancerului HM Bligh, Departamentul de Microbiologie și Imunologie, Școala de Medicină din Chicago, Universitatea de Medicină și Știință Rosalind Franklin, North Chicago, IL, SUA
Neelam Sharma-Walia
Laboratoarele de cercetare a cancerului HM Bligh, Departamentul de Microbiologie și Imunologie, Școala de Medicină din Chicago, Universitatea de Medicină și Știință Rosalind Franklin, North Chicago, IL, SUA
Abstract
Rezumat video
Descărcați fișierul video. (80M, avi)
Introducere
Ca răspuns la infecții, leziuni și stimuli inflamatori, mediatorii chimici sunt eliberați ca regulatori ai răspunsului imun. Lipoxinele sunt o astfel de moleculă anti-inflamatorie, care rezolvă, care este secretată de celulele imune, cum ar fi neutrofilele și macrofagele. 1,2 Lipoxinele au fost mai întâi izolate din leucocitele umane de către Serhan și colab. Și au fost descrise mai întâi ca o serie nouă de compuși cu patru legături duble conjugate.3 Lipoxinele sunt un metabolit al căii acidului arahidonic, care a fost bine studiat de Hamberg și Samuelsson.4 Căile acidului arahidonic joacă un rol important în inflamație, producând mai multe molecule antiinflamatoare.5
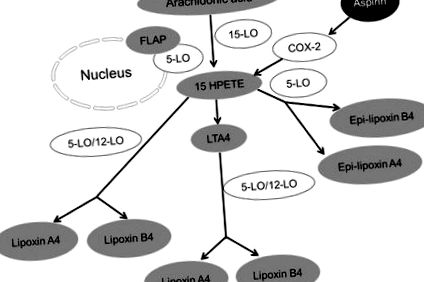
Sinteza lipoxinei. Trei lipoxigenaze majore (LO) precum 5-LO, 15-LO și 12-LO sunt implicate în sinteza lipoxinelor din acid arahidonic.
Note: În prima cale de sinteză a lipoxinelor, LTA4 este acționat de 12-LO și este transformat în lipoxine. A doua cale de sinteză a lipoxinelor implică acțiunea unei serii de activități lipoxigenază (5-LO în neutrofile și 15-LO în eritrocite) asupra acidului arahidonic care apoi se transformă în 15-HEPTE. Lipoxinele se formează din 15-HEPTE prin acțiunea fie a 5-LO, fie a 12-LO. A treia cale este formarea epi-lipoxinei A4 sau a lipoxinei declanșate de aspirină (ATL) și a epi-lipoxinei B4 a cărei generație este dependentă de aspirină. Fără umplutură reprezintă enzime, în timp ce umplutura gri reprezintă metaboliții sau produsele finale.
Abrevieri: 15-HPETE, acid 15-hidroxiperoxieicosatetraenoic; COX-2, ciclooxigenază-2; FLAP, proteină activatoare de 5-lipoxigenază; LTA4, leucotriene A4.
Lipoxina și epi-lipoxina interacționează cu ALX/FPR2 și această interacțiune duce la declanșarea mai multor evenimente celulare care apar în câteva secunde sau minute (Figura 2). Un studiu efectuat pe celulele endoteliale ale venei ombilicale umane arată că există o internalizare substanțială a ALX/FPR2 în regiunea perinucleară la stimularea cu lipoxină.38 Internaționalizarea ALX/FPR2 este esențială pentru acțiunea antiinflamatoare a lipoxinelor.34
efectul lipoxinelor asupra cascadelor de semnalizare citoplasmatică și a factorilor de transcripție.
Abrevieri: AP-1, activator de proteină-1; DAG, diacil-glicerol; EGR1, răspuns la creștere timpurie 1 genă; ERK, kinază extracelulară reglementată de semnal; IL-8, interleukină 8; IP3, inozitol trifosfat; JAK, Janus kinase; MEK, protein kinază kinază activată cu mitogen; MPO, mieloperoxidază; mTOR, țintă de rapamicină la mamifere; NAB1, proteina 1 care leagă NGFIA; NFκB, Factor nuclear κB; Nrf2, factor nuclear ca 2; ONOO, anion peroxonitrit; PI3K, fosfatidilinozitol-4,5-bisfosfat 3-kinază; PLD, fosfolipază D; PPAR, receptor activat de proliferatorul peroxizomului; SAA, amiloid seric A; TNFα, factor alfa de necroză tumorală; SOCS, supresori ai semnalizării citokinelor; PIPP, poliizoprenil fosfat.
Interiorizarea ALX/FPR2 după stimularea lipoxinei are loc într-o manieră dependentă de timp.33,34 Un studiu realizat de Maderna și colab. Arată că în celulele nestimulate, ALX se găsește predominant pe suprafața celulei. După 5 minute de stimulare a lipoxinei, ALX a putut fi găsit atât pe pliantele interioare cât și exterioare ale membranei plasmatice. După 15 minute, ALX se găsește în endosom și ulterior în compartimentul endosom târziu - lizozom. După 120 de minute, ALX își reia expresia suprafeței.39 Internalizarea receptorului ALX este esențială pentru fagocitoză.35 Maderna și colab. Au arătat că internalizarea receptorului este afectată de tratamentul cu inhibitor de fosfo-kinază C. S-a constatat că fosfo-kinaza C este implicată în internalizarea receptorului ALX prin endocitoză mediată de caveolin care implică și plute lipidice. Lipoxinele induc fagocitoza celulelor apoptotice prin rearanjarea filamentelor de actină. Interiorizarea ALX/FPR2 în plute lipidice ar putea contribui direct la rearanjarea actinei și ar ajuta la fagocitoză.39,40
Rolul lipoxinelor la locul inflamației
Neutrofilele joacă un rol vital în răspunsul imun înnăscut împotriva infecțiilor.41 Recrutarea la timp a neutrofilelor la locul inflamației urmată de eliminarea lor ajută la rezolvarea inflamației.42,43 Lipoxinele ajută la migrarea neutrofilelor la locul inflamației prin creșterea citosolică a acestora. nivelurile de calciu (Ca 2+ ).44 O creștere a Ca 2+ favorizează asamblarea elementelor cito-scheletice, care ajută neutrofilele să-și prelungească pseudopodele și să inițieze migrația transendotelială. patogen particular. Echilibrul ciclului de viață al neutrofilelor este esențial pentru a evita deteriorarea țesuturilor.46 Întârzierea apoptozei neutrofilelor este una dintre cauzele majore ale bolilor, cum ar fi sindromul respirator acut47 și cancerul.48 Lipoxinele ajută, de asemenea, la eliminarea neutrofilelor de la locul infecției și la rezolvarea problemelor. inflamația.
Macrofagele sunt recrutate la locul infecției după neutrofile. Macrofagele sunt necesare pentru fagocitarea celulelor moarte și a agenților patogeni la locul infecției și o creștere a supraviețuirii macrofagelor facilitează eliminarea infecției/inflamației.58 Lipoxinele promovează, de asemenea, rezolvarea inflamației prin întârzierea apoptozei macrofagelor. Lipoxinele stimulează o activare rapidă a fosfatidilinozitol-4, 5-bisfosfat 3-kinazei (PI3K)/Akt și a kinazei extracelulare reglate cu semnal (ERK)/factorului nuclear ca 2 (Nrf2) căi care au un rol relevant în inhibarea apoptozei în macrofage (Figura 2) .59
Răspunsul imun adaptiv excesiv poate duce la inflamații, leziuni tisulare și boli autoimune.60 Scăderea producției de anticorpi după inflamație și scăderea producției de anticorpi împotriva autoantigenelor sunt vitale în rezolvarea inflamației și prevenirea bolilor autoimune.61 Un studiu realizat de Ramon et al arată că lipoxina A4, prin receptorul său ALX/FPR de pe suprafața celulei B, scade producția și proliferarea anticorpilor de celule B din memorie.62 În plus, citokinele secretate de celule T, cum ar fi factorul de necroză tumorală alfa (TNFα), care promovează inflamația și boli precum deoarece artrita și bolile inflamatorii intestinale pot fi inhibate de lipoxină.63 Prin urmare, lipoxinele, epi-lipoxinele și ALX pot oferi noi oportunități de a concepe noi terapii „orientate spre rezoluție”, care ar putea controla în mod eficient inflamația.
Activarea ALX mediată de lipoxină s-a dovedit că inhibă semnalizarea fosfolipazei D (PLD) și generarea de anioni superoxizi. Dintre acestea, activitatea PLD a fost raportată a fi reglată prin semnalizarea poliizoprenil fosfatului (Figura 2), care acționează ca un comutator de semnalizare „stop” pentru ATL A4.64 PLD catalizează conversia fosfatidilcolinei în fosfatidat și colină și joacă un rol cheie în creșterea celulară, proliferarea, metastaza, transformarea celulelor, angiogeneza și ținta mamiferelor de semnalizare rapamicină, trafic vezicular și endocitoză.65 PLD reprezintă o țintă potențială pentru dezvoltarea rațională a terapiei împotriva cancerului și a bolilor legate de inflamație.
Lipoxine și factori de transcripție
Se cunosc multe despre căile de semnalizare ale lipoxinelor și mecanismul lor de acțiune pentru a rezolva inflamația; cu toate acestea, acțiunea lor asupra factorilor de transcripție implicați în inflamație este încă de explorat. NFκB și AP-1 joacă un rol important în controlul expresiei mai multor gene implicate în inflamație, cum ar fi selectina E, TNFα, IL-8 și IL-1β.66 Superoxidul și oxidul nitric eliberat la locul leziunii reacționează la formare ONOO stabil.54 ONOO crește acumularea nucleară de factori de transcripție precum NFκB și AP-1 favorizând inflamația.56 Lipoxinele și epi-lipoxinele inhibă formarea ONOO la locul inflamației și atenuează acumularea de NFκB și AP-1 în nucleu.
Lipoxinele controlează, de asemenea, expresia genei de răspuns 1 de creștere timpurie (EGR1). EGR1 este activat în celulele T stimulate de antigen. EGR1 controlează transcrierea citokinelor pro-inflamatorii IL-2 și TNFα în celulele T.67 În afară de creșterea nivelului de citokine pro-inflamatorii, EGR1 crește, de asemenea, expresia nucleară a NFκB și AP-1 și contribuie la formarea și inflamația tumorii.68 Represorul transcripțional NAB1 reglează în jos expresia EGR1.69 Studiile arată că la neutrofile, lipoxinele reglează în sus expresia NAB1 și acest lucru ajută la reducerea nivelurilor de EGR1 și la controlul inflamației (Figura 2) .70
Receptorul gamma activat prin proliferator de peroxisom (PPARγ) este un factor de transcripție care reglează în jos inflamația.71 S-a demonstrat că prezența lipoxinelor crește nivelul genelor PPARγ și ale lipocalinei asociate cu gelatinaza neutrofilă (NGAL). Inflamarea cronică la nou-născuți este legată de afectarea activității lipoxinei la neutrofile și reducerea expresiei PPARγ.72 PPARγ se leagă de gena țintă NGAL exprimată în țesuturile care sunt expuse la microorganisme și promovează apoptoza neutrofilelor.73
Nrf2 este un factor de transcripție care reglează expresia elementului de răspuns antioxidant, care este implicat în producerea de antioxidanți și enzime de detoxifiere.74 Nrf2 este extrem de exprimat în macrofage activate, glande tiroide și organe de detoxifiere, cum ar fi ficatul, rinichii și plămânii. .75 Un studiu a arătat că în timpul etapei de rezoluție a inflamației, există o cantitate crescută de 15-deoxi prostaglandină J2 (15-dPGJ2) găsită la locul inflamației.76 Un studiu realizat de Itoh și colab. A arătat că 15-dPGJ2 inhibă acumularea nucleară de NFκB și AP-1, activează PPARγ pentru a regla căile pro-inflamatorii și activează, de asemenea, Nrf2. Nrf2 activat inhibă inducția mediată de TNFα a moleculei de adeziune a celulelor vasculare, care este importantă pentru recrutarea monocitelor la locul inflamației.77 Lipoxinele joacă un rol important în rezolvarea inflamației prin activarea Nrf2 și întârzierea apoptozei macrofagelor.59
Lipoxinele și relevanța lor clinică
Această secțiune prezintă o discuție cu privire la relevanța clinică a lipoxinelor, în special legată de inflamația care apare în bolile renale, tractul respirator, cancerul, bolile neurodegenerative și infecțiile virale.
Boli renale și inflamații
Rinichii sunt implicați în eliminarea deșeurilor din sânge, prin urmare primesc un volum mare de sânge pentru purificare. Când rinichiul întâlnește agenți patogeni, există o infiltrare crescută a leucocitelor urmată de inflamație.78 Dacă leziunile și inflamația renală nu sunt rezolvate în timp util, atunci aceasta duce la boli renale cronice și, în cele din urmă, la stadiul final al insuficienței renale.79 Lipoxinele inhibă infiltrarea neutrofilelor în rinichii și limitează afectarea țesuturilor.80
Fibroza renală este o manifestare obișnuită a bolii renale cronice.81 Transformarea factorului de creștere (TGF) β1 induce afecțiuni fibrotice ale rinichilor prin reglarea descendentă a mi-ARN let-7c. Când celulele epiteliale sunt pretratate cu lipoxină, se observă o creștere a nivelului de mi-ARn let-7c. let-7c miARN vizează receptorul 1 TGFβ, o componentă vitală a semnalizării TGFβ1 care este reglată în sus în fibroza renală.82
Lipoxinele și epi-lipoxinele s-au dovedit a fi eficiente în tratamentul modelului de șoarece cu insuficiență renală acută.83 Șoarecii cu insuficiență renală atunci când sunt tratați cu lipoxine au un nivel crescut de supresori ai ARNm de semnalizare a citokinelor (SOCS-1, 2) .84 SOCS se leagă de Janus kinază și alți receptori ai citokinelor pentru a suprima acțiunea citokinelor și a reduce inflamația.85 Împreună, aceste studii susțin conceptul de tratare a inflamației legate de rinichi prin lipoxine.
Cancer și inflamație
Boli ale tractului respirator și inflamații
Astmul este o boală inflamatorie obișnuită a obstrucției căilor respiratorii cauzată de metabolismul defect al acidului arahidonic. Scăderea semnificativă a hiper-reacției și inflamației căilor respiratorii104 Pe lângă astm, boala pulmonară obstructivă cronică este o altă boală a inflamației căilor respiratorii asociată cu expunerea pe termen lung a plămânilor la iritanți precum fumul de țigară și alți poluanți găsiți în aer. În boala pulmonară obstructivă cronică, există o supraexpresie a proteinei C reactive și a SAA.105 Proteina C reactivă și SAA se leagă de ALX pentru a promova inflamația și a inhiba semnalizarea lipoxinei.106 Dacă lipoxinele sunt prezente în cantități suficiente, atunci poate preveni legarea SAA de ALX/FPR2, ajutând astfel la rezolvarea inflamației
Programul 3 de cercetare a astmului sever desfășoară în prezent un studiu clinic la Boston Children's Hospital și Brigham and Women’s Hospital pentru a înțelege modul în care corticosteroizii utilizați în tratamentul astmului afectează producția de lipoxine.
Boli neurodegenerative
Leziunile cerebrale traumatice provoacă perturbarea barierei hematoencefalice și inflamații, care ar putea duce la moarte. Sa constatat că tratamentul cu lipoxină într-un model de leziuni cerebrale traumatice reduce scăderea barierei hematoencefalice și volumul leziunilor. Lipoxinele inhibă activarea căilor kinazei terminale ERK și Jun-N și controlează inflamația prin reducerea secreției de citokine proinflamatorii precum TNFα, IL-1β și IL-6.113 Aceste studii evidențiază potențialul utilizării lipoxinelor în tratamentul bolilor neurodegenerative care afectează creierul și măduva spinării.
Infecții virale
Virusul gripal H5NI provoacă un răspuns imun sever la om.114 Virusul gripal H5NI provoacă un răspuns inflamator susținut și inhibarea răspunsurilor antiinflamatorii mediate de lipoxină. Două gene antiinflamatorii principale: arahidonatul 5-lipoxigenazei (ALOX5), o genă responsabilă pentru sinteza lipoxinelor și o genă care codifică SOCS-2 au fost reglate în jos la infecția virală. Pe de altă parte, mai multe gene implicate în citokinele pro-inflamatorii precum TNFα și interferon-γ s-au dovedit a fi reglate în sus.115 Sunt necesare studii suplimentare pentru a înțelege influența căii anti-inflamatorii a lipoxinelor și a patogenezei H5N1.
Virusul sincițial respirator provoacă infecții ale tractului respirator inferior prin infectarea macrofagelor pulmonare și a celulelor epiteliale.116,117 Există două tipuri de macrofage care joacă un rol important în timpul infecției cu virusul sincițial respirator - macrofage activate clasic și macrofage activate alternativ. În stadiile inițiale ale infecției, macrofagele activate clasic stimulează producția de COX-2.118 proinflamatoare. cum ar fi IL-10, lipoxina și rezolvele.119 Un studiu arată că atunci când se activează calea antiinflamatorie LO, acestea promovează diferențierea macrofagelor activate alternativ și ajută la rezolvarea hiperreactivității căilor respiratorii. Închiderea căii COX-2 a fost propusă ca un mecanism de promovare a activității LO și rezolvarea patogeniei pulmonare.118.120
Epstein - Bar virus (EBV) este un virus herpes uman care a fost detectat în diferite limfoame, 121-123, de obicei în faza latentă.124 Trecerea de la ciclul latent la cel litic duce la distrugerea celulelor tumorale și, de asemenea, declanșează imunitatea răspuns.125 NFκB, un factor de transcripție care joacă un rol important în inflamație, este activat constitutiv în mai multe tipuri de cancer.126.127 Proteinele de membrană latentă codificate de EBV suprimă ciclul litic128 și, de asemenea, reglează în sus expresia NFκB.129-132 Un studiu arată că tratamentul cu aspirină pe limfomul EBV-pozitiv a scăzut translocarea nucleară a NFκB și promovează ciclul litic. Aspirina ar putea fi utilizată în combinație cu alte medicamente anticanceroase pentru tratarea eficientă a limfoamelor EBV-pozitive
Un alt virus herpes uman numit virus herpes asociat cu sarcomul Kaposi (KSHV) este un virus herpes gamma asociat cu sarcomul Kaposi (KS), limfom primar de revărsare (PEL) și boala multicentrică Castleman.134-138 Activarea constitutivă a NFκB a fost observată în Celulele PEL infectate cu KSHV în comparație cu celulele limfomului cu celule B neinfectate. NFκβ s-a dovedit a fi esențial pentru supraviețuirea și proliferarea KSHV; prin urmare, inhibitorii NFκβ sunt importanți pentru tratamentul KS și PEL.139.140 Inhibitorii NFκB aparțin a trei categorii funcționale: inhibarea degradării proteazomale a IκB, inhibarea fosforilării IκB și inhibarea translocației NFκB în nucleu. Aspirina este un inhibitor NFκB, care blochează fosforilarea IκB. Un studiu care utilizează inhibitorul de fosforilare Iκβ Bay11-7082 a arătat rezultate promițătoare în apoptoza celulelor infectate cu KSHV.139, 140 Acest lucru sugerează utilizarea potențială a inhibitorilor NFκB pentru tratamentul KS.139.
Studii multiple au arătat că căile pro-inflamatorii sunt reglate în sus la infecția cu KSHV.141-149 celulele KS prezintă o creștere semnificativă a proteinelor inflamatorii precum COX-2, Prostaglandin E2 și 5-LO.141-149 Studiile noastre anterioare arată că utilizarea de inhibitori COX-2 ajută la țintirea PEL și ameliorează patogeneza KS a KS.141-149
Concluzie
Mulțumiri
Mulțumim cu recunoștință profesorului Bala Chandran și Keith Philibert pentru sugestii și pentru citirea critică a manuscrisului. Autorii sunt recunoscători fondurilor inițiale ale Universității de Medicină și Știință Rosalind Franklin, premiul Schweppe scholar și grantul American Cancer Society-Illinois (279196) pentru sprijinul activității lor legate de acest subiect.
- Infecția sau inflamația legăturii dintre bolile parodontale și cardiovasculare Cardiologia viitoare
- Motivația intrinsecă vs extrinsecă Ghidurile naturii secundare
- Capsule de ciulin de lapte Extract de semințe foarte concentrat 900mg - ficat C; Natură; cu Nutriție
- Cum Cat; Gheara funcționează pentru a ușura durerea, inflamația - extinderea vieții
- Dieta Nadia Khan pentru scăderea în greutate (încercare gratuită) Echilibrul naturii și scăderea în greutate Tls Scăderea în greutate