Subiecte
Abstract
Paladiul, un material plasmonic aproape în infraroșu a fost recunoscut pentru utilizarea sa în terapia fototermală ca alternativă la nanomaterialele de aur. Cu toate acestea, aplicația sa potențială nu a fost explorată bine în aplicațiile biomedicale. În studiul de față, nanoparticulele de paladiu au fost sintetizate și suprafața particulelor a fost modificată cu succes cu oligozaharidă chitosanică (COS), ceea ce a îmbunătățit biocompatibilitatea particulelor. Mai important, particulele au fost funcționalizate cu peptida RGD, ceea ce îmbunătățește acumularea de particule în celulele cancerului de sân MDA-MB-231 și are ca rezultat efecte terapeutice fototermale îmbunătățite sub un laser de 808 nm. Nanoparticulele de paladiu acoperite cu COS legate de peptide RGD (Pd @ COS-RGD) au o bună biocompatibilitate, dispersie a apei și stabilitate coloidală și fiziologică. Ei distrug tumora în mod eficient sub iluminare laser de 808 nm la 2 W cm -2 densitate de putere. Mai mult, Pd @ COS-RGD oferă o amplitudine bună a semnalelor fotoacustice, ceea ce facilitează imagistica țesuturilor tumorale utilizând un sistem de tomografie fotoacustică neinvazivă. În cele din urmă, fabricatul Pd @ COS-RGD acționează ca un agent nanoterostatic ideal pentru imagistica îmbunătățită și terapia tumorilor utilizând un laser neinvaziv în infraroșu apropiat.
Introducere
Agenții teranostici ne vizați reduc eficiența terapeutică prin acumularea nespecifică în alte țesuturi. Există două mecanisme posibile pentru a îmbunătăți selectivitatea tumorală a nanoparticulelor: (i) direcționarea pasivă prin reținerea îmbunătățită a permeabilității și (ii) direcționarea activă bazată pe un receptor specific de suprafață celulară cu un ligand pe nanoparticulele 17. Integrinele, proteine heterodimerice de adeziune celulară implicate în multe mecanisme, inclusiv atașamentul celular, angiogeneza și metastaza tumorilor solide, au fost identificate pentru direcționarea activă a țesutului tumoral în traseele clinice 18. Dintre diferitele tipuri de integrină, integrinele alfaV beta3 (αvβ3) sunt recunoscute ca ținte terapeutice promițătoare, deoarece sunt supraexprimate în timpul proliferării celulelor tumorale 19. În lucrarea de față, am funcționalizat Pd NPs cu un motiv RGD (acid arginină-glicină-acid aspartic) care se poate lega de integrinele αvβ3 de pe suprafața celulei și, eventual, poate mări reglarea agentului fototerapeutic la locul tumorii.
Chitosanul este un polimer natural, biodegradabil, netoxic, cationic, utilizat pe scară largă în industria farmaceutică, cosmetică și în industria alimentară 20. Chitosanul este obținut în mare parte din chitina învelișului crustaceului și este compus din d-glucozamină legată de β-1,4. În forma sa nativă, chitosanul are o solubilitate redusă în mediu apos fără acid, ceea ce și-a restricționat aplicarea în domeniul farmaceutic. În ultimii ani, studii intensive au condus la dezvoltarea unei oligozaharide chitosanice (COS) cu greutate moleculară mică și solubilă în apă din chitosan. Datorită proprietăților sale unice, COS a devenit un candidat excelent pentru diferite aplicații biomedicale, inclusiv administrarea de medicamente, livrarea genelor și ingineria țesuturilor 21. În lucrarea de față, suprafața Pd NPs a fost modificată cu un polimer COS (Pd @ COS NPs), care conferă biocompatibilitate și permite funcționalizarea în continuare cu alte molecule de interes prin chimia convențională de cuplare utilizând grupările amină și hidroxil prezente în polimer.
Cancerul de sân, unul dintre cele mai frecvente tipuri de cancer în rândul femeilor, duce la deces la nivel mondial datorită rezistenței terapeutice la chimioterapia tradițională 22. Cancerul de sân triple-negativ (TNBC) este un subtip de cancer de sân care se caracterizează prin expresia negativă a receptorului 2 de progesteron, estrogen și factor de creștere epidermic și poate fi metastazat agresiv 23. TNBC reprezintă 10-15% din cancerele de sân, iar pacienții cu acest subtip de cancer au rezultate slabe cu chimioterapia clinică. Linia celulară TNBC MDA-MB-231, care a fost caracterizată pentru expresia pozitivă 24 a integrinei αvβ3, care a fost aleasă ca model de linie celulară pentru a studia capacitatea de țintire a peptidelor RGD conjugate NP în prezentul studiu.
În lucrarea de față am sintetizat Pd NP biocompatibile acoperite cu COS și le-am funcționalizat cu peptidă RGD (Pd @ COS-RGD) pentru acumularea eficientă în celulele cancerului mamar. Mai mult, ablația fototermală pe bază de NIR și eficiența imagistică PAT a particulelor formulate au fost examinate folosind in vitro și in vivo modele.
Rezultate si discutii
Sistemul nanoparticulelor
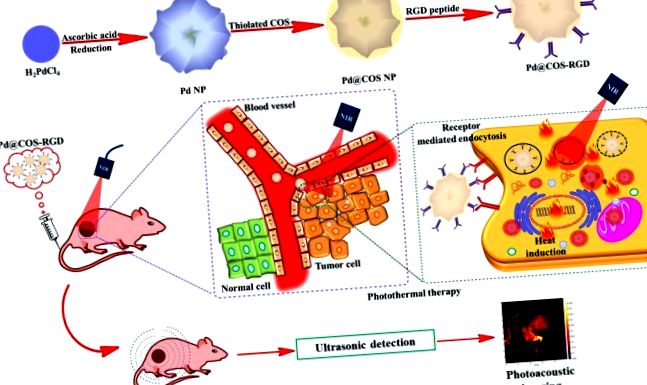
Nanostructurile de paladiu au fost recunoscute în câmpurile biomedicale pentru proprietățile lor optice și catalitice remarcabile. Pregătirea ușoară a Pd NPs și modificarea treptată a suprafeței cu peptida COS și RGD sunt prezentate în Fig. 1a și Fig. S1. În primul rând, COS tiolat a fost acoperit pe suprafața Pd NPs prin abordări de schimb de ligand pentru a obține Pd @ COS NPs. În al doilea rând, anhidrida maleică a fost conjugată pe suprafața Pd @ COS NPs prin reacția de deschidere a inelului. Grupările anhidridă maleică pot reacționa cu grupările hidroxil (-OH) și amino secundare (-NH) prezente în unitățile polimerice COS pentru a produce grupări „ene” (Pd @ COS-COOH NPs). În cele din urmă, unitățile ciclice de peptidă RGD au fost conjugate cu succes pe Pd @ COS-COOH NPs folosind „chimia clicului tiol-ene” prin reacția dintre grupările tiol ale peptidei RGD și partea „ene” a Pd @ COS-COOH NPs pentru a obține Pd @ COS-RGD, care este produsul final (Fig. S1). Acumularea mediată de receptor de Pd @ COS-RGD în celulele tumorale și aplicația lor în mod dual pentru imagistica PTT și PAT sunt prezentate în Fig. 1b.
(A) O schemă care arată prepararea Pd NPs și acoperirea ulterioară a suprafeței cu oligozaharidă chitosană thiloated (Pd @ COS NPs) și în final funcționalizarea utilizând peptida RGD (Pd @ COS-RGD). (b) O ilustrare sistematică care arată ablația fototermală și imagistica fotoacustică a țesutului tumoral utilizând Pd @ COS-RGD.
Caracterizarea nanoparticulelor
În prezentul studiu, Pd NPs poroase au fost sintetizate urmând un protocol de creștere mediat de semințe într-o soluție apoasă cu clorură de cetiltrimetilamoniu (CTAC) ca agent stabilizant, așa cum este descris de Wang și colab. 25. Spectrul de absorbanță al Pd NPs observat de la UV-Vis la regiunea NIR (Fig. 2a), care califică Pd NPs ca potențial agent fototermic folosind un laser NIR. Figura 2b arată că dimensiunea PN Pd a fost relativ uniformă, cu o formă sferică asemănătoare unei flori care conține structuri poroase. Distribuția mărimii NP-urilor as-sintetizate a scăzut între 18 și 26 nm, cu o dimensiune medie de 22,26 ± 0,97 nm (Fig. S2a). Analiza prin difracție de electroni de suprafață selectată (SAED) arată natura cristalină a particulelor sintetizate (Fig. 2b). Franjurile de rețea detectate în modelul SAED [(111), (200), (220) și (311)] dezvăluie planurile cristaline ale Pd NPs. În plus, modelul XRD al Pd NPs sintetizate prezintă vârfuri la 40,1 °, 46,5 ° și 68,3 °, care corespund planurilor cristaline (111), (200) și (311) (Fig. 2c), susținând natura cristalină a Pd NPs (JCPDS nr. 46-1043). Intensitatea maximă la 40,1 ° (111) a fost cea mai intensă, în comparație cu alte vârfuri de reflexie, care pot reflecta direcția preferată a creșterii nanocristale 26 .
(A) Spectrul de absorbanță UV-Vis al Pd NPs, Pd @ COS NPs și Pd @ COS-RGD dispersate în apă. (b) Imagini TEM ale Pd NP cu modificări diferite împreună cu modelele SAED. (c) Modelele de difracție cu raze X (XRD) în intervalul 2θ 20–80 ° din Pd NPs inițiale și Pd final @ COS-RGD. (d) Spectrul FTIR de Pd NPs liofilizate, Pd @ COS NPs și Pd @ COS-RGD.
Modificarea suprafeței Pd NPs cu COS
Pd @ COS-RGD NPs au prezentat o stabilitate excelentă pe termen lung în medii apoase timp de cel puțin 6 luni. Nu s-a observat nicio modificare semnificativă a poziției benzii plasmonice de suprafață în timpul depozitării pe termen lung în apă (Fig. S3a). A arătat că Pd @ COS-RGD a fost stabil și nu s-a găsit nicio agregare într-o soluție apoasă. Agregarea particulelor dă naștere la benzi de plasmoni cuplate la lungimi de undă 31 mai mari; cu toate acestea, aceste benzi nu au fost observate (Fig. S3a). Dimensiunea particulelor a rămas aceeași și nu s-a observat nicio floculare în timpul depozitării pe termen lung în apă distilată (fig. S3b). Pd @ COS-RGD a avut o bună stabilitate coloidală în diferite soluții fiziologice (Fig. S3c), ceea ce este în concordanță cu rapoartele conform cărora modificările COS au stabilitate coloidală 32 .
Analiza termogravimetrică a fost efectuată pentru a examina acoperirea unităților polimerice COS și conjugarea ulterioară a unităților peptidice RGD pe Pd NPs. Așa cum se arată în FIG. S3d, toate probele prezintă o pierdere în greutate inițială de aproximativ
6,2% în greutate La temperaturi de 100-170 ° C datorită solventului fizic absorbit sau umezelii. În plus, a doua pierdere în greutate de aproximativ
16,5% în greutate Pentru Pd NPs indică descompunerea CTAC prezentă pe Pd NPs (Fig. S3d). În contrast, Pd @ COS NPs acoperite cu COS și alte Pd @ COS-RGD NP conjugate cu peptide RGD prezintă o pierdere colectivă în greutate de aproximativ
38% în greutate În intervalul de temperatură cuprins între 180 și 460 ° C, indicând faptul că suprafața Pd NPs a fost acoperită cu polimer COS (Fig. S3d). Cu cât mai departe
8% în greutate Pierderea Pd @ COS-RGD a indicat descompunerea polimerului COS conjugat cu peptidă RGD (Fig. S3d). Datele termogravimetrice au arătat că o cantitate considerabilă de unități peptidice COS și RGD au fost încorporate în Pd @ COS-RGD.
Efect de încălzire fototermic
(A) Curba de încălzire a Pd @ COS-RGD (50 ppm) dispersată în 1 ml de apă și iradiată cu un laser de 808 nm la diferite densități de putere. (b) Curbele termice ale Pd @ COS-RGD la diferite concentrații sub iluminare laser 808-nm la 2 W cm −2 densitate de putere. (c) Stabilitatea termică a Pd @ COS-RGD (50 ppm) pe parcursul a 5 cicluri ale unui experiment de pornire/oprire laser la 2 W cm −2 densitate de putere. (d) Spectru de absorbanță optică a Pd @ COS-RGD înainte și după 5 cicluri ale unui experiment de pornire/oprire laser.
Au fost utilizate experimente cu pornire/oprire laser pentru a studia fotostabilitatea Pd NP-urilor. O soluție apoasă (1 ml) conținând 50 ppm (Pd) de Pd NPs a fost iradiată timp de 5 cicluri de pornire/oprire experiment folosind un laser de 808 nm (2 W cm -2). Pentru fiecare ciclu, soluția a fost iradiată timp de 5 minute și soluția a fost lăsată să se răcească la temperatura camerei în mod natural. Modificările de temperatură înregistrate pentru întregul ciclu 5 sunt prezentate în Fig. 3c. Pd NPs au prezentat stabilitate termică consistentă, ajungând la 53 ° C după 5 minute de iradiere cu laser pentru fiecare ciclu repetat. Spectrul de absorbanță al Pd NPs a fost măsurat după experimentul de pornire/oprire laser. Spectrul soluțiilor Pd NPs nu a prezentat diferențe semnificative înainte și după iradiere (Fig. 3d). Comparativ cu nanostructurile de aur și argint, nanostructurile Pd au fost raportate ca fiind cele mai stabile traductoare fototermale 7 .
Eficiența conversiei fototermice a Pd NPs a fost comparată cu nanorodurile Au, deoarece Au este NP-urile metalice de referință standard. Densitatea optică atât a Pd NPs, cât și a soluțiilor de nanorod Au au fost ajustate la 1,0 unitate de absorbanță la 808 nm. Apoi soluțiile au fost iradiate cu laser 808-nm la 2 W cm -2 densitate de putere timp de 5 min și temperatura a fost lăsată să se răcească în mod natural. Curba termică comparativă este prezentată în Fig. S5. După cum se vede în Fig. S5, profilele termice ale Pd NPs și Au nanorods au fost destul de comparabile. Huang la al. a raportat că nanofițele Pd servesc ca un agent fototermic eficient, cu o eficiență de conversie termică de 93,4%, care este comparabilă cu nanorodurile 36. Nanoparticulele metalice utilizate în mod obișnuit, cum ar fi fierul, aurul, argintul și platina, au fost studiate pe larg cu diferite modificări ale suprafeței, iar unele dintre ele au fost utilizate în studiile clinice 37. Numărul de studii privind utilizarea Pd NPs ca agenți teranostici este rar și nu există niciun studiu privind acumularea țintită de Pd NPs în țesuturile tumorale.
Biocompatibilitatea PN
Acumularea sporită de Pd @ COS-RGD
In vitro citotoxicitate fototermală
Înaintea in vivo studiu, efectul citotoxic fototermic al Pd @ COS-RGD a fost evaluat în celulele MDA-MB-231 utilizând testul MTT standard. Inițial, toxicitatea fototermală a Pd @ COS-RGD în celulele MDA-MB-231 a fost evaluată folosind un laser de 808 nm la diferite densități de putere. Figura 4C arată o reducere drastică a viabilității celulei depinde de densitatea puterii laserului. Rata mortalității celulare a fost înregistrată ca 22,24, 73,8 și 94,1% la 1, 2 și respectiv 3 W cm -2. În același timp, s-a observat o rată a mortalității celulare de 11,7% în celulele martor tratate la 3 W cm -2 densitate de putere. Eficiența termică a Pd @ COS-RGD NPs a variat foarte mult în funcție de densitatea de putere a laserului de 808 nm (Fig. 4c). În plus, moartea celulară a fost mai mică la 1 W cm -2 comparativ cu 2 W cm -2 la tratamentul cu NPs. Deoarece temperatura a atins 41 ° C în 2 minute și a crescut la 52 ° C la 5 min (Fig. 3a), s-a observat moartea substanțială a celulei (73,32%) la 2 W cm -2 densitate de putere. Densitatea de putere de 2 W cm -2 a fost aleasă ca densitate de putere optimă pentru alte experimente. În acest caz, s-a realizat o activare drastică în moartea celulară prin creșterea temperaturii peste 48 ° C timp de câteva minute în timpul tratamentului și a fost considerată ca moarte celulară eficientă și nereversibilă.
Moartea celulelor apoptotice induse de PTT a fost examinată în continuare prin citometrie în flux după 8 ore de tratament cu laser. Celulele tratate cu PTT au fost dublu colorate cu FITC-anexină V și PI, apoi s-a efectuat analiza FACS. Rezultatele au arătat că o mare parte din celulele expuse la laser Pd @ COS-RGD + au suferit apoptoză timpurie (49,1%); simultan, unele celule au progresat către faza tardivă de apoptoză/necroză (12,5%) (Fig. S8b). Am recunoscut că majoritatea celulelor din grupurile de control, control cu laser și NP (aproximativ 98,4, 92,7 și respectiv 95,2%) au fost reprezentate grafic în starea activă (Fig. S8b). Prin urmare, Pd @ COS-RGD a exercitat daune evidente celulelor MDA-MB-231 atunci când a fost iradiată cu lumină laser 808-nm la 2 W cm -2. În total, rezultatele in vitro Studiul sugerează că Pd @ COS-RGD posedă un potențial mare de toxicitate fototermală activată prin NIR prin acumularea sporită în celulele MDA-MB-231.
In vivo Biodistribuirea
A explora in vivo acumularea tumorii, Pd @ COS NPs și Pd @ COS-RGD au fost livrate la șoarecele MDA-MB-231 stabilit prin tumora prin injectarea venei cozii. Tumora șoarecilor a fost disecată la 1, 12 și 24 de ore după injectarea particulelor și țesutul tumoral a fost lizat cu aqua regia pentru a măsura particulele Pd prin analiza ICP-MS. Figura 5a arată că Pd @ COS-RGD funcționalizat RGD a fost adăpostit în tumoare cu mult decât Pd @ COS NPs la toate intervalele de timp. Rata de acumulare mai mare a avut loc la 1 oră după injectarea venei cozii.
In vivo PTT
Termograf cu infraroșu al șoarecilor goi purtători de tumori mamare MDA-MB-231 iradiate cu laser de 808 nm la 2 W cm -2 după 1 oră de injectare intravenoasă de PBS și Pd @ COS-RGD.
- Nanoparticule de Fe (NH2 - trz) 3 Br2⋅3 H2O (NH2 - trz 2 - Amino - 1,2,4 - triazol) Preparate de revers
- Îmbunătățirea imunității bărbie, pierderea în greutate Chitosan Chitin Capsule moi - China Detoxifierea, uscată
- Pierde grăsimea burtică rapidă Chitosan Oprește grăsimea de a fi absorbită - Naturalexis
- Echilibru natural Chitosan original
- Nanoparticulele plus celulele stem adulte demolează placa, descoperă studiul - ScienceDaily