Petr Sarapultsev
* Institutul de Imunologie și Fiziologie (IIP) al Diviziei Ural ale Academiei de Științe din Rusia
Oleg Chupakhin
† Institutul I. J. Postovsky de sinteză organică a ramurii urale a RAS, Laboratorul compușilor heterociclici
Alex Sarapultsev
* Institutul de Imunologie și Fiziologie (IIP) al Diviziei Ural ale Academiei de Științe din Rusia
Maxim Rantsev
‡ GOU VPO Academia medicală de stat din Ural
Larisa Sidorova
§ Instituția educațională autonomă de stat federal pentru învățământul profesional superior, Universitatea Federală din Ural numită după primul președinte al Rusiei B. N. Elțîn
Svetlana Medvedeva
* Institutul de Imunologie și Fiziologie (IIP) al Diviziei Ural ale Academiei de Științe din Rusia
Irina Danilova
* Institutul de Imunologie și Fiziologie (IIP) al Diviziei Ural ale Academiei de Științe din Rusia
Abstract
Progresele în îngrijirea pacienților cu cardiologie au dus la o scădere a ratelor mortalității spitalicești la pacienții cu infarct miocardic acut (IMA). Cu toate acestea, incidența persistentă la nivel mondial a bolilor de inimă ischemice susține interesul pentru patogeneza și istoria naturală a leziunilor miocardice (Drapkina și colab. 2000; Arzamastsev și colab. 2003; Saprunova și colab. 2003; Golikov, 2004), deoarece acest lucru poate ajuta în dezvoltarea de noi forme de tratament mai eficiente.
În prezent, tratamentul pentru leziuni cardiace ischemice se bazează pe simulări pe acțiunile mecanismelor antistresor naturale și anti-ischemice. Administrarea metaboliților sau a analogilor lor sintetici care afectează diferite părți ale lanțului patogenetic (Meyerson 1984).
Astfel, în conformitate cu Ghidurile Task Force ale Societății Europene de Cardiologie (2000) și Ghidurile rusești ulterioare (2001), tratamentul pentru IM dezvoltat ar trebui să se bazeze pe utilizarea beta-blocantelor, a nitraților, a blocantelor canalelor de calciu și a agenților antiplachetari aspirină., tienopiridine, antagoniști ai receptorilor glicoproteinei IIb/IIIa din trombocite). Cu toate acestea, aceste medicamente nu afectează nici țesutul, nici procesul inflamator tisular sistemic asociat cu IM (Smith și colab. 1977).
Reacția inflamatorie este o componentă nu numai a ischemiei, ci și a leziunii de reperfuzie a miocardului, contribuind astfel la răspândirea zonei necrotice (Tommasi și colab. 1999). În plus, modelul de formare a necrozei poate duce la provocarea remodelării anormale a ventriculului stâng în IM (Chukaeva și colab. 2007). Mai mult, reducerea dimensiunii cicatricilor este asociată cu prevenirea undelor secundare de necroză miocardică (Sarkisov, 1979).
O serie de studii recente au susținut această opinie. Activarea efectorilor celulari ai inflamației are un efect negativ asupra funcției miocardice în IMA (Engler și colab. 1986; Kuzuya și colab. 1991). Dimensiunile zonei de infarct se corelează cu indicatorii de răspuns în fază acută (Myagkov și colab. 1993). Prin urmare, nivelurile scăzute de bază ale CRP sunt asociate cu un prognostic mai favorabil timp de șase luni după MI (Hudson și colab. 1999). Rolul reacției inflamatorii în IM este confirmat în continuare de faptul că îndepărtarea neutrofilelor din sânge sau adăugarea de agenți care inhibă infiltrarea leucocitelor au contribuit la reducerea dimensiunilor zonei de infarct în studiile pe animale (Engler și colab. 1986; Dinerman și colab. 1990). Prin urmare, obiectivul prezentului studiu a fost investigarea efectelor compusului L-17 al grupului de 5R1, 6H2-1,3,4-tiadiazin-2-amine substituite, cunoscute ca având efecte asupra miocardului, asupra infiltrație celulară și remodelare miocardică după IM acut la șobolani.
Materiale și metode
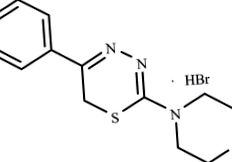
Compusul L-17 din grupul 5R1, 6H2-1,3,4-tiadiazin-2-amine substituit a fost utilizat pentru tratarea MI experimentale la șobolani (Figura 1).
Formula structurală a compusului L-17 din grupul 5R1, 6H2-1,3,4-tiadiazin-2-amine substituite.
Acest compus a fost sintetizat în Institutul de Sinteză Organică, Filiala Urală a RAS, ca parte a unei serii de mai multe substanțe active care afectează metabolismul și inflamația. Compusul este o invenție înregistrată (brevetul SUA nr. 6313111 din 6 noiembrie 2001, brevetul PCT RF nr. 2259371 din 27 august 2005). Alegerea acestui compus se datorează faptului că se știe că compusul L-17 este activ din punct de vedere biologic și se știe că are miorelaxare (brevetul SUA nr. 4309426 din 20 noiembrie 1980), antispasmodic și antiagregator (Novikova și colab. 1992; Logvinova și colab. 2010) de activitate, dar nu a fost încă investigat într-un sistem de model patogenetic in vivo. Constatările în tratamentul MI experimentale au fost, de asemenea, protejate de un brevet (brevetul PCT RF nr. 2395850 din 27 iulie 2010).
Modelul MI acut
Modelarea unui IAM la șobolani a fost efectuată așa cum s-a descris anterior (Brevetul PCT RF nr. 2407062 din 20 decembrie 2010). Această metodă se bazează pe modelarea operativă a IM la șobolani, care se caracterizează printr-o succesiune din pașii următori: pielea este incizată și mușchii expuși pe partea stângă a pieptului; mușchii pectorali sunt răspândiți pentru a expune arcurile costale și mușchii intercostali; mușchii intercostali sunt disecați la nivelul spațiului intercostal 4-5 timp de 1 cm; inima este vizualizată; iar coagularea se efectuează pe o zonă limitată standard a ramurilor arterei coronare stângi în treimea sa medie sau inferioară. Coagularea se realizează cu un instrument în formă de „L’ pentru a da o suprafață cauterizantă de 2,5 × 3,0 mm, preîncălzită folosind o lampă cu alcool care permite vizualizarea clară a inimii în timpul coagulării. Plaga de toracotomie este închisă cu o sutură care rulează folosind un ac atraumatic; pneumotoraxul este eliminat cu ajutorul unei seringi cu ac; iar incizia cutanată este închisă. Această metodă crește probabilitatea unui rezultat pozitiv (adică un IMA), reducând în același timp timpul operativ și mărind timpul pentru experimentul în sine. În plus, această metodă nu tulbură ritmul cardiac și nici nu provoacă aritmii asociate cu un efect de curent electric.
În decurs de 10 minute după modelarea infarctului, reacțiile comportamentale ale animalelor revin complet la nivelul preoperator. Nu s-au înregistrat decese. Evaluarea comportamentului animalelor la 24 de ore nu a evidențiat semne de reacții comportamentale anormale: animalele erau active; și reacționează la stimularea sunetului și a luminii fără întârziere.
Pregătirea animalelor
Au fost folosiți șobolani masculi de 12 săptămâni, de rasă aleatorie. Au fost adăpostiți la 23-25 ° C într-un ciclu de lumină - întuneric de 12: 12 ore cu hrană și apă ad libitum.
MI acut a fost indus de coagularea arterei coronare stângi așa cum s-a descris anterior. Șobolanii au fost anesteziați prin injecție intraperitoneală de ketamină (50 mg/kg) și xilazină (10 mg/kg). Au fost intubate și ventilate, iar procedura a fost efectuată așa cum s-a subliniat mai sus. Coagularea a fost efectuată pe zona limitată standard a ramurilor arterei coronare stângi în treimea sa medie sau inferioară. Controalele au fost șobolani care au suferit aceeași operație, dar fără controale au fost coagulare a arterei coronare. Experimentele pe animale au fost aprobate și efectuate în conformitate cu Directiva 86/609/CEE (1986) a Consiliului UE și convenția europeană privind protecția vertebratelor utilizate în scopuri experimentale și în alte scopuri științifice (1990) și ORDINUL Ministerului URSS Sănătatea din 12 august 1977, nr. 755 „Cu privire la măsurile de îmbunătățire a formei organizatorice a utilizării animalelor de experiment”.
Protocol experimental
Au fost studiați 52 de șobolani masculi de rasă aleatorie, cu greutatea de 180-240 g. Experimentele au fost efectuate după cum urmează: animalele cu model experimental MI au fost împărțite în două grupuri, câte 15 șobolani în fiecare grup. Primul grup a inclus șobolani albi care au primit compus L-17 intraperitoneal la o doză de 40 mg/kg la fiecare 24 de ore; al doilea grup a primit soluție de clorură de sodiu intraperitoneală; grupul de control al animalelor intacte fără IMA experimental a inclus 10 șobolani.
Animalele au fost sacrificate pentru studiu în primele, cinci și șapte zile după ce au fost anesteziate cu Aethaminalum-sodiu intraperitoneal la o doză de 40 mg/kg.
La recoltarea inimilor pentru evaluarea histologică ulterioară, observațiile brute în toate cazurile de testare au arătat prezența zonei de infarct distincte în miocard. Nu s-au observat modificări pulmonare și nici revărsături pleurale. Observarea grosieră nu a relevat nicio modificare vizibilă a organelor abdominale (ficat, splină, bucle intestinale) sau alte țesuturi.
Miocardul din toate inimile a fost examinat prin prelevarea de probe atât în zonele miocardice de infarct și peri-infarct, cât și în zonele ventriculare stângi îndepărtate de țesuturile deteriorate. Blocurile de parafină au fost preparate folosind metode standard. Secțiunile în serie (5-6 microni) de 5-6 microni au fost colorate cu hematoxilină și eozină conform Van Gieson și Weigert (Lillie 1977; Bancroft & Stevens 1996).
Pentru analiza biochimică, s-au obținut 3 ml de sânge printr-o puncție cardiacă pentru centrifugarea ulterioară și separarea serului. Activitatea serică a creatin fosfokinazei (CPK), aspartatului aminotransferazei (AST), izoenzimelor 1 și 2 și a lactatului dehidrogenazei (LDH1-2) înainte și în procesul de dezvoltare a MI a fost investigată în același interval de timp.
Testele de sânge de laborator au fost efectuate folosind următoarele dispozitive și sisteme de diagnosticare:
Analizator biochimic „Sisteme de imunochimie” de Beckman Coulter, Inc. (Brea, CA, SUA)
Sisteme de diagnosticare de DSL, Inc. (Webster, TX, SUA)
Spectrofotometru „Multiscan” de Labsystems Ltd. (Helsinki, Finlanda)
Analizor automat „Glycomat DS5” de Drew Scientific Ltd. (Dallas, TX, SUA)
Tolerabilitatea compusului L-17
Tolerabilitatea compusului L-17 la animale a fost estimată ca fiind destul de satisfăcătoare: nu au fost detectate cazuri de reacții dureroase sau modificări necrobiotice la locurile de injectare, nu s-au înregistrat infecții ale plăgii postoperatorii și nu au existat empieme pleurale, cu excepția încetinirii reacțiilor animalelor la sunet și lumină. stimulare care a fost observată în 20-30 min după injecții și a durat 40-45 min înainte ca comportamentul animalelor să nu fie diferit din nou de cel al șobolanilor intacti. Simptomele insuficienței respiratorii sau ale tulburărilor de consum și alimente și băuturi nu au fost de asemenea observate.
analize statistice
tabelul 1
Valorile biochimice ale serului sanguin în cursul IM acut experimental
| CPC (μmol/L-min) | 146,92 ± 22,6 | 234,9 ± 60,1 * | 201,08 ± 28,5 * | 168,54 ± 21,6 * | 103 ± 12,1 † | 248,12 ± 41,5 * | 107,64 ± 19,9 † |
| AST (μmol/L-24 h) | 0,193 ± 0,014 | 0,415 ± 0,033 ** | 0,379 ± 0,022 ‡ * | 0,290 ± 0,05 * | 0,184 ± 0,011 † | 0,288 ± 0,023 * | 0,225 ± 0,024 † |
| LDH1-2 (μmol/L-24 h) | 165,15 ± 34,6 | 515,82 ± 60,1 * | 403,78 ± 38,4 ** | 262,28 ± 22,1 * | 258,08 ± 31,6 * | 346,46 ± 52,9 * | 229,74 ± 60,6 * |
Fiabilitatea diferențelor între animalele intacte și animalele cu un MI experimental: * P ** P † P ‡ P Figura 2). Edemul și plinătatea vaselor endomiziale cu formare de nămol a fost observată în structurile adiacente. Leucocitele polimorfonucleare detectabile în zona de distrugere au fost indicative ale inflamației reactive cu răspuns exudativ. Formarea nămolului de celule roșii din sânge și hemoragiile focale au fost detectate în microvasele din zona perifocală.
Infarct miocardic, ziua 1, fără administrarea preparatului. Zona de necroză (a) este reprezentată de cardiomiocite cu semne de carioliză, plasmoliză și plasmorexie; infiltrare difuză moderată (b) a zonei vătămate cu leucocite segmentate. Colorarea H&E. Mărire × 400.
Modificări semnificative au fost observate nu numai în zona necrozei, ci și în țesuturile adiacente. Aceste modificări au inclus atrofia parțială a miocardiocitelor, reacția distrofică marcată cu edem stromal și pierderea striației transversale și axiale a miofibrilelor (Figura 3).
Infarct miocardic, ziua 1, fără administrarea preparatului. Plinătatea vaselor endomiziale cu formațiuni de nămol. Colorarea H&E. Mărire × 400.
În prima zi postoperatorie în grupul experimental de animale MI tratate cu L-17, zona de infarct a fost mare, focală și a prezentat cardiomiocite cu semne de carioliză, plasmoliză și plasmorexie fără o zonă de demarcare clară. Un număr mic de limfocite au fost prezente în infiltrat. Zona necrotică a fost infiltrată minim (Figura 4).
Infarct miocardic, ziua 1, cu preparat administrat. Zona deteriorată (a) este reprezentată de cardiomiocite cu semne de carioliză, plasmoliză și plasmorexie; infiltrarea difuză moderată (b) a zonei vătămate este mai puțin marcată; infiltratul conține un număr mic de limfocite. Colorarea H&E. Mărire × 400.
În a cincea zi postoperatorie la animalele cu IM experimental netratat, zona necroică a fost caracterizată ca predominant transmurală. Cardiomiocitele necrotice au fost înconjurate de o linie de demarcație; și s-au observat puține semne de formare a țesutului de granulație: fibroblaste și hemocapilare au fugit să apară. Structurile adiacente au demonstrat infiltrarea endomisiei.
În a cincea zi postoperatorie la animalele experimentale cu MI tratate cu compus L-17, zona rănită a fost înlocuită de țesut de granulație reprezentat de fibroblaste, fibre fine de colagen și capilare sinusoidale multiple. Țesutul de granulație a fost infiltrat cu limfocite și macrofage, dar au existat puține leucocite polimorfonucleare.
În a șaptea zi postoperatorie la toate animalele cu IM experimental netratat, zona necrotică din peretele ventricular stâng a fost caracterizată ca transmurală. Au apărut semne histologice ale stadiului de formare (adică formarea țesutului de granulație pe marginile zonei de necroză cu o cantitate mare de fibroblaste, macrofage și hemocapilare sinusoidale care înlocuiesc zona rănită); cu toate acestea, dezintegrarea celulelor musculare și infiltrarea miocardului cu limfocite și leucocite segmentate au persistat. În unele cazuri, marginea cu semne de leucopedeză a fost detectată în vase.
În a șaptea zi postoperatorie la animalele experimentale cu MI tratate cu compus L-17, zona necrotică a fost complet înlocuită cu țesut de granulație, în care hemocapilare multiple de tip sinusoidal, formarea fibrelor fine de colagen, au crescut substanța intercelulară la sol, în care un număr semnificativ de fibroblastele active și macrofagele au fost detectabile. Infiltratul a fost compus din limfocite cu un număr mic de leucocte polimorfonucleare. Semnele edemului interstițial au persistat în zonele miocardice adiacente; vasele endomiziale au fost dilatate și pline.
Discuţie
Prezentul studiu a investigat efectele compusului L-17 al grupului de 5R1, 6H2-1,3,4-tiadiazin-2-amine substituite asupra infiltrării celulare inflamatorii și a remodelării miocardice după IM acut la șobolani.
Studiile de laborator ale efectelor compusului L-17 asupra dezvoltării și evoluției MI experimentale au arătat că administrarea compusului L-17 scade semnificativ nivelul AST și CPK din sânge. Având în vedere datele privind corelația dintre activitatea acestor enzime și dimensiunile zonei necrotice, aceasta permite să se tragă câteva concluzii provizorii despre eficacitatea în tratarea IM.
Constatările histologice la animale cu IM experimentale merită o atenție specială. S-a constatat că compusul L-17 nu numai că scade aria infarctului inițial, ci și că modifică tiparul reacției inflamatorii în miocardul deteriorat fundamental.
Practic, o reducere a cantității de țesut deteriorat ireversibil în sine poate fi un factor major care determină prezentarea clinică a IM și prognosticul său (Golikov, 2004); totuși, după cum sa dovedit, administrarea compusului L-17 duce la înlocuirea inflamației distructive exudative, care este condusă în principal de leucocite polimorfonucleare, cu inflamație productivă celulară caracterizată prin dominarea celulelor mononucleare în infiltrat. Este probabil dezvoltarea inflamației distructive exudative care poate agrava ischemia și reperfuzia leziunii miocardului și poate contribui la răspândirea zonei țesutului necrotic (Tommasi și colab. 1999).
Astfel, studiile efectuate aici au arătat că compusul L-17 oferă o abordare esențial nouă a tratamentului cu MI, ceea ce înseamnă schimbarea modelului reacției inflamatorii în așa fel încât să permită dominanța reacțiilor fiziologice de protecție ale unui corp.
Concluzii
Utilizarea compusului L-17 în MI experimental induce înlocuirea inflamației distructive exudative cu inflamația productivă celulară, ceea ce duce la reducerea zonei necrotice inițiale și la scăderea ischemiei miocardice și a leziunii de reperfuzie și accelerează procesul de reparare.
Mulțumiri
Acest studiu a fost susținut de o subvenție specială de cercetare a proiectului interdisciplinar al Institutului de Imunologie și Fiziologie și Institutul de Sinteză Organică, Filiala Urală a RAS (2009-2011).
- Icter pentru sugari Federația Rusă PDF PPT Rapoarte de caz Simptome Tratament
- Tratamentul infertilității pentru femeile cu PCOS CS Mott Spitalul de copii Michigan Medicină
- Mezoterapie - Tratament pentru mezoterapie -Celulita - Medic cosmetic
- Tratamentul mezoterapiei pentru celulita; Reducerea grăsimii în New York, Westchester; Bronxul
- EFECTE ISTOPATOLOGICE ALE TRATAMENTULUI OZONIC LOCAL ȘI SISTEMIC ÎN MEMBRANA TIMPANICĂ EXPERIMENTALĂ