Subiecte
Abstract
Introducere
La nivel mondial, aproape 60% dintre pacienții cu poliartrită reumatoidă (RA) sunt tratați cu glucocorticoizi (GC) 1. Prednison/metilprednisolon, cel mai frecvent utilizat GC este administrat în asociere cu medicamente antireumatice care modifică boala (DMARD) pentru a oferi un beneficiu clinic mai bun. Cu toate acestea, utilizarea pe termen lung a GC are mai multe efecte adverse metabolice și cea mai proeminentă dintre acestea este osteoporoza și sarcopenia 2,3. Medicamentele utilizate clinic pentru osteoporoza indusă de GC (GIO) sunt anti-resorbtive (bifosfonați și denosumab), în timp ce boala este în primul rând un efect al afectării funcției osteoblaste 4. Deși singurul medicament osteoanabolic, hormonul paratiroidian 1-34 (teriparatidă) umană a demonstrat o eficacitate terapeutică mai mare decât bifosfonații în GIO 5,6,7,8,9,10 acest medicament nu a primit aprobarea pentru utilizare în această indicație de la brevetul SUA . Food & Drug Administration (FDA), lăsând astfel un scop pentru descoperirea unui nou agent de formare a oaselor. Tratamentul GC pe termen lung provoacă și sarcopenie 11. Mușchiul scheletic oferă un semnal pozitiv oaselor prin încărcare biomecanică și sarcopenie pentru care nu există niciun medicament care afectează în continuare sănătatea oaselor.
Cassia occidentalis L. (aparține Caesalpiniaceae familie) este o plantă anuală care este distribuită abundent în zone largi din Asia de Sud și America de Sud. Utilizări tradiționale ale frunzei și tulpinii de C. occidentalis pentru tratamentul fracturilor și a afecțiunilor osoase sunt cunoscute de la sfârșitul secolului al XIX-lea în Puttur, un oraș de recensământ al districtului Chittoor din Andhra Pradesh, un stat sudic al Indiei 12,13. Am arătat recent că o fracțiune butanolică obținută din extractul etanolic de C. occidentalisTulpina S promovează regenerarea osoasă la locul fracturii și protejată împotriva pierderii de masă și rezistență indusă de metilprednison (MP) la șobolani 14. În această privință, fracția butanolică (CSE-Bu) sa dovedit a fi mai puternică decât extractul etanolic. Deși CSE-Bu a oferit o protecție semnificativă împotriva pierderii osoase induse de MP, totuși, aceasta nu a fost completă, lăsând astfel o posibilitate de îmbunătățire a eficacității acesteia.
Fitochimicalele sunt cunoscute pentru biodisponibilitatea lor orală slabă și pentru realizare in vivo eficacitatea unui agent dat, sunt necesare doze mai mari care la rândul său reduc fereastra terapeutică 15. Sistemul de eliberare a medicamentului auto-nano (SEDDS) este o abordare eficientă pentru îmbunătățirea absorbției intestinale a compușilor hidrofobi care sunt prezenți în CSE-Bu, ducând la biodisponibilitatea lor îmbunătățită și la un profil temporal mai consistent al absorbției lor. CSE-Bu conține șase compuși osteogeni, dintre care izovitexina a avut cel mai bun efect osteogen in vitro 14 .
Aici, am dezvoltat un SEDDS de CSE-Bu pe bază de lipide (formulare CSE-Bu denumită în continuare CSE-BuF) pentru a spori absorbția și, prin urmare, biodisponibilitatea compușilor osteogeni prezenți în CSE-Bu. Am studiat apoi farmacocinetica și farmacodinamica CSE-BuF. Mai mult, am studiat efectul CSE-BuF asupra efectului antiinflamator al MP. Apoi, am folosit un model de osteotomie femurală de șobolan pentru a evalua regenerarea osoasă și un model de osteopenie indusă de MP pentru a evalua eficacitatea CSE-BuF și am studiat mecanismul său de acțiune în os. Deoarece MP este, de asemenea, cunoscut pentru a provoca sarcopenie care, la rândul său, contribuie la pierderea osoasă datorită încărcării mecanice reduse, am studiat astfel efectul CSE-BuF asupra impactului MP asupra mușchiului scheletic.
Rezultate
Caracterizarea CSE-BuF și efectul său asupra biodisponibilității orale a compușilor osteogeni
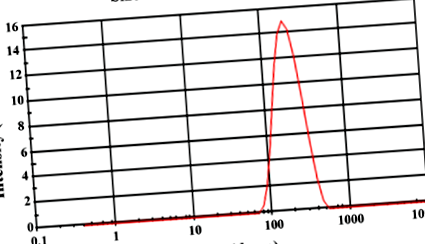
Mărimea globulelor CSE-BuF sa dovedit a fi în intervalul de 100-170 nm de emulsie diluată și potențialul zeta a fost de -28 mV (Fig. 1).
Mărimea globulelor și distribuția mărimii SEDDS după diluare. Dimensiunea medie a globulelor și PDI ale formulării după diluarea 1: 100 în apă distilată sa dovedit a fi de 166,7 d.nm și respectiv 0,186.
Anterior, am izolat cinci compuși osteogeni, inclusiv emodină, luteolină, 3 ′, 4 ′, 7-trihidroxiflavonă (THF), apigenină și izovitexină din CSE-Bu pe baza in vitro teste 14. Dintre acești compuși, emodina și luteolina ar putea fi măsurate în plasmă după administrarea orală unică de CSE-Bu, în timp ce apigenina, izovitexina și THF nu au fost detectabile (Tabelul 1). Cu toate acestea, dozarea orală unică de CSE-BuF a dus la creșteri ale concentrațiilor plasmatice de emodină și luteolină în timpul tratamentului cu CSE-Bu. Comparativ cu CSE-Bu, biodisponibilitatea relativă a emodinei și luteolinei a crescut cu 279% și, respectiv, 36% prin tratamentul cu CSE-BuF. Spre deosebire de CSE-Bu, nivelurile de apigenină, izovitexină și THP au fost detectabile și măsurate în plasma șobolanilor cărora li s-a administrat o doză orală unică de CSE-BuF (Tabelul 1).
CSE-BuF a îmbunătățit efectul regenerator osos
Regenerarea osoasă, evaluată prin marcarea calceinei la locul osteotomiei femurale, a fost comparată între CSE-BuF și CSE-Bu. În comparație cu vehiculul (apa), formularea vehiculului (SEDDS gol fără extract) nu a avut niciun efect asupra etichetării calceinei. La doza de 50 mg/kg, CSE-Bu nu a avut efect, dar CSE-BuF a crescut semnificativ intensitatea medie a calceinei. Evaluarea Micro CT (μCT) a arătat un volum crescut al osului calus (BV/TV) în CSE-BuF comparativ cu grupul CSE-Bu (Fig. 2).
CSE-BuF a prevenit complet efectul osteopenic al MP
Deoarece CSE-BuF în doză de 50 mg/kg a stimulat regenerarea osoasă semnificativă la locul osteotomiei, am testat dacă la această doză ar putea preveni impactul osteopenic al MP. În grupul MP, o scădere semnificativă a greutății corporale (26%) părea să fie contribuită atât de scăderea masei slabe (11%), cât și a grăsimii (40%) comparativ cu martorul. CSE-BuF a prevenit pierderea de greutate corporală indusă de MP, menținând masa slabă și grasă la nivelurile de control (Tabelul 2).
CSE-BuF a protejat complet metafiza femurului (oasele trabeculare), diafiza femurului (osul cortical) și vertebra L5 (osul trabecular) de pierderea indusă de MP (Fig. 3A - C). În metafiza femurului și L5, densitatea minerală osoasă (BMD), volumul osos (BV/TV%) și parametrii microarhitecturali [numărul trabecular (Tb.N), grosimea trabeculară (Tb.Th) și separarea trabeculară (Tb.Sp)] au fost comparabile între grupurile de control și grupurile CSE-BuF (Fig. 3A, B). Indicele modelului de structură (SMI), un indicator al geometriei osului trabecular, a fost, de asemenea, comparabil între aceste două grupuri (Fig. 3A, B). În plus, CSE-BuF a prevenit complet pierderea BMD indusă de MP, grosimea corticală și perimetrul periostal al diafizei femurale (Fig. 3C).
Am efectuat analize de calceină cu dublă etichetare la diafiza femurală pentru a măsura rata de formare osoasă. Micrografia reprezentativă a arătat o etichetare intensă și continuă a calceinei diafizei femurale, care a fost intercalată de o etichetare dublă strâns în grupurile de control și MP + CSE-BuF, spre deosebire de etichetarea unică slabă și ruptă observată în grupul MP (Fig. 4A, panoul superior ). Calculul parametrilor dinamici ai formării osoase pe baza experimentului de marcare a calceinei duble a arătat scăderi semnificative ale suprafeței mineralizante (pMS/BS), a ratei de apoziție minerală (pMAR) și a ratei de formare osoasă (pBFR/BS) în grupul MP comparativ cu vehiculul control ). Acești parametri au fost comparabili între grupurile de control și grupurile CSE-BuF (Fig. 4A, panoul inferior).
Deoarece pierderea masei osoase și microarhitectura cauzează pierderea rezistenței osoase, am studiat rezistența la compresiune a vertebrei L5 și rezistența la îndoire în 3 puncte a diafizei femurale. Tratamentul MP a scăzut toți parametrii de rezistență (sarcină maximă, energie până la eșec și rigiditate) în diafriza vertebrală și femurală L5, iar CSE-BuF a menținut toți cei trei parametri la ambele locuri la nivelurile șobolanilor martor (Fig. 4B, C).
CSE-BuF a prevenit formarea osoasă redusă și resorbția crescută de către MP fără a afecta efectul său de supresie imună
Pentru a studia mecanismul osteopocției de către CSE-BuF, am măsurat mai întâi markerii de fluctuație a osului seric. MP a suprimat propeptida N-terminală a procolagenului de tip I (PINP, marker de formare osoasă) și a crescut C-telopeptidă reticulată a colagenului de tip I (CTX-I, marker de resorbție osoasă) comparativ cu controlul (Veh) și CSE-BuF menținut atât la nivelurile de control (Fig. 5A). În concordanță cu PINP redus, nivelul ARNm al osteocalcinei (OCN), osteoblastul produs de proteina matricii non-colagenice a fost suprimat semnificativ în grupul MP comparativ cu controlul și tratamentul CSE-BuF a crescut semnificativ în grupul MP (Fig. 5A). Mai mult, ținând cont de markerul de resorbție seric crescut, am observat o creștere robustă a fosfatazei acide rezistente la tartrat (TRAP, enzimă specifică osteoclastelor) mARN în oasele grupului tratat cu MP peste control și CSE-BuF l-a suprimat la nivelul de control (Fig. 5A).
Osteocitele sunt osteoblasti maturi prinși în matricea osoasă și servesc ca un regulator major al remodelării osoase prin secretarea activatorului receptorului ligandului factor kappa-ga (RANKL) 16. Osteocitele apoptotice sunt producători robusti de RANKL, citokina osteoclastogenă cheie 17,18. Se știe că GC induc apoptoza osteocitară 19 și, în consecință, am observat o scădere semnificativă a nivelurilor de ARNm ale markerilor osteocitari: proteina matricei dentinei 1 (DMP-1), fosfliclicoproteina extracelulară a matricei (MEPE) și o creștere robustă a RANKL în oasele Grupul MP în comparație cu controlul și CSE-BuF au prevenit modificările induse de MP (Fig. 5B). Sclerostina, în primul rând o proteină produsă de osteocite, care inhibă funcția osteoblastelor, a fost semnificativ crescută în serul șobolanilor tratați cu MP comparativ cu martorul, cu toate acestea, CSE-BuF nu a avut niciun efect în comparație cu grupul tratat cu MP (Fig. 5C).
Pentru a obține o perspectivă asupra mecanismului molecular al acțiunii CSE-BuF, am măsurat apoi diferite niveluri de micro ARN (miARN) în oase despre care se știe că sunt modificate de GC. MiRNA 29a este cunoscut pentru a promova activitatea osteoblastelor prin reglarea expresiei Runx2 și MP îi suprimă expresia 20. Atât miARN 17, cât și miARN 20a inhibă expresia RANKL de către osteoblast și GC suprimă expresia lor 21,22. În concordanță cu aceste rapoarte, am observat scăderi semnificative ale nivelurilor de miARN 17, -20a și -29a la oasele șobolanilor tratați cu MP comparativ cu martorul, iar tratamentul cu CSE-BuF a crescut semnificativ nivelurile celor trei miARN comparativ cu grupul MP ( Fig. 5D).
Am verificat apoi dacă prevenirea efectului osteopenic al MP de către CSE-BuF implică o modificare a efectului antiinflamator al MP. Fermoarul leucinei indus de glucocorticoizi (GILZ) mediază acțiunea antiinflamatorie a GC în diferite organe, cel mai important prin reglarea activităților celulare T timice 23. Tratamentul cu MP a dus la o creștere robustă a mRNA GILZ în timus și os peste control, iar CSE-BuF nu a modificat efectul MP (Fig. 5E). În plus, nivelurile serice ale citokinei inflamatorii IL-1β au fost suprimate prin tratamentul cu MP și CSE-BuF nu a avut niciun efect asupra suprimării induse de MP (Fig. 5F).
CSE-BuF a prevenit atrofia musculară cauzată de MP
Atrofia musculară indusă de MP a fost observată din zona secțiunii transversale reduse semnificativ și diametrul feretului al mușchiului gastrocnemius comparativ cu martorul și ambii parametri din grupul CSE-BuF au fost mai mari decât martorul (Fig. 6A). Mai mult, tratamentul cu MP a crescut proteinele catabolice musculare, inclusiv nivelul de atrogină și proteina musculară RING-finger protein-1 (MuRF-1), provocând astfel atrofia musculară, iar CSE-BuF și-a suprimat complet nivelul de control (Fig. 6B).
Discuţie
SEDDS apare ca un sistem eficient de purtător pentru îmbunătățirea biodisponibilității compușilor slab absorbiți prezenți în extracte din plante. Deși majoritatea rapoartelor au folosit fitochimicale pure, această abordare a fost utilizată și pentru a spori biodisponibilitatea metoxiflavonelor Kaempferia parviflora extract 24, germacronă de rizom uscat de Curcuma zedoaria extract 25, bilabolid și ginkgolid A și B de Ginkgo biloba extractul 26 și protopina și tetrahidropalmatina Rhizoma Corydalis decumbentis 27 .
Datele noastre arată că CSE-BuF, o formulare bazată pe SEDDS în doză de 50 mg/kg promovează regenerarea osoasă și previne complet osteo-sarcopenia indusă de MP la șobolani probabil prin creșterea robustă a biodisponibilității a cinci compuși osteogeni (apigenină, izovitexină, THP, emodin și luteolin) raportate de noi pe baza in vitro teste 14. Printre acestea, in vivo efectul de conservare a oaselor a fost raportat pentru apigenină, emodină și luteolină 28,29,30,31,32. Isovitexina are, de asemenea in vivo efect osteogen la șoareci (date nepublicate, S. Pal și N. Chattopadhyay).
În concordanță cu biodisponibilitatea orală crescută a compușilor osteogeni, am observat un efect osteogen mai puternic al CSE-BuF (la 50 mg/kg) în ambele modele utilizate aici comparativ cu extractul nostru etanolic raportat anterior C. occidentalis tulpină (CSE, doză eficientă, 250 mg/kg) și CSE-Bu (doză efectivă 100 mg/kg) 14. În ciuda dozelor mai mari, CSE sau CSE-Bu nu au reușit să ofere protecție scheletică completă împotriva pierderii osoase induse de MP, ceea ce CSE-BuF a făcut 14, ceea ce a sugerat că CSE-BuF a fost semnificativ mai bun decât extractul/fracția neformulată.
Efectul osos al CSE-BuF a implicat atât mecanisme osteoanabolice, cât și mecanisme anti-resorptive. Având în vedere că terapia osteoanabolică (teriparatida) are un efect terapeutic mai bun în GIO decât bifosfonații 6,7,8,9,10 cea mai frecvent utilizată terapie anti-resorptivă și, din moment ce teriparatida nu este un medicament aprobat de FDA pentru GIO, este necesar pentru intervenția osteoanabolică pentru GIO, care ar putea fi deservită de CSE-BuF. Mai mult, sarcopenia cauzată de MP la rândul său afectează în mod secundar masa osoasă și a fost prevenită de CSE-BuF. În plus, modificările adverse ale compoziției corpului cauzate de MP care prezintă scăderi atât în masa slabă, cât și în masa grasă au fost prevenite de CSE-BuF. Luate împreună, CSE-BuF oferă o protecție completă împotriva modificărilor induse de MP în osteopenie și sarcopenie care au un impact secundar asupra sănătății osoase.
Osteocitele sunt osteoblaste rezidente în matrice care reglează critic homeostazia osoasă și unul dintre mecanismele majore prin care MP induce osteopenia este prin inducerea apoptozei osteocitelor 36. O inversare semnificativă a efectului supresiv puternic al MP de către CSE-BuF asupra genelor osteocitelor (DMP-1 și MEPE) atestă efectul osteoanabolic ulterior, cu toate acestea, nu a reușit să suprime creșterea indusă de MP a nivelurilor de sclerostină serică. Descoperirea noastră de suprimare a DMP-1 și MEPE de către MP este diferită de un raport care nu arată efectul prednisolonului asupra vertebrei lombare a șoarecilor 37. Această diferență ar putea fi explicată prin faptul că șoarecii martor au fost femele C57BL/6 purtând transgene Atg 7-f/f, în timp ce am folosit șobolani SD masculi, iar doza de glucocorticoizi a fost
Cu 60% mai mică (2,1 mg/kg) decât doza noastră (5 mg/kg). Astfel, rezultă din studiul nostru că reducerea markerilor osteocitari este asociată cu producția crescută de sclerostină de către MP și întrucât CSE-BuF atenuează efectul MP asupra expresiei markerului, nu afectează nivelurile ridicate ale inhibitorului Wnt care suprimă osteoblastul, sclerostin. Din datele noastre, se pare că efectul osteoanabolic al CSE-BuF nu se datorează suprimării nivelurilor de sclerostină. Mai mult, se știe că glucocorticoizii induc apoptoza osteocitară 38,39, iar osteocitele apoptotice produc puternic citokina osteoclastică puternică, RANKL 40 și CSE-BuF au blocat complet nivelurile de ARNm ale acestei citokine induse de MP. Ca rezultat, CSE-BuF a prevenit resorbția osoasă îmbunătățită cauzată de MP, care a fost evidentă din serul CTX-1 crescut puternic. La nivel molecular, MP a reglat inhibitorii RANKL ai miARN 17- și 20a și Runx2 și β-catenina stabilizând miARN 29a în oase și CSE-BuF a împiedicat aceste modificări. Aceste date furnizează mecanismele celulare și moleculare care stau la baza efectului protector al CSE-BuF asupra pierderii osoase induse de MP.
Observațiile unei asocieri puternice între osteopenie și sarcopenie în mai multe boli și îmbătrânire au condus la identificarea mușchilor osoși și scheletici ca țesuturi legate anatomic și funcțional. Pierderea masei musculare contribuie la pierderea osoasă datorită încărcării mecanice reduse a oaselor 41. Se știe că utilizarea cronică a GC provoacă sarcopenie prin stimularea căii catabolice musculare 11 și, în concordanță cu această constatare, am observat scăderea masei musculare datorită dimensiunii musculare reduse, contribuită de reglarea în sus a atrogin-1 și MurF-1, proteinele aparținând E3 ubiquitin ligase familie.
Problemele de siguranță și toxicitate sunt esențiale pentru traducerea clinică a unei intervenții terapeutice. Extract etanolic de C. occidentalis până la 2,5 g/kg nu au avut toxicitate în studiile acute și subacute 42. Deși nu am efectuat studii detaliate de toxicitate cu CSE-BuF, totuși, nu au existat mortalitate și pierderea în greutate datorită tratamentului cu CSE-BuF. Mai degrabă, CSE-BuF a protejat complet împotriva pierderii de greutate corporală indusă de MP (atât slabă, cât și de grăsime) sugerând astfel siguranța acesteia. Mai mult, excipienții formulării sunt categoria „În general recunoscută ca sigură” (GRAS) conform S.U.A. FDA și este puțin probabil să aibă toxicitate.
Dozele mari de GC sunt utilizate clinic nu numai pentru RA, ci și pentru alte afecțiuni inflamatorii cronice, cum ar fi boala pulmonară obstructivă cronică și boala inflamatorie a intestinului. Prin urmare, împiedicarea efectului antiinflamator al GC pe calea de protejare a osului este inacceptabilă din punct de vedere clinic. Inducerea GILZ de către GC este esențială pentru acțiunea lor antiinflamatorie și am observat că MP GILZ și CSE-BuF reglementate în mod robust nu au blocat acest efect în timus și os. În plus, CSE-BuF nu a avut niciun efect asupra supresiei IL-1β mediate de MP în ser. Aceste date au sugerat că CSE-BuF ar putea fi utilizat profilactic pentru a preveni osteo-sarcopenia indusă de MP fără a împiedica efectul antiinflamator al medicamentului. Figura 7 este o reprezentare schematică a principalelor constatări ale acestui studiu.
O diagramă schematică care ilustrează efectele CSE-Bu sau CSE-BUF asupra oaselor șobolanilor și a mușchilor scheletici administrate concomitent cu tratamentul MP. Imaginea folosită în această figură a fost făcută de Subhashis Pal (autorul acestui manuscris). PK, farmacocinetică și PD: farmacodinamică.
- Beneficii ale extractului de semințe de Cassia, efecte secundare; Dozare
- Extract standardizat de anghinare Vitamin World
- Piața extractelor de semințe de Cassia - Analiza globală a industriei, dimensiunea și prognoza, 2017-2027
- 10 beneficii pentru sănătate ale semințelor de Cassia - extract, efecte secundare de top
- Extract de polifenol de bergamotă Suport natural pentru scăderea colesterolului, a trigliceridelor și a glucozei