1 Departamentul de Medicină, Școala de Medicină a Universității Emory, 101 Woodruff Circle NE, Atlanta, GA 30322, SUA
2 Divizia de Endocrinologie, Metabolism și Lipide, Departamentul de Medicină, Școala de Medicină și Atlanta VA Medical Center Emory University, Decatur, GA 30300, SUA
Abstract
Raportăm cazul unui bărbat afro-american în vârstă de 30 de ani cu osteopetroză și hipofosfatemie, prezentând malgii difuze. Evaluarea de laborator efectuată a evidențiat un nivel scăzut de fosfor în ser, cu irosire de fosfat urinar, concentrații scăzute de calciu și 25-hidroxivitamină D, precum și fosfatază alcalină crescută. Radiografiile craniului și pelvian au relevat o densitate osoasă ridicată, în concordanță cu masa osoasă mare găsită în rapoartele de densitate minerală osoasă. Analiza mutației genei PHEX a fost negativă. Pacientul a început să înlocuiască calciu și fosfor și sa îmbunătățit clinic. Această lucrare va analiza diferitele subtipuri de osteopetroză și evaluarea hipofosfatemiei.
1. Introducere
Acest manuscris va prezenta cazul unui bărbat afro-american în vârstă de 30 de ani, care a prezentat asistență medicală cu mialgii difuze și dureri osoase. Pacientul a fost mai întâi tratat simptomatic pentru durerea de șold care a devenit din ce în ce mai gravă și a fost asociată cu pierderea auzului și tulburări vizuale. El a fost trimis pentru evaluare ulterioară, când s-a constatat că are un diagnostic dublu de osteopetroză și hipofosfatemie. Acest articol se va concentra în principal pe evaluarea diagnosticului și diferențialul pentru fiecare afecțiune, precum și pe un potențial diagnostic unificator.
2. Prezentarea cazului
Istoricul familiei sale este semnificativ pentru un frate mai mic cu dureri osoase difuze și dureri de cap, precum și cu fosfor seric scăzut. Fratele său nu a mai avut alte antrenamente. El raportează un văr și un nepot cu înclinare a picioarelor și statură scurtă și un văr secund care suferă de dureri musculo-scheletice severe și statură scurtă. Niciun membru al familiei nu a fost evaluat pentru cauzele staturii lor scurte sau a durerii musculo-scheletice. Nici o femeie nu este afectată în familie și toate persoanele afectate sunt din partea maternă.
I s-a prescris inițial medicament de înlocuire a calciului și durere. De asemenea, a fost sfătuit să renunțe la armată. Pacientul nu a îmbunătățit acest tratament și a solicitat oa doua opinie de la un endocrinolog pediatru. Testele inițiale au fost repetate, inclusiv densitatea minerală osoasă, care a confirmat diagnosticul de densitate minerală osoasă ridicată. Testele suplimentare au evidențiat un nivel scăzut de fosfor în ser și un nivel scăzut de fosfor în urină 24 de ore. Reabsorbția sa tubulară maximă de fosfor per rata de filtrare glomerulară (TMP/GFR) a fost de 1,1 mg/dL (2,6-4,4 mg/dL). A început cu suplimente de calcitriol și fosfat de potasiu/fosfat de sodiu.
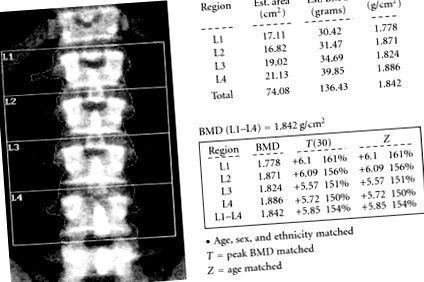
Pacientul a fost trimis la instituția noastră la aproximativ doi ani de la prezentarea inițială. O măsurare repetată a densității osoase de către DEXA a relevat o densitate osoasă mare în șoldul total (+2,31 T-scor) și în coloana vertebrală (L1 - L4) (+5,85 T-scor) (Figura 1). Radiografiile craniului său au fost remarcabile pentru un calvariu gros cu densitate normală și simetrică (Figura 2). Studiul scheletului și examenul coloanei lombare au fost în limite normale. Pacientul avea calciu seric normal (9,7 mg/dL), fosfor seric cu post redus (1,8 mg/dL) (2,4-4,5 mg/dL) și o colecție de urină de 24 de ore care a demonstrat irosirea fosfatului (2666,38 mg/24 ore) 800 –2000 mg/24 ore). 25-hidroxivitamina D a fost de 17 ng/mL (30-100 ng/mL). Concentrația sa de PTH a fost în limite normale la 46 pg/ml (15-65 pg/ml), iar nivelul fosfatazei alcaline a fost crescut la 139 UI/L (30-115 UI/L). Hipofosfatemia a fost investigată în continuare cu secvențierea ADN-ului, în căutarea unei posibile mutații genice PHEX. Douăzeci și două de segmente ale secvenței PHEX s-au dovedit a fi negative pentru o mutație PHEX semnificativă.
El a început să utilizeze calcitriol 0,25 mcg de două ori pe zi, fosfat de potasiu/fosfat de sodiu (250 mg fosfor) la fiecare 3 ore de până la 8 ori pe zi. I s-a administrat ergocalciferol 50.000 UI o dată pe săptămână pentru deficitul său de vitamină D, care i-a îmbunătățit serul 25 (OH) D la 27 ng/ml. El este menținut pe calcitriol 0,75 micrograme de două ori pe zi și fosfor 225 micrograme de 4 ori pe zi. Durerea sa este îmbunătățită și ia doar tramadol ocazional pentru dureri musculo-scheletice. De atunci se descurcă bine, suferind doar de dureri musculo-scheletice ocazionale, fără a interfera cu activitățile sale zilnice.
3. Discuție
3.1. Osteopetroza
Osteopetroza cuprinde un grup eterogen clinic și genetic de afecțiuni care împărtășesc semnul distinctiv al densității osoase crescute pe radiografii. Creșterea densității osoase poate fi o constatare normală atunci când este prezentă în tot scheletul la gimnaste și alți sportivi. Cu toate acestea, creșterea asimetrică a densității osoase sau a creșterii mult mai mari decât în mod normal este asociată de obicei cu o anumită patologie de bază. Densitatea osoasă crescută în osteopetroză rezultă din anomalii ale diferențierii sau funcției osteoclastelor [1].
Există mai multe tipuri distincte de osteopetroză, dintre care cele mai frecvente 2 sunt tipul autosomal dominant benign și tipul malign recesiv [1]. Osteopetroza produce eterogenitatea simptomelor, în funcție de mutația specifică care stă la baza fiecărei forme a bolii [1].
Tipul autosomal recesiv (ARO) se manifestă de obicei la copilărie, provocând anemie, leucopenie, hepatomegalie și eșecul prosperării, precum și simptome ale nervului cranian, uneori ducând la moarte timpurie [2]. O variantă a ARO apare secundar unui defect al enzimei anhidrazei carbonice II (CAII), cunoscut sub numele de „sindromul creierului de marmură” [3]. Are un curs mai blând, cu acidoză tubulară renală concomitentă (RTA) și calcificări cerebrale [3]. Alte manifestări clinice cuprind o frecvență crescută a fracturilor, statura scurtă, anomalii dentare, compresia nervului cranian și întârzierea dezvoltării [3]. Eșecul neuronal în osteopetroză, manifestat ca întârziere mentală și pierderea vizuală și auditivă, este cel mai probabil secundar compresiei nervoase prin îngustarea foraminei nervoase [4]. Pacienții cu ARO aveau de obicei o fosfatază alcalină osoasă ridicată (BALP) [2]. Acidoza tubulară a fost, de asemenea, descrisă secundar unei duble mutații genetice, una în gena ATP6i și cealaltă în gena ATPV1B1 care codifică subunitatea B1 specifică rinichiului H + -ATPazei vacuolare [5]. Evaluarea de laborator la pacientul nostru nu a relevat nicio dovadă a RTA. Nu a suferit de întârziere mintală, iar studiul său osos nu a dezvăluit fracturi.
Tipul autosomal dominant, cunoscut și sub numele de boala Albers-Schonberg, are 2 subtipuri majore, și anume, ADO-I și ADO-II, ADO II fiind forma mai frecventă. S-a sugerat că mutațiile proteinei 5 (LRP5) legate de receptorul lipoproteinelor cu densitate scăzută, gene importante pentru funcția osteoclastelor, sunt posibil asociate cu ADO-I [6, 7], în timp ce mutațiile din gena CLCN7 au fost recent menționate ca subiacente ADO -II, producând un spectru larg de severitate a bolii [8, 9].
Aceste 2 forme se disting prin caracteristici radiografice și clinice. ADO-II se caracterizează prin îngroșarea plăcii finale a vertebrelor și endobonilor din bazin, în timp ce la ADO-I pacienții au de obicei osteoscleroză pronunțată a bolții craniene. ADO-I este puțin probabil să prezinte fracturi [6, 10]. De asemenea, s-a remarcat faptul că pacienții cu ADO-II au o creatinin kinază BB crescută [11], o tartrat fosfatază serică crescută și un BALP scăzut. Pacientul nostru nu a prezentat caracteristici radiografice clasice ale ADO-I sau ADO-II. Pacientul nostru a avut o prezentare mai benignă la o vârstă mai târziu. Acest lucru sugerează o formă mai ușoară de ADO.
3.2. Hipofosfatemie
4. Densitatea osoasă crescută, hipofosfatemia și fosfaturia coexistente
Pacientul nostru a prezentat paradoxul creșterii densității osoase cu scăderea rezistenței osoase, manifestat ca o DMO crescută cu o fractură vertebrală T11. Filmele sale nu au dezvăluit niciunul dintre semnele radiografice clasice care să facă diferența între ADO-I sau ADO-II. Pacientul avea, de asemenea, hipofosfatemie și irosire de fosfat de urină. Evaluarea de laborator pentru o potențială mutație a genei PHEX a fost negativă. PTH al pacientului se încadra în limite normale și nu a folosit niciun fel de diuretice, ceea ce le face mai puțin probabile pe diferențialul nostru. De asemenea, a suferit de deficit de vitamina D, dar nu avea dovezi clinice de rahitism.
Un alt diagnostic potențial la pacientul nostru include ARO secundar deficitului de CAII. Cu toate acestea, el nu manifestă nicio dovadă a acidozei tubulare renale cu bicarbonat seric normal, cuprins între 28 și 31 mmol/l. Au fost raportate cazuri de deficit de CAII fără RTA, dar acea clasă de pacienți a suferit de întârziere mintală. Pacientul nostru are o dezvoltare mentală normală; a absolvit facultatea și este asistent social. Mai mult, el nu are fracturi osoase sau malocluzie dentară severă [19, 20].
5. Concluzie
Am prezentat un caz al unui tânăr care prezintă atât osteopetroză, cât și hipofosfatemie. Avea deficiență de vitamina D, dar nu a suferit niciodată clinic de rahitism. De asemenea, el nu a avut descoperiri radiologice care să sugereze osteomalacia. Evaluările biochimice ale acestui pacient au fost remarcabile pentru anemie ușoară, niveluri crescute de fosfatază alcalină, nivel scăzut de fosfat plasmatic cu irosirea fosfatului în urină și densitate minerală osoasă crescută radiologic. Pacientul nu a avut o mutație genică PHEX. Pacientul s-a prezentat la o vârstă mai târzie și a răspuns bine la terapie. De asemenea, i-au lipsit descoperirile clasice pentru osteopetroza autosomală recesivă, care este mai severă și se prezintă la o vârstă mult mai timpurie. Având în vedere aceste constatări, este probabil ca pacientul nostru să sufere de o formă ușoară de osteopetroză autosomală dominantă. Din păcate, nu am avut teste ADN disponibile pentru a confirma suspiciunea noastră clinică. Pacientul nostru a raportat dureri scheletice îmbunătățite cu suplimente de calciu și fosfor.
Finanțarea
Această lucrare a fost susținută de NIH Grant nr. K23AR054334/NIH/NIAMS.
Declinare de responsabilitate
Această lucrare nu a fost prezentată anterior sub nici o formă.
Referințe
- Z. Stark și R. Savarirayan, „Osteopetroza” Jurnalul Orphanet al bolilor rare, vol. 4, nr. 1, articolul 5, 2009. Vizualizați la: Site-ul editorului | Google Scholar
- D.M. Brown și P.B. Dent, „Patogenia osteopetrozei: o comparație a spectrelor umane și animale” Cercetări pediatrice, vol. 5, pp. 181–191, 1971. Vezi la: Google Scholar
- C. Jacquemin, P. Mullaney și E. Svedberg, „Sindromul creierului de marmură: osteopetroză, acidoză renală și calcificarea creierului” Neuroradiologie, vol. 40, nr. 10, pp. 662–663, 1998. Vizualizare la: Site-ul editorului | Google Scholar
- C. Letizia, A. Taranta, S. Migliaccio și colab., "Osteopetroza benignă de tip II (boala Albers-Schönberg) cauzată de o mutație nouă în CLCN7 care prezintă manifestări clinice neobișnuite" Calcified Tissue International, vol. 74, nr. 1, pp. 42–46, 2004. Vizualizare la: Site-ul editorului | Google Scholar
- K. J. Borthwick, N. Kandemir, R. Topaloglu și colab., „O fenocopie a deficitului de CAII: o explicație genetică nouă pentru osteopetroza infantilă moștenită cu acidoză tubulară renală distală”. Journal of Medical Genetics, vol. 40, nr. 2, pp. 115–121, 2003. Vizualizare la: Google Scholar
- L. Van Wesenbeeck, E. Cleiren, J. Gram și colab., „Șase noi mutații missense în gena proteinei 5 (LRP5) legată de receptorul LDL în condiții diferite, cu o densitate osoasă crescută”. American Journal of Human Genetics, vol. 72, nr. 3, pp. 763–771, 2003. Vizualizare la: Site-ul editorului | Google Scholar
- E. Van Hul, J. Gram, J. Bollerslev și colab., „Localizarea genei care determină osteopetroza dominantă autozomală de tip I la cromozomul 11q12-13”. Journal of Bone and Mineral Research, vol. 17, nr. 6, pp. 1111–1117, 2002. Vizualizare la: Google Scholar
- Z. L. Zhang, J. W. He, H. Zhang și colab., „Identificarea mutațiilor genei CLCN7 în două familii chineze cu osteopetroză dominantă autozomală (tip II)” Journal of Bone and Mineral Metabolism, vol. 27, nr. 4, pp. 444–451, 2009. Vizualizare la: Site-ul editorului | Google Scholar
- E. Cleiren, O. Bénichou, E. Van Hul și colab., „Boala Albers-Schönberg (osteopetroză autosomală dominantă, tip II) rezultă din mutații ale genei canalului de clorură CICN7”. Genetica moleculară umană, vol. 10, nr. 25, pp. 2861–2867, 2001. Vizualizare la: Google Scholar
- J. Bollerslev și L. Mosekilde, „Osteopetroza autosomală dominantă” Ortopedie clinică și cercetări conexe, Nu. 294, pp. 45–51, 1993. Vizualizare la: Google Scholar
- J. Gram, S. Antonsen, M. Horder și J. Bollerslev, „Niveluri serice crescute de creatin kinază BB în osteopetroza autosomală dominantă de tip II”. Calcified Tissue International, vol. 48, nr. 6, pp. 438–439, 1991. Vizualizare la: Google Scholar
- A. Gaasbeek și A. E. Meinders, „Hipofosfatemia: o actualizare a etiologiei și tratamentului acesteia” Jurnalul American de Medicină, vol. 118, nr. 10, pp. 1094–1101, 2005. Vizualizare la: Site-ul editorului | Google Scholar
- A. S. Alizadeh Naderi și R. F. Reilly, „Tulburări ereditare ale irosirii fosfatului renal” Nature Reviews Nephrology, vol. 6, nr. 11, pp. 657–665, 2010. Vizualizați la: Site-ul editorului | Google Scholar
- D. Tiosano și Z. Hochberg, „Hipofosfatemia: numitorul comun al tuturor rahitismului” Journal of Bone and Mineral Metabolism, vol. 27, nr. 4, pp. 392–401, 2009. Vizualizare la: Site-ul editorului | Google Scholar
- F. S. Kaplan, C. S. August, M. D. Fallon, F. Gannon și J. G. Haddad, „Osteopetrorickets: paradox of abundence. Fiziopatologie și tratament " Ortopedie clinică și cercetări conexe, Nu. 294, pp. 64–78, 1993. Vizualizare la: Google Scholar
- Y. Bükte, F. Gürkan, M. Davutoǧlu, A. Gözü și M. Bilici, „Osteopetroza infantilă asociată cu rahitismul” Jurnalul European de Medicină Generală, vol. 2, nr. 1, pp. 32–34, 2005. Vizualizare la: Google Scholar
- C. Kirubakaran, K. R. Ranjini, J. X. Scott, M. Basker și G. Sridhar, „Osteopetrorickets” Journal of Tropical Pediatrics, vol. 50, nr. 3, pp. 185–186, 2004. Vizualizare la: Site-ul editorului | Google Scholar
- V. Datta, N. C. Prajapati, M. Kamble și S. Pathak, „Osteopetrorickets” Pediatrie indiană, vol. 37, nr. 1, pp. 98–99, 2000. Vizualizare la: Google Scholar
- W. S. Sly, S. Sato și X. L. Zhu, „Evaluarea izozimelor anhidrazei carbonice în tulburările care implică osteopetroza și/sau acidoză tubulară renală”. Biochimie clinică, vol. 24, nr. 4, pp. 311–318, 1991. Vizualizare la: Google Scholar
- K. Senel, M. Ugur, A. Erdal și H. Özdemir, „Osteopetroza autosomală dominantă de tip II” Rheumatology International, vol. 22, nr. 3, pp. 116–118, 2002. Vizualizare la: Site-ul editorului | Google Scholar
- Hrănirea restrictivă și foamea excesivă la copiii mici cu obezitate O serie de cazuri - Eagleton -
- Prurigo Pigmentosa - „Keto Rash” o revizuire a literaturii și un studiu de caz recent Natural
- Studiu de caz de dietă rutieră Ingersoll revigorant
- Adenomul pleomorf al palatului moale al unei glande salivare minore O prezentare neobișnuită
- Rata de obezitate pentru copii mici scade cu 43% într-o decadă - The New York Times