Rozita H Anderberg
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Jennifer E Richard
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Kim Eerola
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Lorena Lopez-Ferreras
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Elin Bank
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Caroline Hansson
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Hans Nissbrandt
2 Departamentul de farmacologie, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Göteborg, Suedia
Filip Berqquist
2 Departamentul de farmacologie, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Göteborg, Suedia
Fiona M Gribble
3 Unitatea MRC pentru boli metabolice și Institutul de Științe Metabolice, Universitatea din Cambridge, Marea Britanie
Frank Reimann
3 Unitatea MRC pentru boli metabolice și Institutul de științe metabolice, Universitatea din Cambridge, Marea Britanie
Ingrid Wernstedt Asterholm
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Christophe M Lamy
4 Laborator de fiziologie neurometabolică, Departamentul de Medicină, Universitatea din Fribourg, Fribourg, Elveția
Karolina P Skibicka
1 Departamentul de Fiziologie/Fiziologie metabolică, Institutul de Neuroștiințe și Fiziologie, Academia Sahlgrenska de la Universitatea din Gothenburg, Suedia
Date asociate
Abstract
Introducere
Glucagon-like peptide-1 (GLP-1), o peptidă produsă în creier și în intestin, este un regulator critic al echilibrului energetic; proprietățile sale de glucoreglare și anti-obezitate sunt utilizate în prezent cu succes în clinică (1-3). Deși capacitatea GLP-1 și a analogilor săi stabili, exendin-4 (EX4), de exemplu, de a reduce consumul de alimente este bine stabilită, mecanismele cerebrale care guvernează anorexia indusă de receptorii GLP-1 (GLP-1R) sunt încă slab înțelese.
În mod surprinzător, se știe puțin despre interacțiunea sistemelor centrale de GLP-1 și serotonină. Cu toate acestea, datele existente sugerează că este posibilă o interacțiune: 1. GLP-1 și EX4 s-au dovedit a elibera în mod dependent serotonina din sinaptozomii hipotalamici de șobolan (13); 2. Receptorii GLP-1 au fost identificați în nucleul rafei dorsale (DR), un nucleu care adăpostește corpuri celulare de neuroni serotoninergici care furnizează serotonină multor situri ale creierului, inclusiv hipotalamusul (14-16); 3. Mecanismul molecular pentru inducerea serotoninei prin activarea GLP-1R este sugerat de un studiu recent care arată că, la nivelul colonului, EX4 atenuează hiperalgezia prin creșterea producției de serotonină colonică (17). La nivelul colonului, interacțiunea GLP-1-serotonină poate fi reciprocă, deoarece agoniștii receptorilor serotoninei sau serotoninei 5HT1B cresc, de asemenea, secreția GLP-1 din celulele enteroendocrine (18, 19).
Aici am folosit mai multe abordări metodologice pentru a determina dacă cele două sisteme anti-obezitate relevante clinic interacționează și pentru a identifica mecanismul neuroanatomic al acestei interacțiuni. Rezultatele comportamentale, neurofarmacologice, electrofiziologice și neuroanatomice obținute aici susțin un impact direct al activării centrale a GLP-1 pentru a crește neurotransmisia centrală a serotoninei, o relație descoperită a fi critică pentru menținerea pierderii în greutate sau pierderea în greutate indusă de GLP-1 și pentru hipofagia.
Proiectare și metode de cercetare
Animale
Șobolani Sprague-Dawley masculi adulți, cu o greutate de 200-250g (Charles River, Germania), au fost adăpostiți în cuști de plastic individuale sub 12/12 ore ciclu întuneric/lumină, la 20 ° C și 50% umiditate. Șoarecii transgenici mGLU-124 adulți mGLU-124 de proteină fluorescentă galbenă (șoareci YFP-PPG; Universitatea din Cambridge, Regatul Unit (20)) au fost adăpostiți în cuști de plastic. Apa și chow-ul standard erau disponibile ad libitum. Toate studiile au fost efectuate cu permisiuni etice din partea Comitetului pentru bunăstarea animalelor din cadrul Universității din Gothenburg (permisiunea 195-13), în conformitate cu cerințele legale ale Comunității Europene (Decretul 86/609/CEE).
Droguri
GLP-1 (7-36), Exendin-4 (EX4; agonist GLP-1R), Exendin 9-39 (Ex9-39; antagonist GLP-1R), para-clorofenilalanină (PCPA), R-96544 (antagonist selectiv 5HT2A ) (21)), SB242084 (antagonist 5HT2C (22)) și angiotensină II au fost achiziționate de la Tocris (Bristol, Marea Britanie). Toate substanțele, cu excepția SB242084, liraglutidă și PCPA, au fost dizolvate în lichidul cefalorahidian artificial (aCSF), un vehicul pentru injecții centrale. Liraglutida (Bachem) a fost dizolvată în soluție salină 0,9%. PCPA a fost dizolvat în soluție salină 0,9% prin încălzire ușoară și sonicare la o concentrație de 100 mg/ml (23, 24). SB242084 a fost dizolvat în 16% DMSO. Antagonistul receptorului 5HT2C SB242084 afișează selectivitatea de 158 și 100 de ori peste receptorii 5HT2A și respectiv 5HT2B și, de asemenea, afișează selectivitatea pe o gamă de alți receptori 5-HT, dopamină și adrenergică. R-96544 este un antagonist puternic, selectiv al receptorului 5HT2A; R-96544 arată o afinitate de 100 de ori mai mare pentru receptorii umani 5HT2A decât 5HT1A, 5HT1B, 5HT1D, 5HT5A, 5HT6, 5HT7 și transportori 5-HT, deși R-96544 are o afinitate relativ mare pentru receptorii 5HT2C -HT2A) (21).
Canularea creierului
Șobolanilor li s-a implantat o canulă de ghidare (canulă de calibru 26; Plastics One, Roanoke, VA) așa cum s-a descris anterior (25) pentru a permite injecțiile medicamentoase în ventriculul lateral (LV) sau DR. Au fost utilizate următoarele coordonate de injecție: ± 1,6mm/-0,9mm/-4,0mm pentru LV și 0,0mm/-7,7mm/-6,8mm pentru DR (date de la linia mediană/bregma/craniu). Plasarea VS a fost verificată cu testul de consum al angiotensinei II (26). Situl de microinjecție pentru canula de ghidare DR a fost verificat post mortem prin microinjecție de cerneală India la același volum de microinjecție (0,3 μl) utilizat pe tot parcursul studiului.
Izolarea ARN și expresia ARNm
Nivelurile de expresie a genelor hipotalamice au fost măsurate după injecții cronice (zilnic, timp de 10 zile) cu VS de EX4 (0,2 ug) sau vehicul (aCSF). Un al treilea grup de șobolani a fost inclus pentru a determina dacă activarea cronică a GLP-1R interacționează cu modificările induse de pierderea în greutate a receptorilor serotoninei. Acești șobolani au fost hrăniți în perechi zilnic la cantitatea de chow consumată de șobolanii tratați cu EX4. Au fost examinate următoarele gene ale receptorilor de serotonină: Htr1a, Htr2a, Htr2c, Htr3a. Aceste gene au fost alese pe baza conexiunii lor arătate anterior cu activarea GLP-1R sau a rolului lor bine stabilit în reglarea hrănirii (a se vedea secțiunea de discuții pentru detalii). Creierele au fost îndepărtate rapid la 24 de ore după ultima injecție EX4 și hipotalamusul a fost disecat. Expresia genică a fost determinată folosind TaqMan RT-PCR și seturi de primer/sondă așa cum s-a descris anterior (26-28) (pentru numerele de referință vezi tabelul 1 SI). Valorile expresiei genice au fost calculate pe baza metodei ΔΔCt (29), cu grupul injectat de vehicul setat ca calibrator. PPIA (peptidilprolil izomeraza A) a fost utilizată ca genă de referință.
Imunohistochimie
Șoarecii au fost anesteziați și perfuzați transcardic cu soluție salină heparinizată urmată de soluție fixativă tamponată. Fibrele GLP-1 și neuronii TPH pozitivi au fost vizualizați cu un microscop confocal (LSM 700; Carl Zeiss AG). Anticorpii, producătorii și diluțiile sunt enumerate în tabelul suplimentar 2.
Electrofiziologie cu celule întregi
Feliile coronale de trunchi cerebral de șobolan, grosime de 200 μm, care conțin DR au fost tăiate în soluție extracelulară rece ca gheața folosind un vibratom și menținute într-o cameră de incubație la temperatura camerei. Înregistrările cu celule întregi au fost obținute din neuroni identificați vizual folosind pipete de sticlă conținând (în mM): 130 K-gluconat, 2 NaCl, 1 MgCl2, 10 hepe, 0,1 EGTA, 10 Na fosfocreatină, 4 MgATP, 0,5 Na2GTP, biocitină 0,1%, pH 7,3. Înregistrările continue ale potențialului membranei (Vm) au fost utilizate pentru a monitoriza efectul EX4. Rezistența de intrare (Rinput) a fost calculată din răspunsul la impulsurile de curent hiperpolarizante injectate prin pipeta de înregistrare. EX4 sau Ex9-39 au fost adăugate la tamponul de superfuzie. Datele electrofiziologice au fost analizate cu pClamp10 (Molecular Devices). Datele grupate au fost prezentate ca medie ± SEM; s-a folosit o măsură repetată ANOVA pentru a determina semnificația, deoarece efectul inițial al vehiculului și efectele EX4 sau Ex9-39 și EX4 au fost măsurate în același neuron. Feliile DR au fost fixate cu PFA 4% după înregistrare. Imaginile de fluorescență ale secțiunilor marcate au fost achiziționate cu un microscop confocal (TCS SP5, Leica Microsystems) și reconstituite în 3 dimensiuni pentru a evalua expresia TPH în celulele care conțin biocitină.
Cifra de afaceri a serotoninei
Creierele au fost disecate la 24 de ore după ultima injecție EX4 (injecțiile au fost administrate zilnic timp de 8 zile). Creierele au fost îndepărtate rapid și hipotalamusul a fost disecat folosind o matrice cerebrală. Concentrațiile tisulare de serotonină și metabolitul acesteia (5-HIAA) au fost determinate prin cromatografie lichidă de înaltă performanță (30).
Test de înot forțat (FST)
FST a fost inițial dezvoltat de Porsolt și colegii (31) pentru a depista efectul antidepresiv al farmacoterapiei. Aici am folosit versiunea modificată a FST prezentată pentru a oferi o fiabilitate mai mare pentru detectarea efectelor depresive sau antidepresive pentru compușii care afectează sistemul serotoninergic (32). Testul a fost efectuat conform descrierii anterioare (26).
Proiectare experimentală
Efectul epuizării serotoninei asupra impactului pierderii în greutate a activării GLP-1R
Pentru a evalua impactul epuizării serotoninei asupra efectului de scădere în greutate al activării GLP-1R, șobolanii săraci cu serotonină au fost injectați cu EX4 și greutatea lor a fost urmată timp de cinci zile consecutive de injecții centrale cu EX4. Depleția serotoninei a fost efectuată prin trei injecții intraperitoneale de PCPA, un inactivator ireversibil al TPH, o enzimă necesară pentru sinteza serotoninei. Șobolanii au primit o injecție zilnică de 300 mg/kg timp de 3 zile. Acest regim de tratament s-a arătat anterior că scade conținutul de serotonină la 5-10% din nivelurile inițiale (24, 33), în mâinile noastre, volumul serotoninei în hipotalamus a fost încă redus cu peste 40% la o săptămână după tratamentul cu PCPA (2,53 ± 0,2 vs 1,57 ± 0,2: cifra de afaceri a serotoninei 5-HIAA/5-HT pentru șobolanii tratați cu vehicul și respectiv cu PCPA; p Figura 1A). Măsurătorile repetate ANOVA pe două căi asupra datelor privind greutatea corporală au indicat un efect semnificativ al tratamentului medicamentos (F (3, 15) = 18,69; P # p ## p ### p Figura 1B). Hrănirea a fost limitată la cantitatea zilnică consumată voluntar de șobolanii tratați cu EX4. În timp ce restricția alimentară a crescut mARN-ul tuturor receptorilor serotoninergici testați, această modificare a atins semnificația numai pentru ARNm Htr2a și Htr2c (Figura 1B). De remarcat, restricția alimentară a promovat o expresie crescută a acestor doi receptori, de asemenea, atunci când ambele grupuri de control și cele cu restricție alimentară nu au primit canulație sau injecție (Figura S1). În concordanță cu ideea că activarea GLP-1R crește neurotransmisia serotoninei pentru a produce hipofagie, am constatat că rotația serotoninei a crescut în hipotalamia șobolanilor tratați cu EX4 (Figura 1C).
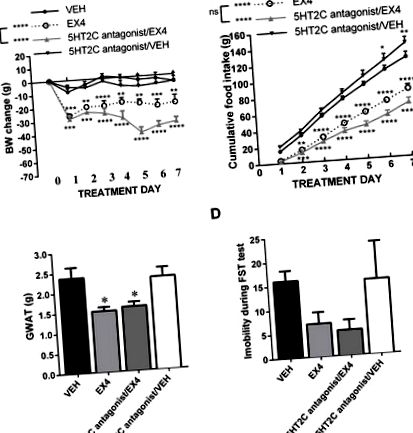
Blocarea receptorului 5HT2C nu atenuează pierderea în greutate indusă de EX4 sau anorexia
Blocarea receptorilor centrali 5HT2A atenuează efectul anorexic și de scădere în greutate a EX4. Tratamentul EX4 central subcronic zilnic a produs o pierdere în greutate profundă și susținută; blocarea receptorilor 5HT2A concomitent cu tratamentul EX4 nu a afectat pierderea în greutate acută indusă de EX4, dar a eliminat pierderea în greutate indusă de EX4 după o săptămână (A). În conformitate cu rezultatele greutății corporale, EX4 a produs o reducere profundă a aportului alimentar care a fost abolită după tratamentul cu antagonist 5HT2A, dar numai după trei zile de co-tratament (B) În mod similar, reducerea greutății tamponului adipos gonadial gonadal (GWAT) indusă de EX4 a fost complet abolită prin blocarea concomitentă a receptorului 5HT2A (C). În schimb, impactul EX4 asupra comportamentului asemănător depresiei a fost nealterat de blocarea cronică a receptorilor 5HT2A (D). n = 6-8 pentru fiecare grup de tratament. Datele sunt prezentate ca medie ± SEM. * P Figura 4A). Modelul rezultatelor a fost oarecum diferit de cel obținut cu EX4, deoarece liraglutida injectată intraperitoneal a fost mult mai puțin puternică la reducerea greutății corporale și, în mod interesant, blocarea 5HT2A a fost eficientă deja la 24 de ore. Măsurile repetate ANOVA pe două căi asupra datelor privind greutatea corporală au indicat o interacțiune semnificativă, efect semnificativ al tratamentului medicamentos (F (3,32) = 6,282; P Figura 4B): interacțiune semnificativă, efect semnificativ al tratamentului medicamentos (F (3, 32) = 5,82; P Figura 1A, 2A, 2A, 3A, 3A, 4A), 4A), acest lucru este probabil deoarece fiecare dintre aceste grupuri a primit diferite tratamente vehicul pentru serotonina care însoțește medicamentul care vizează semnalizarea sau diferiți analogi GLP -1 afișarea unei potențe de efect diferite sau a unei căi de administrare diferite (periferice vs. icv), rezultând o putere de efect diferită. Este important, totuși, interacțiunea cu serotonina descoperită aici a persistat, indiferent de gradul de scădere în greutate indus de analogii GLP-1. Astfel, interacțiunea nu este limitată la cazurile în care analogii GLP-1 duc la cea mai mare pierdere în greutate.
Blocarea receptorilor centrali 5HT2A atenuează efectul anorexic și de scădere în greutate a liraglutidei injectate periferic. Injecțiile zilnice periferice (ip) de liraglutidă (75 µg/kg) au favorizat pierderea în greutate; blocarea receptorilor 5HT2A concomitent cu tratamentul cu liraglutidă a eliminat pierderea în greutate indusă de liraglutidă (A). În conformitate cu rezultatele greutății corporale, liraglutida a redus aportul de alimente, efect care a fost atenuat de tratamentul antagonist al receptorului 5HT2A (B) n = 7-10 pentru fiecare grup de tratament. Datele sunt prezentate ca medie ± SEM. * P Figura 5A). Această cale de aplicație furnizează probabil agoniști GLP-1R către multe locații ale creierului din care poate fi obținut un potențial efect anorexic. Deoarece atât epuizarea serotoninei, cât și blocarea receptorului 5HT2A au sugerat o interacțiune a activării GLP-1R cu serotonina, am emis ipoteza că GLP-1 poate exercita o parte din efectele sale anorexigenice și de pierdere în greutate, acționând direct asupra DR. Șobolanii microinjectați cu GLP-1 sau EX4 în DR au mâncat semnificativ mai puțin chow atât la 1h (ANOVA; F (2, 23) = 4,17, p Figura 5B). Pierderea în greutate a șobolanilor injectați fie cu EX4, fie cu GLP-1 nu a atins, totuși, semnificație statistică (F (2.23) = 1.39, p = 0.26, Figura 5C). Microinjecțiile intra-DR GLP-2 nu au modificat aportul de alimente sau greutatea corporală (Figura S2).
Fibrele neuronilor producători de GLP-1 inervează DR
Pentru a determina dacă neuronii producători de GLP-1 inervează DR, oferind astfel o cale prin care peptida endogenă ar putea ajunge la neuronii serotoninici DR, șoarecii proiectați pentru a exprima proteina fluorescentă galbenă (YFP) și neuronii preproglucagonici (PPG) producători de GLP-1 au fost utilizat (38) împreună cu detectarea imunohistochimică a TPH pentru identificarea neuronilor serotoninergici. Inervația imunoreactivă YFP a fost evaluată în felii de creier coronal luate în întreaga întindere rostro-caudală a DR la șoareci YFP-PPG (38). Fibrele imunoreactive YFP au fost găsite în toată DR (Figura 6); cu toate acestea, diviziunile dorsale și dorsolaterale ale DR conțineau cea mai mare densitate a axonilor YFP-imunoreactivi. În această zonă, s-a găsit că mulți neuroni TPH-pozitivi primesc inervație de la neuroni producători de GLP-1 (Figura 6, Figura S3: fișier video). Reconstrucția tridimensională a liniei Z a unei stive de imagini confocale focalizată pe un singur neuron inervat YFP pozitiv TPH a fost utilizată pentru a confirma inervația YFP și pentru a diferenția fibrele care se termină pe neuronul pozitiv TPH de fibrele trecătoare. Doar inervația neuronului PPG foarte rar a fost detectată la nivelul DR ventral (Figura S4).
Marcare imunohistochimică pentru YFP la neuronii YFP - PPG (verzi) și 5-HT în neuronii serotoninergici (roșii) în secțiuni coronare prin nucleul DR al șoarecilor YFP - PPG. Micrografii cu mărire redusă care arată extinderea rostro-caudală a DR examinat (A-C). Grupurile de corpuri de celule roșii 5-HT-imunoreactive sunt prezentate la mărire mai mare în D-I. Mărirea mai mare a subregiunii dorsale a DR este afișată în D-E și a subregiunii laterale în G-I. Pentru fiecare dintre aceste subregiuni, exemple de neuroni individuali TPH pozitivi care primesc inervație marcată cu YFP de la neuroni producători de GLP-1 sunt prezentate în colțul din stânga jos al fiecărui panou. Inervația neuronilor individuali aleși a fost confirmată prin crearea unei reconstrucții tridimensionale a imaginilor Z-stack (Fig. S3). Niveluri ridicate de fibre YFP imunoreactive se găsesc atât în secțiunile dorsolaterale, cât și în cele dorsale ale DR, dar nu și în secțiunea ventrală (Fig. S4).
Discuţie
Rezultatele prezentate aici demonstrează că semnalizarea serotoninei cerebrale intacte este esențială pentru menținerea pierderii în greutate indusă de activarea GLP-1R. Cursul de timp și contribuția specifică a receptorului serotoninei descoperite aici sunt neașteptate, dar în concordanță cu literatura recent apărută (39). Mai mult, rezultatele congruente ale studiilor electrofiziologice, imunohistochimice și neurofarmacologice plasează DR pe harta creierului a siturilor afectate direct de GLP-1 pentru a regla homeostazia energetică.
Mai mult, chiar dacă blocarea receptorilor 5HT2A sau 5HT2C nu a modificat în mod semnificativ răspunsurile de hrănire și scădere în greutate (21M, avi)
- Compoziția Neuromultivității, recenzii și analogi
- Comparație între administrarea centrală și periferică a C75 la consumul de alimente, greutatea corporală și
- Cougar v Câinele ciobanesc din Asia Centrală (Alabai) - Carnivora
- Uitați de Boot Camp, taberele POOP sunt cele mai recente noutăți de pierdere în greutate Comedie Central UK
- Forever Green introduce Ketopia pentru pierderea în greutate trezirile naturale South Central Pennsylvania