Ji Zhou
1 Centru de Medicină a Reproducerii, Spitalul Jinling, Școala Clinică a Colegiului Medical, Universitatea Nanjing, Nanjing, Republica Populară Chineză,
Li Chen
1 Centru de Medicină a Reproducerii, Spitalul Jinling, Școala Clinică a Colegiului Medical, Universitatea Nanjing, Nanjing, Republica Populară Chineză,
Jie Li
2 Departamentul de Neurochirurgie, Spitalul Jinling, Școala Clinică a Colegiului Medical, Universitatea Nanjing, Nanjing, Republica Populară Chineză,
Hongjun Li
3 Departamentul de Urologie, Spitalul Colegiului Medical al Uniunii din Beijing, Academia Chineză de Științe Medicale și Colegiul Medical al Uniunii din Beijing, Beijing, Republica Populară Chineză,
Zhiwei Hong
1 Centru de Medicină a Reproducerii, Spitalul Jinling, Școala Clinică a Colegiului Medical, Universitatea Nanjing, Nanjing, Republica Populară Chineză,
Min Xie
1 Centru de Medicină a Reproducerii, Spitalul Jinling, Școala Clinică a Colegiului Medical, Universitatea Nanjing, Nanjing, Republica Populară Chineză,
Shengrong Chen
1 Centru de Medicină a Reproducerii, Spitalul Jinling, Școala Clinică a Colegiului Medical, Universitatea Nanjing, Nanjing, Republica Populară Chineză,
Bing Yao
1 Centru de Medicină a Reproducerii, Spitalul Jinling, Școala Clinică a Colegiului Medical, Universitatea Nanjing, Nanjing, Republica Populară Chineză,
Conceput și proiectat experimentele: JZ BY. A efectuat experimentele: JZ JL HJL. Analiza datelor: JZ JL HJL. Reactivi/materiale/instrumente de analiză contribuite: ZWH MX SRC. Am scris lucrarea: JZ LC JL HJL BY.
Date asociate
Toate datele relevante se găsesc în lucrare.
Abstract
Introducere
Conform statisticilor raportate, aproximativ unul din șase cupluri este infertil, dintre care aproape jumătate se atribuie factorilor masculini [1]. Principalele manifestări clinice ale infertilității masculine includ reducerea numărului de spermatozoizi (oligozoospermia), scăderea motilității spermei (astenospermia) și anomaliile morfologice ale spermei (teratozoospermia) [2,3]. Peste 85% dintre bărbații infertili pot produce de fapt spermă [4], dar spermatozoizii lor sunt adesea incapabili să fertilizeze un ovul.
Unele rapoarte de cazuri clinice indică faptul că pH-ul materialului seminal al astenospermiei masculine s-ar fi modificat [11,25]. Cu toate acestea, dacă și cum pH-ul materialului seminal afectează mișcarea și capacitatea spermei rămâne neclar. Înțelegerea efectelor pH-ului plasmatic seminal poate fi utilă pentru tratamentul clinic al infertilității. Prin urmare, am investigat modificările motilității și viabilității spermei într-un interval de pH relevant din punct de vedere biologic și am măsurat activitatea Na +/K + -ATPase corespunzătoare și modificările intracelulare ale Ca 2+ ale spermatozoizilor.
Materiale și metode
Colectarea spermei
Acest studiu a fost aprobat de Comitetul de Etică al Spitalului Nanjing Jinling și în conformitate cu orientările naționale și internaționale. Un total de 136 de voluntari de sex masculin au participat la acest studiu, cu o vârstă medie de 27,54 ± 3,98 (medie ± deviație standard). Înainte de inițierea studiului, a fost obținut consimțământul scris în scris de la toți participanții. Spermatozoizii supuși analizelor provin de la voluntari sănătoși de sex masculin. Acești bărbați aveau fertilitate și calitate normală a materialului seminal, conform criteriilor Organizației Mondiale a Sănătății (2010). Probele de material seminal au fost obținute prin masturbare după cel puțin 3 zile de abstinență.
Probele au fost ejaculate în recipiente sterile și lăsate să se lichefieze timp de cel puțin 30 de minute înainte de a fi procesate prin centrifugare într-un gradient Percoll de 60% (GE Healthcare, Waukesha, WI, SUA) pentru a îndepărta plasma seminală, celulele germinale imature și non-spermatozoizii. celule (în principal celule epiteliale), așa cum este descris de Loredana-Gandini și colab. [26,27]. Spermatozoizii purificați au fost apoi spălați în soluție nutrițională de spermă (NaCI 670,8 mg; KCl 35,6 mg; 147 mg/ml CaCl2 · 2H2O 171 μL; KH2PO4 16,3mg; MgSO4 · 7H2O 29,3 mg; NaHCO4 210,6 mg; D-glucoză 100 mg; 60 % Na · lactat 0,37 ml; HEPES 238 mg; Penicilină 6 mg, dizolvat în 100 ml apă sterilă) de 3 ori înainte de analiza ulterioară. Toate experimentele următoare au folosit spermă purificată grupată de la 3-4 voluntari repartizați în patru grupuri și toate experimentele au fost efectuate cel puțin în trei replici.
Evaluarea motilității spermei
Spermatozoizii purificați au fost resuspendați în soluție nutritivă de spermă cu pH 5,2, 6,2, 7,2 și 8,2 și incubați timp de 15, 30, 60, 90 și respectiv 120 de minute. Analiza semenului asistată de computer (CASA; WLJY-9000; Weili New Century Technology Development Co., Ltd.; Beijing; China) a fost utilizată pentru a evalua motilitatea spermei. Motilitate neprogresivă (NP, toate celelalte tipare de motilitate cu absența progresiei), motilitate progresivă (PR, spermatozoizii care se deplasează activ, fie liniar, fie într-un cerc mare, indiferent de viteză), motilitate (PR + NP), traiectorie medie viteza (VAP, viteza peste o cale netezită calculată), viteza curbiliniară (VCL, viteza peste pista reală a spermei, inclusiv toate abaterile de mișcare a capului spermei), viteza liniei drepte (VSL, viteza peste distanța dintre linie dreaptă între început și sfârșitul pistei spermatozoizilor) au fost calculate pentru fiecare grup din cele trei înregistrări a cel puțin 100 de spermatozoizi.
Test VOC
Testul HOS a fost utilizat în evaluarea viabilității spermei. Spermatozoizii au fost resuspendați în soluție nutrițională de spermă cu pH 5,2, 6,2, 7,2 și respectiv 8,2, timp de 60 de minute și centrifugați la 760 g timp de 15 minute. Lichidul supernatant a fost aruncat și precipitatul a fost amestecat cu 0,5 mL soluție de umflare (0,735 g citrat de sodiu dihidrat și 1,351 g D-fructoză dizolvată în 100 mL apă purificată) urmată de incubare timp de 30 min la 37 ° C. După incubare, peste 200 de spermatozoizi au fost examinați de CASA. Conform criteriilor Organizației Mondiale a Sănătății (2010), numărul de cozi de spermă umflate și, respectiv, neumflate au fost înregistrate [28].
Testul contorului de penetrare a spermei (SPM)
Capilarele pline de soluție nutritivă de spermă cu pH diferit au fost inserate perpendicular în eprubete care conțin 200 μL de lichid spermatic (spermă umană purificată în soluție nutritivă de spermă). Partea superioară a pipetelor capilare și deschiderea eprubetelor au fost sigilate cu folie de etanșare urmată de incubare timp de 1 oră la 37 ° C. Conform criteriilor Organizației Mondiale a Sănătății (2010), distanța de mișcare a spermei a fost măsurată la microscopul optic (CX31; OLYMPUS; Japonia).
Analiza Na +/K + -ATPase
Spermatozoizii (10 7) au fost diluați cu 2 ml soluții nutritive pentru spermatozoizi la pH 5,2, 6,2, 7,2 și respectiv 8,2, amestecați energic și incubați timp de 60 min la 37 ° C într-un incubator cu 5% CO2. Tuburile au fost centrifugate la 760 g timp de 15 min pentru a îndepărta soluția nutrițională, iar precipitația a fost spălată cu soluție salină normală de 3 ori și lizată prin ultrasunete (4 ° C, 40% din energie, sonicată timp de 5 s, opriți pentru 5 s, un ciclu de 1 min) (VCX750; Sonics; SUA). Concentrația de proteine a fost determinată prin testul acidului bicinchoninic (BCA) (produs nr. 23225, Thermo, SUA). Activitatea Na +/K + -ATPase a spermei a fost măsurată prin trusa de măsurare Na +/K + -ATPase (Nanjing Jiancheng Bioengineering Inc.), iar unitatea a fost demonstrată ca μmolPi/mg prot/oră.
Analiza intracelulară Ca 2+
Nivelul de Ca 2+ intracelular al spermatozoizilor a fost determinat prin citometrie în flux (FCM) și microscopie cu scanare confocală laser (LSCM).
Spermatozoizii au fost incubați în medii de capacitate (soluții nutritive ale spermatozoizilor cu 10 mg/ml albumină serică bovină (BSA; Nr. A8806; Sigma; SUA]) [29], la pH 5,2, 6,2, 7,2 și respectiv 8,2. După incubare timp de 3,5 h la 37 ° C într-un incubator cu 5% CO2, 200 μL de supernatant conținând sperma capacitată au fost luate și ajustate la concentrația de spermă de 2 × 106/ml. Aceste probe au fost preparate pentru testul Ca 2+ intracelular al spermei.
Pe scurt, 200 μL spermă în soluție de condensare au fost centrifugate la 3.000 rpm timp de 5 minute; supernatantul a fost aruncat, iar spermatozoizii au fost resuspendați în 300 μL 0,01 mol/L PBS (Ca 2+ și Mg 2+ plus). Probele au fost apoi incubate cu 2 μM Fluo3-AM (Molecular Probe Inc. SUA) timp de 30 de minute la 37 ° C, spălate cu PBS și în cele din urmă resuspendate în 1 ml PBS cu Ca 2+ și Mg 2+ .
Eșantionul de material seminal suspendat colorat cu Fluo3-AM (0,8 ml) a fost analizat de FCM pe un FACS Calibur (Becton Dickinson, SUA). Un total de 20.000 de celule au fost măsurate pentru fiecare probă și s-a obținut intensitatea fluorescenței fiecărui spermatozoid individual. Modificările Ca2 + intracelular au fost exprimate ca fluorescență medie împărțită la fluorescența de fond. Datele obținute au fost analizate în cele din urmă de software-ul Cell Quest (versiunea 3.2.1, Becton Dickinson Immunocytometry Systems, Silicon Valley, CA).
LSCM (ZEISS LSCM510, Germania) a fost, de asemenea, utilizat pentru a măsura intensitatea relativă a fluorescenței în spermoplasma individuală adăugată cu Fluo3-AM. Fluorescența a fost înregistrată la lungimea de undă de excitație de 488 nm și lungimea de undă de emisie de 530 nm. Seria temporală de secțiuni optice ale unei celule a fost obținută cu o etapă XY. Măsurătorile fluorescenței pentru diferite câmpuri vizuale au fost efectuate sub obiectivul de 400 ×, iar intensitatea medie a fluorescenței tuturor celulelor de spermă dintr-un câmp vizual a fost utilizată pentru a reprezenta intensitatea fluorescenței acestui eșantion de material seminal.
analize statistice
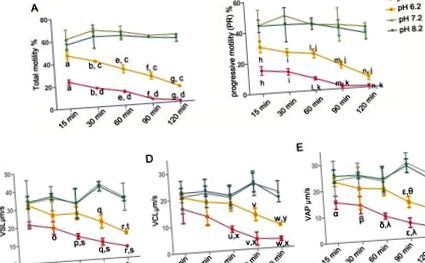
Software-ul SPSS 13.0 (SPSS Inc., Chicago IL, SUA) a fost utilizat pentru evaluarea statistică. Regresia liniară a fost utilizată pentru a estima relația dintre mișcarea spermei și rata HOS. Alte rezultate (motilitate, PR, rata HOS, SPM, Na +/K + -ATPază și concentrații intracelulare de Ca 2+) au fost comparate utilizând metoda ANOVA unidirecțională, iar omogenitatea varianței a fost testată înainte (cu 0,1 ca test standard efectuat test Levene). Când s-au presupus varianțe egale, s-a selectat testul LSD. În caz contrar, a fost efectuat un test T3 al lui Dunnett. Datele au fost exprimate ca medii ± deviație standard. Diferențele au fost considerate semnificative statistic atunci când p Fig 1A, motilitatea totală a spermatozoizilor a scăzut doar ușor pe parcursul întregii perioade de incubație de 120 min (pH 7,2: 59,86 ± 0,85%; pH 8,2: 56,52 ± 3,30%) în pH 7,2 și 8,2 nutrienți soluții. În schimb, mediul acid (pH 5,2 și 6,2) a redus semnificativ procentul de spermatozoizi mobili total într-o manieră dependentă de timp. Mai mult, mediul acid (pH 5,2 și 6,2) a scăzut, de asemenea, PR-ul spermei (Fig. 1B). Parametrii de viteză (VSL, VCL și VAP) au fost de asemenea evaluați (Fig. 1C, 1D și 1E). Parametrii de viteză au fost similari cu PR-ul spermei, adică mediul acid (pH 5,2 și 6,2) a scăzut VSL, VCL și VAP al spermei.
Spermatozoizii umani purificați au fost incubați în soluții nutritive cu pH 5,2, 6,2, 7,2 și 8,2 timp de 15, 30, 60, 90 și respectiv 120 min. (A) Mobilitatea spermei (PR + NP): a, b, e-g p c p d p h, i, l-n p j p k p o-r p t p s p u-w p y p x p α, β, δ, ε, η p θ p λ p Fig 2B). Mai mult, relația dintre rata HOS și mișcarea spermei în pH diferit a fost analizată la 60 de minute. S-a găsit o corelație pozitivă pentru motilitatea totală a spermei (r = 0,98, p Fig. 3A). Același lucru a fost valabil și pentru corelația dintre rata HOS și PR a spermei (r = 0,98, p Fig 3B).
Comparativ cu grupul cu pH 7,2, altitudinea ascendentă a spermatozoizilor în grupurile cu pH 5,2 și 6,2 a fost semnificativ mai scăzută * Activitatea p p/K + -ATPase a scăzut în mediile acide
Comparativ cu pH 7,2, activitatea spermei Na +/K + -ATPase a scăzut evident la pH 5,2 sau 6,2, în timp ce nu au existat diferențe semnificative cu cea la pH 8,2. * p 2+] i în timpul capacităților spermatozoizilor umani
Fig. 6 arată nivelul intracelular de Ca 2+ al spermatozoizilor din soluțiile de capacitate a spermei la pH diferit, au fost analizați de FCM. Intensitatea fluorescenței Ca2+ intracelulară (264,15 ± 81,57) a fost maximă la pH 7,2. Comparativ cu pH 7,2, intensitățile de fluorescență ale Ca 2+ intracelular în alte grupuri (132,55 ± 40,11 la pH 5,2; 162,76 ± 34,34 la pH 6,2) au scăzut semnificativ, cu excepția pH-ului 8,2 (234,82 ± 55,24).
(A), rezultatele FCM ale spermatozoizilor în soluții nutritive ale spermatozoizilor la pH 5,2, 6,2, 7,2 și respectiv 8,2. (B), comparativ cu grupul cu pH 7,2, intensitatea fluorescentă medie a Ca 2+ intracelular în grupurile cu pH 5,2 și 6,2 a scăzut semnificativ, dar grupul cu pH 8,2 nu a prezentat diferențe semnificative. * p 2+ a atins maximul la pH 7,2 (200,87 ± 27,43; Fig 7). Semnalele fluorescente slabe au fost observate în citoplasma spermei atât la pH 5,2 (147,93 ± 32,90), cât și la 6,2 (152,18 ± 38,05), sugerând că mediul acid duce la o concentrație semnificativ mai mică de Ca 2+ intracelular și afectează capacitatea spermei.
(A), rezultatele LSCM ale spermatozoizilor în soluții nutritive ale spermatozoizilor la pH 5,2, 6,2, 7,2 și respectiv 8,2. (B), comparativ cu grupul cu pH 7,2, intensitatea fluorescentă medie a Ca 2+ intracelular în grupurile cu pH 5,2 și 6,2 a scăzut semnificativ, dar grupul cu pH 8,2 nu a prezentat diferențe semnificative. * p 0,05) [12]. Acest raport nu a fost de acord cu concluziile noastre, posibil pentru că au existat doar 39 de bărbați în grupul de hipomotilitate, iar ceilalți factori, cum ar fi fosfatul anorganic și concentrațiile de calciu ionizat, ar putea fi principalul factor în determinarea fertilizării spermei. Studiul nostru, cu eliminarea altor factori, ar putea ilustra mai bine efectul pH-ului asupra motilității spermei umane.
Calciul este important pentru motilitatea spermei, metabolismul, reacția acrosomică, motilitatea hiperactivată și fertilizarea [46]. Modificările concentrației intracelulare de Ca 2+ sunt asociate cu diferite aspecte ale funcției spermei [12]. Fluxul masiv de Ca 2+ și Ca 2+ induc motilitatea hiperactivată a spermei în timpul reacției acrosomice [47,48]. Când sperma hiperactivată este transferată în mediu fără Ca 2+ timp de 30-60 min, mișcarea hiperactivată se oprește, dar adăugarea a 2 mM Ca 2+ restabilește motilitatea hiperactivată [49]. Ca 2+ poate spori amplitudinea bătăii flagelare a spermei și există o relație directă între nivelul intracelular de Ca 2+ și mișcarea hiperactivată [50,51]. S-a raportat că Na +/K + -ATPaza a fost capabilă să participe la homeostazia intracelulară a calciului [23,52], iar activitatea sa a crescut în timpul capacităților [53]. Rezultatele noastre au arătat că activitatea scăzută a Na +/K + -ATPazei în mediu cu pH 5,2 și 6,2 ar afecta capacitatea spermei. După măsurarea nivelului de Ca 2+ intracelular, am constatat că nivelul de Ca 2+ intracelular a fost redus dramatic sub pH 5,2 și 6,2 față de pH 7,2, ceea ce poate duce la scăderea activității Na +/K + -ATPazei, și apoi scăzută Aflux de Ca 2+. În condiții scăzute de Ca 2+, reacția acrosomică nu poate fi inițiată, afectând în cele din urmă fertilizarea.
Rezultatele noastre au arătat că pH-ul materialului seminal a afectat motilitatea spermei, ceea ce implică faptul că pH-ul micromediului vaginal la femei poate afecta și activitatea spermei. După ejaculare, sperma trece tractul reproductiv feminin cu plasmă seminală; prin urmare, spermatozoizii sunt vulnerabili la diverse substanțe chimice atât în materialul seminal, cât și în tractul reproductiv feminin, iar aceste substanțe chimice pot afecta direct motilitatea și metabolismul spermatozoizilor și apoi influențează tot procesul de capacitare și fertilizare [54]. Modificarea pH-ului nu se produce numai în materialul seminal masculin, ci și în vaginul feminin sub infecții, cum ar fi tricomoniaza, vaginoza bacteriană și vaginoza citolitică [55], care pot afecta motilitatea și capacitatea spermei și pot duce chiar la infertilitate.
Concluzii
În concluzie, am constatat că condițiile ușor alcaline par să stimuleze motilitatea și capacitatea spermei umane. Scăderea dramatică a activității Na +/K + -ATPază cauzată de mediul acid ar putea fi motivul motilității mai scăzute a spermei și a nivelului de Ca 2+, care a afectat în cele din urmă sarcina. Cu toate acestea, mecanismele pH-ului care afectează activitatea Na +/K + -ATPase în spermatozoizii umani nu sunt complet elucidate. Pe lângă faptul că afectează Na +/K + -ATPaza, mediul acid poate să afecteze direct membrana celulei spermei sau să crească conținutul de oxigen activ, afectând astfel motilitatea și capacitatea spermei, care justifică explorări ulterioare.
- Aceasta este povestea Jizz-ului tău - 21 fapte uimitoare despre material seminal și spermă - Fistfy
- Înghițirea semințelor Siguranță, beneficii și riscuri
- O lingură de spermă
- Studiul relevă modul în care motivația afectează nutriția și dieta EurekAlert! Știri științifice
- Care este conexiunea Înțelegerea modului în care greutatea afectează grăsimile din sânge Thorne