Henry J. Haiser
1 Facultatea de Arte și Științe (FAS) Center for Systems Biology, Harvard University, Cambridge, MA, 02138
David B. Gootenberg
1 Facultatea de Arte și Științe (FAS) Center for Systems Biology, Harvard University, Cambridge, MA, 02138
Kelly Chatman
1 Facultatea de Arte și Științe (FAS) Center for Systems Biology, Harvard University, Cambridge, MA, 02138
Gopal Sirasani
2 Departamentul de chimie și biologie chimică, Universitatea Harvard, Cambridge, MA 02138
Emily P. Balskus
2 Departamentul de chimie și biologie chimică, Universitatea Harvard, Cambridge, MA 02138
Peter J. Turnbaugh
1 Facultatea de Arte și Științe (FAS) Center for Systems Biology, Harvard University, Cambridge, MA, 02138
Date asociate
Abstract
În ciuda numeroaselor exemple de efecte ale microbiomului gastrointestinal uman asupra eficacității și toxicității medicamentelor, există adesea o înțelegere incompletă a mecanismelor de bază. Aici, disecăm inactivarea digoxinei medicamentului cardiac de către intestin Actinobacterium Eggerthella lenta. Profilarea transcripțională, genomica comparativă și testele bazate pe cultură au relevat un operon care codifică citocromul reglat în sus de digoxină, inhibat de arginină, absent în tulpinile de E. lenta nemetabolizante și predictiv al inactivării digoxinei de către microbiomul intestinal uman. Studiile farmacocinetice folosind șoareci gnotobiotici au arătat că proteinele dietetice reduc metabolismul microbian in vivo al digoxinei, cu modificări semnificative ale concentrației medicamentului în ser și urină. Aceste rezultate subliniază importanța vizualizării farmacologiei atât din perspectiva genomului nostru uman, cât și a celui microbian.
Textul principal
Oamenii găzduiesc comunități microbiene mari și diverse, dintre care cea mai abundentă rezidă în tractul gastro-intestinal. Studii recente au evidențiat relevanța clinică a biotransformărilor catalizate de microbiomul intestinal uman, inclusiv modificări ale biodisponibilității, activității și toxicității medicamentelor terapeutice (1, 2). Deși> 40 de medicamente sunt metabolizate de microbiomul intestinal, se știe puțin despre mecanismele de bază. Aceste cunoștințe sunt esențiale pentru a permite proiectarea rațională a intervențiilor farmaceutice sau dietetice.
Inactivarea medicamentului cardiac digoxină oferă un punct de plecare promițător pentru înțelegerea metabolismului microbian al medicamentului. Digoxina și alte glicozide cardiace sunt utilizate pe scară largă de sute de ani pentru a trata insuficiența cardiacă și aritmiile. Efectele terapeutice se realizează indirect atunci când inhibarea Na +/K + ATPazei în miocitele cardiace crește concentrația intracelulară de Ca 2+ (3). Digoxina are un domeniu terapeutic restrâns (0,5-2,0 ng/ml) (3), iar unii pacienți excretă metabolitul digoxinei inactive, dihidrodigoxina, în care inelul lactonic este redus (fig. S1A) (4). Această modificare întrerupe planaritatea inelului, despre care se crede că schimbă poziționarea în buzunarul de legare al Na +/K + ATPase, rezultând o afinitate țintă scăzută (5). Administrarea concomitentă de antibiotice cu spectru larg crește digoxina serică (4), iar Eggerthella lenta reduce digoxina in vitro (6). Înainte de această lucrare, mecanismul molecular al reducerii digoxinei și factorii care modifică inactivarea microbiană a medicamentelor in vivo erau necunoscuți.
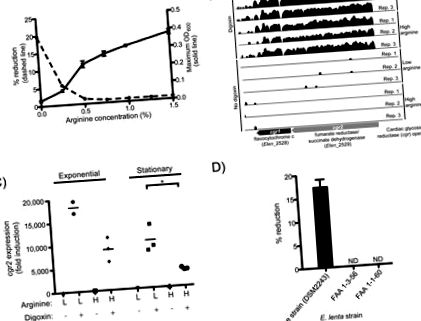
Am confirmat că E. lenta DSM2243, tipul de tulpină, reduce digoxina in vitro (7) și că arginina inhibă această reacție (Fig. 1A). Creșterea E. lenta DSM2243 a fost stimulată prin suplimentarea cu arginină (Fig. 1A, S2), indicativ al utilizării căii argininei dihidrolazei pentru ATP (8). Citrulina (un intermediar în amonte de producția de ATP) a stimulat creșterea, în timp ce ornitina (un produs final) nu (fig. S2, S3).
(A) Arginina stimulează creșterea E. lenta DSM2243 in vitro în timp ce blochează reducerea digoxinei. OD600 maxim (linie continuă; valorile sunt media ± sem; n = 3) și eficiența de reducere a digoxinei% (linie punctată; valorile sunt media; n = 2) după 48 de ore de creștere. (B) Profilurile ARN-Seq ale operonului c ardiac g licozid r eductază (cgr) sunt prezentate cu/fără digoxină în timpul creșterii exponențiale în mediu care conține arginină scăzută/ridicată. Înălțimea este proporțională cu jurnalul natural al numărului de citiri neechivoce de secvențiere mapate la fiecare bază. (C) transcrierea cgr2 determinată de qRT-PCR. Asteriscurile indică semnificația statistică prin testul t Student (P 100 de ori; Fig. 1B, tabelele S2, S3). Aceste două gene, denumite aici sub numele de operon c ardiac g lycoside r eductază (cgr) (etichete genetice: cgr1 și cgr2), codifică proteine care sunt omoloage cu citocromii bacterieni și, prin urmare, sunt potențial capabili să folosească digoxina ca acceptor alternativ de electroni. Incubația E. lenta cu glicozide cardiace multiple și formele reduse ale acestora a relevat că operonul cgr răspunde în general la compușii cu un inel α, β-nesaturat de butirolactonă (fig. S7-9, tabelul S5).
Inducția digoxinei a crescut în condiții de arginină scăzută atât în faza exponențială cât și în cea staționară, în raport cu culturile expuse la niveluri ridicate de arginină (fig. S10A, B). inducerea cgr prin digoxină și efectele dependente de faza de creștere exercitate de arginină au fost confirmate pe probe independente folosind qRT-PCR (Fig. 1C, S7C, tabelul S4). Spre deosebire de arginină, ornitina nu a reprimat expresia cgr2 (fig. S11). Aceste rezultate sunt în concordanță cu ipoteza că arginina reprimă expresia operonului cgr, inhibând astfel reducerea digoxinei.
Apoi, am testat trei tulpini de E. lenta (DSM2243, FAA 1-3-56 și FAA 1-1-60) (9, 10), pentru reducerea digoxinei; tipul de tulpină a fost singura tulpină capabilă să reducă in vitro digoxina (Fig. 1D). Genomica comparativă a arătat că tipul de tulpină era aproape indistinguibil de celelalte două tulpini folosind gene marker comune (Fig. S12). Comparațiile reciproce BLASTP ale tuturor secvențelor de codificare a proteinelor din cele trei tulpini E. lenta complet secvențate au arătat că tipul de tulpină împărtășea 79,4% și 90,5% din proteomul său cu tulpinile FAA 1-3-56 și respectiv FAA 1-1-60 ( Fig. S12). Operonul cgr a fost unic pentru tulpina de tip (tabelul S6); în plus, celor două tulpini nereducătoare de E. lenta le lipseau trei loci genomici, care au fost, de asemenea, reglate în sus de digoxină și se preconizează că codifică transportorii de membrană pentru absorbția moleculelor mici și a glicozidelor (Fig. S13). Arginina nu a scăzut semnificativ nivelul de expresie al acestor transportori (fig. S14).
Un model extins de farmacocinetică a digoxinei apare acum: colonizarea prin tulpini distincte de E. lenta, interacțiunile microbiene și dieta gazdă acționează împreună pentru a influența nivelurile medicamentelor (Fig. S19). Sunt necesare studii de urmărire la pacienții cardiaci pentru a determina dacă evaluările rapide ale biomarkerului bazat pe qPCR ale microbiomului intestinal pot ghida regimurile de dozare. De asemenea, ar putea fi posibil să se furnizeze ghiduri dietetice sau suplimente care să prevină metabolismul microbian al medicamentelor. Mai pe larg, rezultatele noastre subliniază faptul că o viziune cuprinzătoare a farmacologiei include structura și activitatea comunităților microbiene rezidente și o înțelegere mai profundă a interacțiunilor lor între ele, cu habitatul lor gazdă și cu mediul nutrițional al tractului gastrointestinal.
Material suplimentar
Mulțumiri
Bogdan Budnik și Sunia Trauger pentru analize LC/MS; Vladimir Yeliseyev, Alice Liou și Rachel Carmody pentru studii la șoareci; Claire Reardon și Christian Daly pentru sprijinirea secvențierii; Corinne Maurice, Lawrence David, Rachel Dutton, Ben Wolfe, Julie Button, Marie Elliot, Yves Falanga, Richard Losick, Andrew Murray și Bodo Stern pentru discuții utile. Experimentele cu șoareci au fost făcute cu sprijinul generos al Centrului de boli digestive de la Harvard și al nucleelor gnotobiotice ale Universității din Carolina de Nord. Această lucrare a fost susținută de subvenții de la Institutele Naționale de Sănătate (P50 GM068763) și Centrul de Boli Digestive de la Harvard (2P30DK034854-26). HJH este susținut de Institutele Canadiene de Cercetare în Sănătate (MFE-112991). Datele RNA-Seq sunt depozitate în baza de date Genn Expression Omnibus (GEO) (accesare> GSE43919).
- Ne pare rău Veganii Aici; s Cum mâncarea cărnii ne-a făcut să fim oameni
- Obezitatea accelerează îmbătrânirea ficatului uman; Lupta împotriva îmbătrânirii!
- Rusia apără drepturile omului și explodează Occidentul; stadnards duble; Știri mondiale
- Punerea țânțarilor de sex feminin pe medicamentele de dietă umană ar putea reduce răspândirea bolii - ScienceDaily
- Obezitatea și dependența Natura Comportamentul uman