Secția 1 Farmacologie clinică și chimioterapie și 2 Chirurgie # 7, N.N. Blokhin Russian Cancer Research Center, Moscova, Rusia
* Autor corespondent: Ilya Pokataev
Departamentul de Farmacologie Clinică și Chimioterapie
115478, 24 Kashirskoe shosse, Moscova, Rusia
Tel: +7 499 3249259
Fax: +7 499 3249834
E-mail: [e-mail protejat]
Primit 22 martie 2017-Admis 04 mai 2017
Abstract
Cuvinte cheie
Nomograme; Neoplasme pancreatice
INTRODUCERE
Se estimează că 337.800 de persoane au fost diagnosticate cu cancer pancreatic în întreaga lume în 2012; peste 330.000 de pacienți au cedat din cauza acestei boli [1]. Mai mult, incidența cancerului pancreatic tinde să crească. Se așteaptă ca boala să ocupe locul al doilea în mortalitatea prin cancer în Statele Unite până în 2030 [2].
FOLFIRINOX, gemcitabina în combinație cu nabpaclitaxel sau gemcitabină în monoterapie sunt regimuri actuale de primă linie pentru tratamentul cancerului pancreatic avansat local și metastatic [3, 4]. Dimpotrivă, regimurile de chimioterapie de linia a doua pentru această boală nu sunt standardizate. Majoritatea pacienților nu primesc chimioterapie secundară, în principal datorită deteriorării rapide a stării de performanță după progresia cancerului [5, 6]. Alți factori clinici relevanți, cum ar fi eficacitatea chimioterapiei anterioare, locurile și dimensiunile leziunilor, pierderea în greutate și parametrii de laborator, nu sunt de obicei luați în considerare.
Toate regimurile curente de linia a doua au o eficacitate modestă: rata de răspuns obiectivă este de obicei sub 10% [7], supraviețuirea mediană fără progresie este de aproximativ 2 luni [5]. Prin urmare, pacienții trebuie selectați cu atenție pentru chimioterapie și există o nevoie medicală nesatisfăcută pentru un model predictiv care să faciliteze selectarea pacienților pentru chimioterapia de linia a doua.
MATERIAL SI METODE
Pacienți
Înregistrările pacienților cu cancer pancreatic care fuseseră tratați la secția de farmacologie clinică și chimioterapie din N.N. Centrul rus de cercetare a cancerului Blokhin din 2000 până în 2015 a fost analizat. Criteriile de eligibilitate pentru această analiză retrospectivă au fost: 1) cancer pancreatic local avansat/metastatic sau recurent confirmat morfologic, 2) progresia bolii în termen de 6 luni după ultimul ciclu de chimioterapie de primă linie sau chimioterapie adjuvantă.
ANALIZE STATISTICE
Valoarea prognostică a tuturor factorilor menționați mai sus a fost evaluată prin modelul de pericole proporționale Cox univariat cu supraviețuirea globală (OS) ca obiectiv. OS a fost calculat de la data progresiei în urma chimioterapiei anterioare până la deces sau ultimul contact cu un pacient pentru cazurile cenzurate. Metoda Kaplan-Meier a fost utilizată pentru a evalua sistemul de operare. Nivelurile limită ale factorilor cantitativi au fost alese folosind analiza curbelor ROC. Rata de supraviețuire de trei luni a fost selectată ca obiectiv pentru analiza curbei ROC.
Factorii, care au demonstrat un impact semnificativ statistic asupra sistemului de operare în funcție de rezultatele analizelor univariate, au fost analizați în continuare în modelul de pericole proporționale Cox multivariat cu excluderea treptată a variabilelor. Factorii care au prezentat un impact semnificativ statistic asupra SO au fost considerați factori de prognostic independenți. Modelul de prognostic a fost construit pe baza acestor factori care dicotomizează pacienții în grupuri cu prognostic slab sau favorabil. Raporturile de pericol pentru fiecare factor de prognostic independent au fost luate în considerare pentru calcularea scorului de prognostic. Apoi, impactul chimioterapiei de linia a doua asupra supraviețuirii globale a fost evaluat cu stratificare în două grupuri de prognostic.
Analiza statistică a datelor a fost realizată folosind Microsoft Excel 2007 și IBM SPSS Statistics v. 20.
REZULTATE
Caracteristicile pacienților
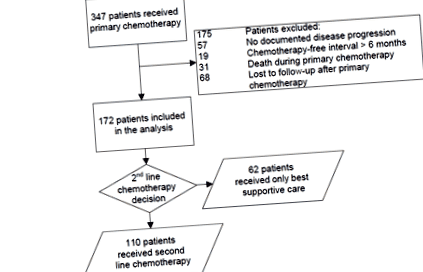
Un total de 347 de pacienți au primit chimioterapie primară. Dintre aceștia 172 de pacienți au îndeplinit criteriile de includere pentru prezenta analiză (figura 1). OS median în întreaga cohortă de pacienți a fost de 3,4 luni (interval confidențial 95% (IC) 2,8-4,0 luni). Caracteristicile pacienților incluși sunt prezentate în tabelul 1.
figura 1. Organigrama pacienților.
Factorii pronosticului nefavorabil
Analizele univariate de regresie Cox au arătat că următoarele variabile au avut un impact negativ asupra OS: prezența metastazelor hepatice mai mari de 20 mm în dimensiunea maximă [raportul de pericol (HR) 1,513, IC 95% 1,090-2,101], prezența ascitei [HR 1,941, IC 95% 1,303-2,890], starea de performanță Karnofsky ≤70% [HR 1,818, 95% CI 1,502-2,201], nivel de albumină ULN [HR 1,656, 95% CI 1,122-2,445], hemoglobină ≤11 g/dL [HR 1,404, IC 95% 1,002-1,965], NLR> 5 [HR 1,845, 95% CI 1,236-2,755] și fosfatază alcalină> valoarea de 5 ori mai mare a LSN [HR 2,424, IC 95% 1,374-4,277].
Acești factori au fost analizați în continuare în analiza de regresie Cox multivariată cu excludere variabilă treptată. Rezultatele analizei multivariate sunt prezentate în masa 2.
Doi factori - statutul Karnofsky 70% sau mai puțin și NLR> 5 - s-au dovedit a fi factori de prognostic slab independenți în cancerul pancreatic care progresează după chimioterapia de primă linie. S-au format grupuri de prognostic favorabil (scor 0-1) și slab (scor ≥2) pe baza valorilor HR ale acestor doi factori.
Figura 2 prezintă curbele Kaplan-Meier pentru SO în aceste două grupuri de risc. OS median au fost de 5,0 și 1,8 luni pentru grupurile cu prognostic favorabil și respectiv slab (p 5. NLR este un marker al inflamației. O serie de studii au demonstrat o influență semnificativă a inflamației asupra progresiei tumorii, invaziei și metastazelor [17-19]. A meta-analiza a nouă studii cu 2035 de participanți a demonstrat valoarea prognostică a NLR în cancerul pancreatic primar [20]. Valorile limită ale NLR au variat de la 2 la 5 în aceste nouă studii.
Rezultatele prezentei analize susțin semnificația prognostică a NLR la pacienții cu progresie a bolii după chimioterapie de primă linie. Aceste constatări sunt în concordanță cu cele raportate de Nakachi K și colab. care au demonstrat o valoare prognostică independentă a unui alt marker de inflamație, proteina C reactivă, la pacienții cu progresie după chimioterapie care conține gemcitabină [12].
Pacienții tratați cu chimioterapie de linia a doua și pacienții care au primit BSC au fost incluși doar în prezenta analiză (tabelul 1). Prezența acestui ultim grup ne-a permis să analizăm impactul chimioterapiei asupra SG cu stratificare în două grupuri de prognostic și să o comparăm cu SG a pacienților care nu au primit chimioterapie.
Rezultatele noastre au arătat că chimioterapia de linia a doua poate îmbunătăți rezultatele numai la grupul de prognostic favorabil al pacienților. În grupul cu prognostic slab, chimioterapia de linia a doua nu a reușit să demonstreze un impact semnificativ statistic asupra rezultatului.
Trebuie remarcat faptul că, din cauza numărului limitat de pacienți, beneficiul terapiei de linia a doua nu poate fi exclus în grupul cu prognostic slab. Cu toate acestea, acest beneficiu minim poate fi ușor ruinat de toxicitatea tratamentului. Astfel, în ciuda faptului că chimioterapia de linia a doua îmbunătățește sistemul de operare în comparație cu BSC, pare rațional să se limiteze utilizarea chimioterapiei de linia a doua la pacienții selectați.
CONCLUZIE
A fost dezvoltat un nou model de prognostic pentru pacienții cu cancer pancreatic cu progresie după chimioterapie de primă linie. Natura retrospectivă și un număr mic de pacienți ar trebui considerate ca o limitare a acestei analize. Avantajele acestui model sunt utilizarea parametrilor pe scară largă, disponibili în practica clinică de rutină și capacitatea sa de a servi ca model predictiv al eșecului de chimioterapie de linia a doua.
Conflict de interese
Autorii au declarat că nu există interese concurente.
- Medicina din plante din China prelungește eficient supraviețuirea generală a pacienților cu cancer pancreatic A
- Pacienții cu cancer tratați cu MISTLETOE în speranța că planta poate vindeca boala - Daily Star
- Răspunsul glicemic și rezumatul sănătății unui atelier The American Journal of Clinical Nutrition
- Găsirea cancerului la copii
- Intervenția computerizată de scădere în greutate optimizează timpul personalului rezultatele clinice și de cost ale unui