Jichan Nie
Departamentul de Ginecologie, Obstetrică și Ginecologie Spitalul Universității Fudan, Universitatea Fudan, Shanghai 200011, P.R. China
Xishi Liu
Departamentul de Ginecologie, Obstetrică și Ginecologie Spitalul Universității Fudan, Universitatea Fudan, Shanghai 200011, P.R. China
Abstract
Introducere
Adenomioza este o tulburare ginecologică frecventă caracterizată prin glande endometriale heterotopice și stroma în miometru. Afectează frecvent femeile cu vârsta cuprinsă între 30-50 de ani (1) și cauzează adesea dismenoree, menoragie, metroragie, uter mărit difuz și dispareunie, precum și infertilitate (2,3). Cu toate acestea, mecanismele exacte ale durerii induse de adenomioză sunt încă necunoscute. Prin urmare, tratarea adenomiozei este o provocare majoră. În prezent, terapiile chirurgicale și medicale sunt tratamentul obișnuit al adenomiozei. Pentru adenomioza severă, simptomatică, histerectomia este alegerea tratamentului (4), care poate fi traumatică pentru femeile care doresc să conceapă. În consecință, terapiile medicale, cum ar fi danazolul și agonistul de eliberare a gonadotropinei, sunt importante pentru pacienții care doresc să rămână gravide. Cu toate acestea, dovezile au arătat că există mai multe limitări ale acestor tratamente, inclusiv perioada lungă de tratament, evenimentele adverse severe și recurența frecventă (5). Prin urmare, sunt necesare studii suplimentare privind dezvoltarea unor terapii medicale mai eficiente.
Quercetina (3,3 ′, 4 ′, 5,7-pentahidroxiflavona; greutate moleculară, 302 g/mol), un flavonoid bioactiv este prezent pe scară largă în diverse fructe și legume, inclusiv ceapa, iar cele mai studiate surse primare de quercetină sunt broccoli, mere, culturi de boabe și struguri, și este, de asemenea, în anumite plante, ceai și vin (6,7). Dovezile emergente au demonstrat că quercetina are beneficii potențiale pentru tratamentul cancerului și endometriozei fără acțiuni adverse evidente, cu activități anti-cancerigene, antiinflamatoare, antivirale, anti-oxidante și psiho-stimulante, precum și capacitatea de a inhiba lipidele. peroxidarea, agregarea trombocitelor și permeabilitatea capilară și pentru stimularea biogenezei mitocondriale (8,9). Cu toate acestea, mecanismul de bază al quercetinei care atenuează hiperalgezia generalizată a adenomiozei rămâne slab înțeles. Prin urmare, sunt necesare studii bine concepute pentru a evalua efectul quercetinei asupra adenomiozei.
Obiectivul acestui studiu este de a evalua efectul quercetinei la șoarecii cu regiune de control a amprentării (ICR) cu adenomioză. S-a urmărit investigarea dacă tratamentul cu quercetină a îmbunătățit durerea și a suprimat infiltrarea miometrială a implanturilor endometriale. Am emis ipoteza că quercetina poate reduce hiperalgezia și, de asemenea, poate suprima infiltrația miometrială a endometrului ectopic la șoareci cu adenomioză indusă. Pentru a elucida mecanismul molecular al tratamentului cu quercetină, nivelurile anumitor mediatori importanți în durere, inclusiv receptorul tranzitoriu potențial canal cationic subfamilia V membru 1 (Trpv-1), fosfo (p) -p38 proteină kinază activată cu mitogen (MAPK) și kinaza p-extracelulară reglementată de semnal (ERK), au fost determinate. Studiul nostru anterior a demonstrat că acidul valproic (VPA), un inhibitor al histonei deacetilazei, a îmbunătățit hiperalgezia generalizată și a redus infiltrarea miometrială (10). Prin urmare, VPA a fost utilizat ca indicator pozitiv în prezentul studiu.
Materiale și metode
Produse chimice
Quercetina și VPA (sare de sodiu VPA, nr. Cod P4543) au fost achiziționate de la Sigma-Aldrich (Merck KGaA, Darmstadt, Germania). Toate aceste medicamente au fost dizolvate în 2% dimetil sulfoxid în 0,1 M Na2S04 ajustat la pH 5,0. Citratul de tamoxifen a fost achiziționat de la Fudan Forward Pharmaceutical Company (Shanghai, China).
Animale și tratamente
Șoarecii ICR nou-născuți (ziua 1 după naștere; n = 43) și șoarecii mama lor de naștere (n = 10) au fost cumpărați de la Shanghai Laboratory Animal Corporation (Shanghai, China). Fiecare șoarecă mamă și descendenții ei au fost adăpostiți într-o cușcă în condiții controlate (
20 ° C, ciclu de lumină/întuneric 12:12) și avea acces gratuit la alimente și apă proaspătă.
În urma protocolului Green și colab. (11) și Parrott și colab. (12), șoarecilor nou-născuți li s-a administrat oral 1 mg/kg tamoxifen suspendat în amestec de ulei de arahide/lecitină/lapte condensat (2: 0,2: 3, în volum) la un volum de doză de 5 pl/g greutate corporală din ziua 2 până în ziua 5 după naștere. Șoarecii neonatali de control femele (n = 9), desemnați aleatoriu, au fost hrăniți cu cantitatea echivalentă de solvent, fără tamoxifen. Când șoarecii aveau vârsta de 3 săptămâni, au fost înțărcați și separați de mame, iar șoarecii femele au continuat ca parte a studiului.
Toate experimentele au fost efectuate în conformitate cu ghidurile Consiliului Național de Cercetare Ghidul pentru îngrijirea și utilizarea animalelor de laborator (13) și aprobate de comisia instituțională de examinare a animalelor experimentale din Spitalul de obstetrică și ginecologie din Shanghai, Universitatea Fudan (Shanghai, China).
Protocol de experiment
Șoarecii neonatali dozați cu tamoxifen așa cum s-a descris (n = 34) și 9 șoareci martori au fost dozați numai cu solvent. Începând de la 4 săptămâni după naștere, un șemineu a fost administrat tuturor șoarecilor la fiecare 4 săptămâni, iar greutatea corporală a fost, de asemenea, măsurată și înregistrată. La 16 săptămâni după naștere, toți șoarecii cărora li s-a administrat tamoxifen au fost împărțiți în mod aleatoriu în 4 grupuri, fiecare primind un anumit tratament prin administrare intragastrică zilnică timp de 3 săptămâni după cum urmează: Grupul L (n = 9) a primit o doză mică (25 mg/kg) greutate corporală) tratament cu quercetin; Grupul H (n = 9) a primit un tratament cu quercetină cu doze mari (50 mg/kg greutate corporală); Grupa V (n = 8) a primit tratament VPA (160 mg/kg greutate corporală); Grupul U (n = 8), sau grupul netratat, a primit numai vehiculul. Grupul de șoareci (n = 9) care au fost administrați neonatal numai cu solventul, au fost desemnați ca grup C, nu au primit deloc tratament și au servit drept martor gol. Dozele acestor medicamente au fost determinate pe baza studiilor noastre anterioare și a altor studii (10,14-18).
După cele 3 săptămâni de tratament medicamentos, s-a efectuat testul final al plăcii fierbinți pentru toți șoarecii cu adenomioză indusă și s-a înregistrat și greutatea corporală. Toți șoarecii au fost anesteziați și perfuzați prin aorta ascendentă cu soluție salină caldă (37 ° C) urmată de o soluție caldă compusă din 4% paraformaldehidă și 0,2% acid picric în tampon fosfat 0,1 M. Perfuzia a fost apoi imediat urmată de același fixator (4 ° C). Uterele au fost apoi excizate și au fost post-fixate peste noapte la temperatura camerei în aceeași soluție de fixare, apoi încorporate în parafină pentru examen histopatologic și analiză imunohistochimică. Ganglionii rădăcinii dorsale L6 și S1 (DRG) au fost disecați și țesuturile au fost post-fixate în același fixator timp de 90 de minute la 4 ° C și apoi au fost scufundate în zaharoză 10% în tampon fosfat 0,1 M peste noapte.
Adâncimea infiltrației miometriale a endometrului ectopic a fost evaluată urmând criteriile descrise de Bird și colab. (19). Pe scurt, gradul 1 a fost definit ca fiind cazul când penetrarea endometrului ectopic la miometru superficial, gradul 2 ca penetrare la miometru mediu și gradul 3 ca penetrare dincolo de miometru mediu. Pentru ușurința analizei statistice, gradul 0 de adâncime a fost înregistrat în absența completă a oricărui endometru ectopic în miometru.
Pentru examinarea histologică, s-au obținut secțiuni seriale de 4 mm din fiecare bloc de țesut încorporat în parafină și apoi s-au ales trei secțiuni aleatoriu selectate pentru colorarea hematoxilinei și eozinei (H&E) pentru a confirma diagnosticul patologic. Secțiunile au fost colorate cu 0,6% hematoxilină și 0,5% eozină timp de 5 minute la temperatura camerei. Dacă s-a observat că glandele endometriale și stromele sunt deplasate în miometru, s-a pus un diagnostic de adenomioză.
Procedura de testare a plitei
Testul plăcii fierbinți este o metodă frecvent utilizată pentru măsurarea nocicepției la rozătoare (20) și un test al pragului de răspuns la stimulii termici, reprezentând o formă de durere termică acută (21). În studiul actual, testul plăcii fierbinți a fost efectuat folosind un contor de analgezie placă fierbinte (BME-480; Institutul de Inginerie Biomedicală, Academia Chineză de Științe Medicale, Tianjin, China) constând dintr-o placă metalică de 25 × 25 cm. Suprafața plăcii poate fi încălzită la o temperatură constantă de 55,0 ± 0,1 ° C, măsurată printr-un termometru digital încorporat, iar un cilindru din plastic (20 cm diametru, 18 cm înălțime) a fost așezat pe placă. Șoarecii au fost aduși în sala de testare și li s-a permis aclimatizarea timp de 10 minute înainte de test. Latența de a răspunde stimulilor termici, definită ca fiind timpul (în secunde) scurs de la momentul în care mouse-ul a fost introdus în cilindru până la punctul în care și-a lins labele din spate. Fiecare mouse a fost testat o singură dată într-o singură sesiune. Latența a fost calculată ca medie a două citiri înregistrate la intervale de 24 de ore.
Imunohistochimie
Pentru toate grupurile experimentale, secțiuni de 10 µm grosime ale DRG-urilor fixe L6 și S1 au fost tăiate în serie într-un criostat și montate pe lamele acoperite cu gelatină. Diapozitivele au fost depozitate la -20 ° C înainte de imunocolorare. Secțiunile au fost stinse cu 0,3% H2O2 timp de 10 minute și apoi blocate în 0,3% Triton X-100 în 0,05 M Tris-NaCl cu 10% ser normal de capră (NGS) timp de 1 oră la temperatura camerei. Ulterior, secțiunile au fost incubate cu iepure policlonal anti-TRPV-1 (1: 5.000; nr. Cat. Acc-030; Alomone Labs, Ltd., Ierusalim, Israel), iepure monoclonal anti-p-p38 MAPK (1:50; nr. cat. 4631; Cell Signaling Technology, Inc., Danvers, MA, SUA) sau anti-ERK1/2 monoclonal (1: 100; nr. cat. 4376; Cell Signaling Technology, Inc.) în 0,3% Triton X -100 în 0,05 M Tris-NaCI, incluzând 1% NGS la 4 ° C peste noapte. Ulterior, anticorpul secundar biotinilat și reactivul de detecție universal de supraveghere (anti-iepure) (peroxidază de hrean) (1: 100; nr. Cat. GK500705; Shanghai Gene Tech Company, Shanghai, China), a fost incubat la temperatura camerei timp de 30 de minute. Complexele de anticorpi legați au fost colorate timp de 3-5 minute sau până când sunt adecvate pentru examinarea microscopică cu 3,3'-diaminobenzidiană și apoi au fost colorate cu 0,6% hematoxilină timp de 50 sec la temperatura camerei și montate.
Analiza cantitativă a fost efectuată în conformitate cu studiile anterioare (22). Pe scurt, cel puțin 5 secțiuni din fiecare DRG în fiecare moment au fost utilizate pentru analiza cantitativă. Toți șoarecii au fost sacrificați la sfârșitul perioadei experimentale. Câmpurile au fost selectate aleator în fiecare 3 secțiuni sub un microscop cu lumină Olympus BX51 (Olympus Corporation, Tokyo, Japonia). Numărul profilurilor de neuroni imunomâtați a fost împărțit la numărul total de profiluri de neuroni și a fost determinat procentul de profiluri de neuroni marcate. Pentru a determina procentul de neuron marcat într-un subgrup de neuroni DRG, au fost numărate profilurile de neuroni cu un nucleu clar.
analize statistice
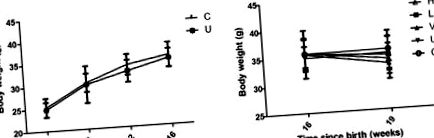
Pachetul de computer SPSS18.0 pentru Windows (SPSS, Inc., Chicago, IL, SUA) a fost utilizat pentru toate analizele. Mijloace ± abateri standard ale experimentelor sunt utilizate pentru a descrie statistici. Diferențele dintre grupurile asociate au fost testate folosind testul t Student și diferențele dintre grupurile tratate variate au fost analizate utilizând o analiză unidirecțională a varianței, urmată de un test de diferență cel mai puțin semnificativ post-hoc pentru comparații multiple. P Fig. 1). Rezultatele au arătat că greutatea corporală a șoarecilor dozați cu tamoxifen părea să fie mai mică decât cea a șoarecilor martor la 4, 8, 12 și 16 săptămâni; cu toate acestea, nu a fost detectată nicio diferență semnificativă statistic (Fig. 1A). După tratamentul cu doze mari și mici de quercetină sau VPA timp de 3 săptămâni, șoarecii au avut greutate corporală mai mică comparativ cu grupul netratat, dar diferența nu a fost semnificativă (Fig. 1B). În plus, doza mare și mică de tratament cu quercetină și VPA a cauzat o pierdere în greutate corporală în comparație cu grupul de control, fără nicio diferență semnificativă (Fig. 1B).
Greutatea corporală medie în diferite grupuri de șoareci. (A) Înainte de tratamentul cu quercetină sau acid valproic la 16 săptămâni. (B) După 3 săptămâni de tratament cu quercetină (n = 9 șoareci) sau acid valproic (n = 8 șoareci). H, quercetină cu doze mari (n = 9 șoareci); L, quercetină cu doză mică (n = 9 șoareci); V, acid valproic (n = 8 șoareci); U, netratat; C, control.
Efectul tratamentului cu quercetină asupra infiltrării miometrului
A fost evaluat efectul tratamentului cu quercetină asupra infiltrării miometrului la șoareci indusă cu adenomioză. După cum au arătat graficele cutiei în Fig. 2, comparativ cu șoarecii martor, șoarecii dozați cu tamoxifen au avut o infiltrație semnificativ mai mare (P Fig. 3A-E, șoarecii dozați cu tamoxifen au scăzut semnificativ latența răspunsului comparativ cu șoarecii martori (P Fig. 3D și E. șoarecii din grupele H, L și V, au fost prelungite după tratamentul cu VPA și quercetin la 19 săptămâni, comparativ cu șoarecii la 16 săptămâni (P Fig. 3F.) În comparație cu șoarecii netratați, latența de răspuns a șoarecilor fie tratați cu Quercetina ridicată sau scăzută sau VPA au prezentat o latență a răspunsului prelungită semnificativ (P Fig. 3F).
Latență de răspuns a plăcii fierbinți în diferite grupuri. Latența răspunsului la placă la (A) 4 săptămâni (B) 8 săptămâni, (C) 12 săptămâni, (D) 16 săptămâni și (E) la sfârșitul tratamentului. (F) Schimbarea latenței de răspuns a plăcii fierbinți înainte (săptămâna 16)/după tratament în diferite grupuri. Datele sunt exprimate ca medie ± deviație standard. * P Fig. 4 - 7. Comparativ cu grupul martor, a existat o creștere evidentă a celulelor pozitive Trpv-1, p-p38 și p-ERK în neuronii L6 și S1 din grupul netratat (P Fig. 4). La animalele cărora li s-a administrat fie o doză mare sau mică de quercetină sau VPA, numărul de celule Trpv-1, p-p38 și p-ERK-pozitive a fost semnificativ mai mic decât cel al grupului netratat (P Fig. 4). Nu a existat nicio diferență semnificativă între grupurile tratate cu VPA/quercetin și grupul de control. Colorarea imunohistochimică a demonstrat că nivelurile de Trpv-1, p-p38 și p-ERK prezente în neuronii DRG au fost semnificativ mai mari la șoarecii cărora li s-a administrat tamoxifen comparativ cu grupul martor (Fig. 4-7). Quercetina cu doze mari și mici a redus semnificativ expresiile Trpv1, p-p38 și p-ERK în comparație cu grupul netratat (; P Fig. 4-7). Doza mare de quercetină a redus nivelurile de Trpv1, p-p38 și p-ERK comparativ cu doza mică de quercetină, însă schimbarea nu a fost semnificativă statistic.
Cuantificarea imunohistochimiei expresiei Trpv-1, p-p38 și p-ERK în neuronii ganglionari ai rădăcinii dorsale. ** P Long L, Chen J, Xiong Y, Zou M, Deng Y, Chen L, Wang Z. Eficacitatea ablației ultrasunete focalizate cu intensitate mare pentru terapia cu adenomioză și calitatea vieții sexuale. Int J Clin Exp Med. 2015; 8: 11701–11707. [Articol gratuit PMC] [PubMed] [Google Scholar]
- P38SJ, o nouă proteină DINGG protejează celulele neuronale de leziunile provocate de alcool și de moarte
- Resveratrol și Quercetin O COMBO DE REDUCERE SUPER GRASĂ! Forumul ierbii naturii
- Studiile efectuate pe șoareci sugerează modul în care fibra dietetică reduce efectele nocive ale dietei bogate în grăsimi
- Extractul apos Rosa rugosa ameliorează Jurnalul de stres indus de exerciții de rezistență la alimentele medicinale
- Restricția calorică pe termen scurt îmbunătățește repararea ADN-ului prin îmbinarea finală neomologă la șoareci npj Îmbătrânire