Shohreh Amini
1 Departamentul de Neuroștiințe, Centrul pentru Neurovirologie, Temple University School of Medicine Philadelphia, Pennsylvania
2 Departamentul de Biologie, Colegiul de Știință și Tehnologie, Universitatea Temple Philadelphia, Pennsylvania
Nana Merabova
1 Departamentul de Neuroștiințe, Centrul pentru Neurovirologie, Temple University School of Medicine Philadelphia, Pennsylvania
Kamel Khalili
1 Departamentul de Neuroștiințe, Centrul de Neurovirologie, Temple University School of Medicine Philadelphia, Pennsylvania
Nune Darbinian
1 Departamentul de Neuroștiințe, Centrul pentru Neurovirologie, Temple University School of Medicine Philadelphia, Pennsylvania
Abstract
Etanolul induce leziuni ale celulelor neuronale și moartea prin neregularizarea mai multor evenimente de semnalizare care sunt controlate, parțial, prin activarea MAPK/ERK1/2 și/sau prin inactivarea fosfatazei sale corespunzătoare, PP1. Recent, am purificat o nouă proteină de 38 kDa în mărime, p38SJ, dintr-o cultură de calus a Hypericum perforatum, care aparține unei familii emergente de proteine DINGG cu activitate de legare a fosfatului. Aici, arătăm că tratamentul celulelor neuronale cu p38SJ protejează celulele împotriva leziunilor induse de expunerea la etanol. Mai mult, tratamentul prealabil al celulelor neuronale cu p38SJ reduce nivelul proteinei pro-apoptotice Bax și unele evenimente asociate cu apoptoza, cum ar fi clivarea caspazei 3. În plus, prin inducerea stresului, alcoolul poate crește producția de specii reactive de oxigen (ROS) care duce la o scădere a activității superoxidului dismutazei (SOD). Rezultatele noastre au arătat că p38SJ restabilește activitatea SOD în celulele neuronale tratate cu etanol. Aceste observații oferă un nou instrument biologic pentru dezvoltarea de noi abordări pentru prevenirea morții celulelor neuronale induse de etanol și, eventual, tratarea tulburărilor neurologice asociate cu abuzul de alcool.
INTRODUCERE
Abuzul de alcool este asociat cu multiple deficite neurologice și comportamentale, inclusiv neuropatie și encefalopatie, degenerare cerebeloasă, modificări cognitive și afectarea judecății și a memoriei (pentru o revizuire a se vedea Alderazi și Brett 2007; Brun și Andersson 2001; Brust 2008; Johnson și colab., 1986). Etanolul dăunează sistemului nervos și provoacă leziuni ale celulelor neuronale prin afectarea mai multor căi de transducție a semnalului, inclusiv MAPK (Sanna și colab., 2002, Logrip 2008). Activarea MAPK de către etanol este dependentă de receptor. Printre receptorii afectați de etanol se numără receptorii GABA (Lee și colab., 2007a, Ueno 2001). S-a demonstrat că efectele celulare ale etanolului care apar prin modularea căilor de transcripție PKA și CREB sunt activate prin receptorii GABA (Criswell și Breese, 2005); expresia crescută a PKA și CREB a fost observată după tratamentul cu etanol (Pandey și colab., 2001).
Studiile anterioare au demonstrat că etanolul poate provoca moartea celulelor neuronale prin stres oxidativ (Antonio și colab., 2008; Haorah și colab., 2008a; Heaton și colab., 2002, 2003; Lee și colab., 2007; Ramachandran și colab., 2003; Watts și colab., 2005). Studii recente au indicat, de asemenea, niveluri crescute de ROS în SNC ale alcoolicilor, probabil datorită metabolismului etanolului (Haorah și colab., 2008a). Stresul oxidativ indus de alcool în creier a fost studiat pe larg ca o cale nouă de neurodegenerare asociată cu abuzul de alcool (Haorah și colab., 2008a și b). Multe studii bine dezvoltate indică importanța activării kinazelor și a inhibării fosfatazelor în leziunile celulare cauzate de stresul oxidativ indus de etanol în creier (Haorah și colab., 2005, 2007, 2008b; Lohmann 2004). Mecanismele potențiale care conduc la inducerea stresului oxidativ și producerea de ROS indusă de alcool și, prin urmare, la leziuni neuronale nu sunt pe deplin înțelese.
Recent am identificat o nouă proteină de 38 kDa, p38SJ, dintr-o cultură de calus cultivată in vitro de Hypericum perforatum și am clonat ADNc-ul său parțial, p27SJ. p27SJ aparține familiei de proteine DINGG, deoarece conține o secvență conservată DINGG la capătul N-terminal (Darbinian și colab., 2008; Perera și colab., 2008). p27SJ prezintă capacitatea de a modula expresia genelor virale și celulare, inclusiv HIV-1, MCP-1 (Darbinian-Sarkissian și colab., 2006; Mukerjee și colab., 2008),
La om, o peptidă care conține DINGG a fost identificată pentru prima dată în lichidul sinovial și s-a constatat că face parte dintr-o proteină mai mare cunoscută sub numele de proteină stimulatoare a celulelor T sinoviale p205 (Blass și colab, 1999; Hain și colab, 1996). Studiile ulterioare au condus la identificarea unui alt membru al familiei umane DINGG cu efecte care favorizează creșterea în celulele normale și tumorale (Adams și colab., 2002; Belenky și colab., 2003; Morales și colab., 2006). În plus față de țesutul uman, proteinele DINGG au fost izolate din diferite ciuperci, țesuturi animale și vegetale și prezintă o omologie strânsă cu proteinele Pseudomonas (pentru recenzie vezi Ahn și colab., 2007; Berna și colab., 2002, 2008; Chen și colab., 2007; Lewis și Crowther, 2005; Moniot și colab., 2007; Pantazaki și colab., 2007; Riah și colab., 2000; Scott și Wu, 2005).
Aici demonstrăm că tratamentul celulelor neuronale cu p38SJ le protejează de apoptoza indusă de etanol.
MATERIALE ȘI METODE
Cultură de celule
Neuronii corticali de șobolan s-au propagat în urma tratamentului enzimatic și mecanic al țesutului embrionar de șobolan Sprague Dawley în ziua 17 (E17) folosind enzima TrypleExpress (Invitrogen, Carlsbad, CA) la 37 ° C timp de 10 minute, urmată de trei spălări cu mediu Hibernate E. După tratamentul mecanic al țesutului cu o pipetă Pasteur din sticlă lustruită cu foc, suspensia monocelulară a fost diluată cu mediu de cultură și celulele au fost placate pe vase de 60 mm acoperite cu poli-D-lizină cu o densitate de 2,5 × 106/placă și cultivate 3 ml mediu neurobazal care conține supliment B27, 0,25 mM Glutamax și 0,25 mM L-glutamină (toate de la Invitrogen). Celulele au fost menținute la 37 ° C într-un incubator umidificat conținând 7% CO2.
Microscopie
Imaginile cu contrast de fază ale celulelor neuronale au fost vizualizate cu un microscop de fluorescență Olympus inversat utilizând software-ul IPLAB. Contrastul și luminozitatea au fost ajustate în mod egal pentru toate imaginile folosind Adobe Photoshop versiunea 5.5.
Pregătirea extractului de plante
O sută de miligrame de H. perforatum uscat au fost dizolvate în 1 ml de tampon de liză conținând 30 mM Tris (pH 7,4), 167 mM NaCl, 0,1% Nonidet P-40 și cocktail inhibitori de protează (Sigma, St. Louis, MO SUA). Resturile celulare au fost îndepărtate prin centrifugare la 14.000 rpm timp de 5 minute la 4 ° C. Proteinele solubile totale din cal au fost centrifugate la 10.000 rpm timp de 5 minute și supernatantul a fost recuperat și fracționat prin filtre Microcon 3, 30 și 50 kDa MilliPore (Millipore, Billerica, MA SUA), pentru a separa proteina de 38 kDa de molecula joasă proteine de greutate și alte componente organice vegetale. Puritatea proteinei de 38 kDa a fost determinată prin SDS-PAGE.
Pregătirea extractelor de proteine și analiza imunoblotului
Pentru prepararea extractelor de proteine de celule întregi, după tratamentul cu etanol și/sau p38SJ, celulele au fost spălate cu soluție salină tamponată cu fosfat rece (PBS) și solubilizate în tampon de liză conținând 50 mM Tris (pH 7,4), 150 mM NaCl, 0,1% Nonidet P-40 și 1% inhibitori de cocktail proteazică (Sigma, St. Louis, MO SUA). Resturile celulare au fost îndepărtate prin centrifugare la 10.000 rpm timp de 5 minute la 4 ° C. Cincizeci de micrograme de proteine au fost rezolvate în tamponul probei Laemmli și fracționate cu electroforeză pe gel de dodecil sulfat de sodiu-poliacrilamidă 10% (SDS-PAGE). Pentru analiza Western blot, probele de proteine au fost rezolvate prin SDS-PAGE și după transferul la membrană, au reacționat cu anticorpi specifici și proteinele vizualizate cu sistemul de detectare a chemiluminescenței îmbunătățit ECL + conform instrucțiunilor producătorului (GE Healthcare, Piscataway NJ) și expuse la filmul cu raze X.
Test Caspase-GLO 3/7
Apoptoza a fost determinată prin analiza activării caspazei-3 utilizând substratul DEVD-aminoluciferină din trusa de test Caspase-Glo ™ 3/7 (Promega, Madison, WI, SUA), conform instrucțiunilor producătorului. Luminescența a fost înregistrată pe un Luminometru Turner Designs TD-20/20 Datele au fost analizate folosind software-ul Excel.
Test de metiltiazoletetrazoliu (MTT)
Pentru testul metiltiazoletetrazoliu (MTT), am folosit un kit de proliferare celulară (MTT) conform protocolului producătorului (Roche, Indianapolis, IN SUA). Celulele au fost plasate pe plăci cu 96 de godeuri în triplicat în două seturi la o densitate de 15.000 de celule/godeu și pre-incubate cu p38SJ (timp de 2 ore) apoi co-incubate cu etanol. După 24 de ore, s-au adăugat 10 g MTT (5 mg/ml) la godeuri (concentrație finală, 0,5 mg/ml) timp de 4 ore și reacția a fost oprită prin adăugarea a 100 pl de soluție de solubilizare. Celulele viabile cu mitocondrii active scindează inelul tetrazoliu într-un produs de reacție formazan albastru închis vizibil, care a fost cuantificat prin spectrofotometrie într-un cititor de microplăci la 570 nm cu o lungime de undă de referință de 650 nm. Viabilitatea relativă a celulei (procente) a fost determinată ca raportul dintre absorbanța medie pentru celulele tratate și cel pentru celulele simulate, netratate.
Testul activității superoxidismutazei (SOD)
Pentru a măsura activitatea SOD în neuronii primari, după tratamentul cu p38SJ timp de două ore și etanol, fracția citosolică a fost preparată și incubată cu soluție de xantină oxidază timp de 1 oră la 37 ° C. Absorbanța a fost citită la 490 nm pentru a genera anioni superoxizi. Activitatea SOD este determinată ca inhibarea reducerii cromagenului. În prezența SOD, concentrația de anion superoxid este redusă, producând un semnal colorimetric mai redus. Activitatea SOD a fost prezentată în%.
Anticorpi
Anticorpii specifici pentru protein kinaza fosfo-p44/42 mitogen-activată (MAPK/Erk1/2), anti-p44/42 MAPK, policlonal de iepure și anticorpi policlonali anti-iepure GRB2 au fost achiziționați de la Cell Signaling Technologies (Danvers, MA). Anticorpii policlonali de iepure anti-caspază-3 și anti-Bax au fost obținuți de la Santa Cruz Biotechnology Inc. (Santa Cruz, CA, SUA).
REZULTATE SI DISCUTII
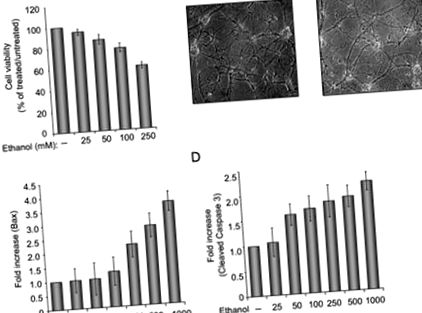
Pentru a examina efectul etanolului asupra celulelor neuronale, am pregătit culturi primare de neuroni de șobolan și am examinat viabilitatea celulară ca răspuns la tratamentul cu etanol. Așa cum se arată în Figura 1A, creșterea concentrației de etanol are ca rezultat scăderea viabilității celulelor neuronale. La tratamentul cu 250 mM etanol, aproximativ 40% din celule erau moarte și celulele rămase au prezentat niveluri reduse de arborizare și procese (Fig. 1B). Examinarea proteinelor pro-apoptotice a relevat inducerea BAX și niveluri crescute de caspază 3. Figura 1 ilustrează analiza cantitativă a Bax (Panoul C) și caspaza 3 scindată (Panoul D), determinată prin testul imunoblot. Pentru a evalua capacitatea p38SJ de a proteja celulele neuronale de apoptoză după tratamentul cu etanol, celulele au fost incubate cu p38SJ foarte purificat (Fig. 2A) timp de 24 de ore înainte de analiza viabilității celulare și a clivajului caspazelor. Așa cum se arată în FIG. 2, tratamentul celulelor cu p38SJ a îmbunătățit drastic cantitatea de arborizare a celulelor tratate cu etanol (panoul B) și viabilitatea celulară (panoul C) și a scăzut nivelul de clivaj al caspazei 3 (panoul D), indicând faptul că p38SJ are activitate neuroprotectoare ca răspuns la tratamentul cu etanol.
(A) Test de viabilitate celulară la neuronii primari de șobolan, incubați cu concentrații crescânde de etanol (de la 25 la 250 mM). Un număr egal de celule au fost placate în duplicat și apoi incubate cu etanol. Viabilitatea celulei a fost evaluată prin testul de excludere albastru Trypan. Bara 1 reprezintă celule netratate setate ca 100%. (B) Imagini de fază (mărire 200 ×) ale celulelor neuronale incubate în absență și prezența a 250 mM etanol. (C) Cuantificarea diferențelor în nivelurile Bax determinate prin analiza densitometrică a benzii corespunzătoare Bax (determinată prin testul Western blot) care a fost normalizată la nivelul Grb2. (D) Cuantificarea diferențelor în caspaza 3 scindată după ce a fost normalizată la nivelul de Grb2.
(A) SDS-PAGE ilustrând p38SJ foarte purificat care a fost obținut la fracționarea în mărime a extractelor de proteine brute din cultura calusului St. Sunătoare (Darbinian-Sarkissian și colab., 2006). Poziția p38SJ este arătată de o săgeată. (B) Imagini de fază ale celulelor neuronale incubate cu etanol (250 mM) și/sau p38SJ (300 ng/ml). Reducerea numărului de neuroni și a proceselor neuronale cauzate de etanol a fost inversată în prezența p38SJ. (C) Test de viabilitate celulară la neuronii primari de șobolan pre-incubați cu concentrații crescânde de p38SJ, așa cum este indicat în Figura 2B, timp de 2 ore și apoi tratat cu etanol. Un număr egal de celule au fost placate în duplicat, iar viabilitatea celulei a fost evaluată prin testul de excludere albastru Trypan. Banda 1 conține celule netratate setate ca 100%. (D) p38SJ previne clivarea caspazei-3 în celulele neuronale tratate cu etanol. Lizatele celulare preparate din netratate, pretratate cu p38SJ timp de 2 ore înainte de tratamentul cu etanol și celulele tratate cu etanol la 24 de ore de incubație au fost analizate prin analiza imunoblot pentru caspaza-3 scindată. Încărcarea egală a fost verificată utilizând anticorp anti-tubulin. Graficele cu bare demonstrează densitatea cuantificată a benzilor, prezentate ca histogramă pentru caspaza-3 scindată, normalizată la tubulină.
Apoi, am investigat efectul p38SJ asupra stresului oxidativ din celulele neuronale. În acest scop, am determinat activitatea superoxidului dismutazei (SOD) în celulele incubate cu p38SJ înainte de tratamentul cu etanol. Pentru a măsura activitatea SOD în neuronii primari, am folosit sistemul OxiSelect SOD Activity Assay (Cell Biolabs, San Diego, CA). Datele din testul SOD indică faptul că etanolul induce stresul oxidativ în neuroni prin inhibarea activității SOD (Fig. 3A). p38SJ a fost capabil să prevină stresul oxidativ indus de etanol și să restabilească activitatea SOD în celulele tratate cu etanol. În condiții experimentale identice, rezultatele testului de metabolizare/activitate celulară MTT au arătat restaurarea celulelor prin p38SJ în celulele tratate cu etanol (Fig. 3B) și o scădere a activității caspazei 3, astfel cum a fost evaluată prin testul Glo (Fig. 3C).
(A) Celule neuronale tratate cu etanol timp de 24 de ore sau pretratate cu p38SJ timp de 2 ore înainte de expunerea la etanol. Celulele au fost analizate prin testul SOD. Activitatea SOD este prezentată ca% din controlul netratat (bara 1). (B) Viabilitatea celulară determinată prin testul MTT. (C) Activitatea Caspase-3 determinată prin testul Caspase-3/7.
În lumina studiilor anterioare care indică capacitatea etanolului de a regla evenimentele de semnalizare care implică fosforilarea ERK1/2 (Glotin și colab., 2006; Ku și colab., 2007; Lee și colab., 2006; Luo și colab., 2006; Zhuang și colab., 2007), am examinat nivelurile de fosforilat și total ERK1/2 în celulele neuronale la tratamentul cu etanol. După cum se vede în Fig. 4A, tratamentul cu etanol induce fosforilarea ERK1/2 (pERK1/2) fără impact major asupra nivelului total de ERK1/2. La fel ca înainte, nivelul BAX și al caspazei clivate au crescut la tratamentul cu etanol. Tratamentul acestor celule cu p38SJ a redus nivelul formei fosforilate de pERK1/2, nu a avut niciun impact asupra nivelului total de ERK1/2 și a redus semnificativ nivelurile de BAX și caspaza clivată 3. Aceste observații indică faptul că p38SJ are capacitatea de a inhibă fosforilarea indusă de etanol a ERK1/2 și activarea căilor apoptotice. Scăderea fosforilării ERK1/2 poate reduce nivelul BAX pro-apoptotic și al caspazei 3.
(A) Exprimarea ERK1/2 și a proteinelor implicate în apoptoză în celulele neuronale tratate cu etanol. Analiza Western blot pentru ERK1/2 și fosfo-Erk 1/2 în celulele neuronale primare de șobolan după tratament cu 100 și 250 mM etanol timp de 24 de ore. Nivelul expresiei totale ERK1/2 și Grb2 servește drept control pentru încărcarea proteinelor. (B). Efectul p38SJ asupra fosforilării ERK1/2 în celule incubate cu etanol. Analiza Western blot pentru ERK1/2 și fosfo-ERK1/2 în celulele neuronale după expunerea la etanol timp de 24 de ore după tratamentul prealabil al celulelor cu p38SJ timp de 2 ore.
Mulțumiri
Autorii doresc să mulțumească membrilor din trecut și prezenți ai Departamentului de Neuroștiințe și ai Centrului pentru Neurovirologie pentru schimbul de reactivi și idei și pentru sprijinul lor continuu. Mulțumim Dr. Yuri Popov de la Universitatea de Stat Yerevan din Yerevan, Armenia pentru colaborarea sa și pentru furnizarea culturii inițiale a calusului H. perforatum. Mulțumim, de asemenea, lui C. Schriver pentru asistență editorială. Această lucrare a fost posibilă prin subvenții acordate de NIH către SA.
Sponsor al grantului contractului: NIH; Număr subvenție contract: R01MH074392
- Observații privind digestia proteinelor in vivo The Journal of Nutrition Oxford Academic
- Proteine pe bază de plante; 88 Acri
- Sancțiuni pentru încălcarea statutului de control al alcoolului
- Proteine vegetale pentru scăderea în greutate Cea mai bună scădere în greutate pentru grăsimea abdominală Cea mai bună livrare la domiciliu Scădere în greutate
- Obezitatea crește riscul de deces din cauza COVID-19 la bărbați 5 moduri sigure de a pierde în greutate