Revizuirea chimiei
Proteinele sunt al treilea grup major de macromolecule care alcătuiesc corpurile organismelor. Proteinele joacă diverse roluri în viețuitoare. Poate că cele mai importante proteine sunt enzimele, proteine capabile să accelereze reacțiile chimice specifice. Alte proteine scurte numite peptide sunt utilizate ca mesageri chimici în creier și în tot corpul. Colagenul, o proteină structurală, este o parte importantă a oaselor, cartilajului și tendoanelor. În ciuda funcțiilor lor variate, toate proteinele au aceeași structură de bază: un lanț lung de aminoacizi legați cap la cap.
Aminoacizii sunt molecule mici care conțin o grupare amino (- NH2), o grupă carboxil (- COOH), un atom de hidrogen, un atom de carbon și un lanț lateral care diferă între aminoacizi. Într-o formulă generalizată pentru un
aminoacid, lanțul lateral este prezentat ca R. Identitatea și proprietățile chimice unice ale fiecărui aminoacid sunt determinate de natura grupului R.
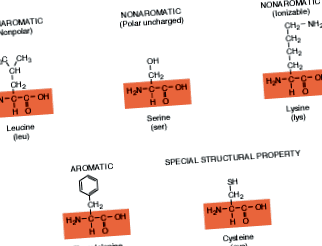
Doar 20 de aminoacizi diferiți alcătuiesc diversele proteine găsite în viețuitoare. Fiecare proteină diferă în funcție de cantitatea, tipul și dispunerea aminoacizilor care alcătuiesc structura sa. Observați că fiecare are aceeași coloană vertebrală chimică (arătată de casetă) ca în formula generalizată. Grupurile R se află în afara acestor casete. Acei aminoacizi cu grupări R care formează structuri inelare sunt numiți compuși aromatici și cei fără structuri inelare sunt nonaromatici. (Acest termen a fost inventat pe măsură ce chimiștii au descoperit că mulți compuși parfumați au această structură inelară distinctă.) Acei aminoacizi care sunt ionizabili au grupări R care se încarcă atunci când sunt în soluție.
Figura 15 Cum se formează și se rupe un lanț polipeptidic. (a) În timpul sintezei de deshidratare, se formează legături peptidice între aminoacizii adiacenți, formând o polipeptidă. (b) În timpul hidrolizei, o moleculă de apă este adăugată la fiecare legătură peptidică care leagă aminoacizii adiacenți, rupând legătura dintre ei. Aceasta separă moleculele în aminoacizi individuali.
Figura 16 Structura primară determină forma unei proteine datorită lipirii de-a lungul lanțului.
Grupurile funcționale ale aminoacizilor dintr-un lanț polipeptidic interacționează cu vecinii lor, formând legături de hidrogen. În plus, porțiuni ale unui lanț proteic cu multe lanțuri laterale nepolare tind să fie împinse în interiorul proteinei datorită proprietăților lor hidrofobe. Datorită acestor interacțiuni, lanțurile polipeptidice tind să se plieze spontan în foi sau să se înfășoare în bobine. Această formă pliată sau înfășurată se numește structura sa secundară 2. Proteinele formate în mare parte din foi formează deseori fibre precum fibrele de keratină din păr, fibrina din cheagurile de sânge și mătasea în pânzele de păianjen. Proteinele care au regiuni care formează bobine se pliază frecvent în forme globulare, cum ar fi subunitățile globinei hemoglobinei din sânge.
Legarea hidrogenului poate duce, de asemenea, la proteine cu forme mai complexe decât structura secundară. Următorul nivel de structură se numește structură terțiară 3. Pentru proteinele care constau din subunități (lanțuri polipeptidice separate), modul în care aceste subunități sunt asamblate într-un întreg se numește structura cuaternară 4.
- Cupon Omni Nutrition - 122020
- ASIGURARE FĂRĂ OMG; Nutriție uimitoare
- Bărbați; Sănătatea sexuală Legătura dintre nutriție, testosteron scăzut; Disfuncție erectilă
- Bărbați; s Săptămâna Sănătății - Nutriție și Hidratare - Sănătate pe toată Valea
- Bărbați; cu Premiile pentru nutriție sportivă pentru fitness 2018