Subiecte
Analizând profilurile microbiene din trei depozite de țesut adipos și ficatul și plasma indivizilor obezi morbid, un nou studiu descoperă o semnătură microbiană specifică organului specifică sau „potențială„ microbiotă tisulară ”internă la persoanele obeze cu diabet zaharat.
Acumularea de grăsime viscerală este considerată unul dintre cei mai importanți factori de risc pentru dezvoltarea diabetului de tip 2. Deși mecanismele moleculare care leagă acumularea de grăsime viscerală cu alterarea metabolismului glucozei nu sunt încă pe deplin elucidate, un factor declanșator acceptat în mod obișnuit este inflamația cronică de nivel scăzut în grăsimea viscerală și organele metabolice, cum ar fi ficatul și mușchii, la persoanele cu diabet și obezitate .
Microbiota intestinală este un factor principal al inflamației cronice, datorită translocației diferitelor componente bacteriene, cum ar fi lipopolizaharidele, de la intestin la sânge; acest fenomen este definit ca endotoxemie metabolică 2. Deși numeroase studii au legat compoziția și activitatea microbiotei intestinale de bolile metabolice 3, dacă microbiota intestinală este legată cauzal de obezitate și de diabetul de tip 2 rămâne un subiect de dezbatere. O limitare importantă în acest sens este că majoritatea studiilor conexe s-au bazat în primul rând pe analiza microbiotei scaunelor. Puține rapoarte au identificat semnături potențiale microbiene în sângele sau țesutul adipos al persoanelor cu obezitate și diabet 4.5. Cu toate acestea, îngrijorările cu privire la potențiala contaminare microbiană a probelor și rezultatele fals pozitive au aruncat îndoieli cu privire la validitatea acestor descoperiri 6 .
Un nou studiu realizat de Anhê și colab., Publicat în acest număr al Natura Metabolismului 7, pare să fi depășit cu succes acest obstacol controlând cu atenție contaminarea la fiecare pas în timpul eșantionării și analizei și oferind o analiză comparativă și conștientă de contaminare a diferitelor profiluri microbiene. Datorită numărului mare de controale, autorii au reușit să furnizeze colectarea de date clară și convingătoare cu un risc minim de raportare a rezultatelor fals pozitive. De exemplu, diferența de semnal de 1.000 de ori dintre probele de țesut și controalele negative indică cu tărie faptul că datele sunt fiabile și reflectă sarcina microbiană reală a țesuturilor, mai degrabă decât contaminarea.
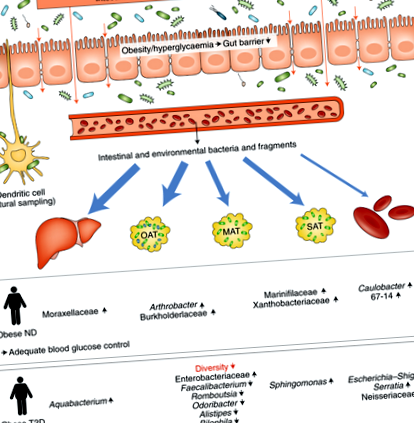
Această lucrare de pionierat este de maxim interes pentru comunitatea științifică. Într-adevăr, acest studiu este primul care investighează semnăturile microbiene prin utilizarea cuantificării bacteriene pe bază de gene ARN ribosomal 16S (rRNA) în plasmă și în diferite locuri ale corpului, în special organele metabolice cheie care sunt notoriu greu de accesat, inclusiv ficatul și viscerul și omenta. depozite de grăsime (Fig. 1). Un alt aspect original al acestei lucrări este că autorii și-au concentrat analiza asupra unei potențiale semnături microbiene specifice organelor, care este independentă de indicele de masă corporală, precum și de legăturile sale cu glicemia și diabetul.
Bacteriile și fragmentele intestinale și de mediu sunt prelevate din punct de vedere fiziologic din lumenul intestinal de către celulele imune, cum ar fi celulele M sau celulele dendritice, sau se pot transloca în sânge și pot ajunge ulterior la diferite țesuturi. Semnăturile bacteriene se găsesc în ficat, țesutul adipos omental (OAT), țesutul adipos mezenterial (MAT), țesutul adipos subcutanat (SAT) și sânge. Sunt indicați diferiții taxoni și abundența lor (adică niveluri mai ridicate sau mai mici la persoanele obeze nediabetice (ND) versus obezii diabetici de tip 2 (T2D)) în țesuturi. Abundența relativă a depozitelor bacteriene este relativ mai mare în țesuturile de-a lungul căii anatomice de la intestin la ficat și relativ mai mică în țesutul adipos subctutanat și sângele periferic (reprezentat de grosimea săgeților albastre).
Interesant este faptul că cercetătorii au găsit un număr mai mare de copii ale genei ARNr 16S în țesutul adipos omental și ficat decât în compartimentele mezenterice, subcutanate și plasmatice (Fig. 1). Proteobacteriile au fost filumul dominant în toate cele cinci țesuturi studiate, deși datele oferă, de asemenea, dovezi ale compartimentării bacteriene specifice țesutului. Printre semnăturile bacteriene, Pseudomonas a fost genul predominant în toate țesuturile, deși s-a observat un număr mai mare de copii ale genei 16S rRNA în organe decât în plasmă. Arthrobacter și Ruminoccocus, în schimb, s-au găsit preferențial în ficat. Alte opt genuri au fost mai răspândite în cele trei țesuturi adipoase. Întrucât Bacteroides, Faecalibacterium și Enterobacter au fost prezente în țesuturile adipoase și sunt clasic reprezentative pentru microbiota intestinală, celelalte genuri detectate sunt considerate în primul rând bacterii de mediu, care se găsesc în mod obișnuit în sol sau în apă (Fig. 1). În plus, constatarea că multe dintre bacterii par să provină nu numai din tractul gastrointestinal, ci și din alte surse - cum ar fi hrana, apa sau solul - sugerează cu tărie că organele noastre interne sunt expuse constant la semnături genetice străine potențiale.
O funcție de barieră intestinală compromisă a fost legată de obezitate și diabet 8.9. Cu toate acestea, în studiul actual, rămâne neclar dacă aceste semnături ale genei ARNr 16S reflectă translocația bacteriană reală către diferitele țesuturi interne sau dacă depunerea materialului genetic este rezultatul eșantionării active a conținutului intestinal sau luminal de către celulele sistemului imunitar, inclusiv celule dendritice sau celule M (Fig. 1). Evaluarea compoziției microbiotei intestinale a indivizilor implicați în acest studiu ar fi putut arunca lumina asupra acestei chestiuni. Cu toate acestea, deși lipsa de informații despre microbiomul intestinal ar putea fi considerată o oportunitate ratată, aceasta nu diminuează relevanța rezultatelor generale și studiul ar trebui luat în considerare pentru ceea ce este: o lucrare de pionierat care deschide calea pentru studiile viitoare care încearcă pentru a lega semnăturile microbiene ale diferitelor organe de intestin și microbiota mucoasei. Mai mult, având în vedere prezența semnăturilor microbiene de mediu în țesuturile interne, investigarea potențialei origini și surse a acestor semnale ar fi de interes.
În concluzie, Anhe și colab. au furnizat elegant dovezi interesante de semnături genetice bacteriene în cinci compartimente biologice extraintestinale. Această realizare pionieră și lăudabilă este un adevărat schimbător de jocuri în domeniul cercetării microbiomului și reprezintă exact tipul de schimbare de paradigmă de care are nevoie câmpul. Ca atare, acest studiu ar putea fi primul dintr-o nouă linie de cercetare care va crește progresiv cunoștințele și va ajuta la descifrarea rolului „microbiotei țesuturilor”, a interacțiunilor sale cu gazda și a relevanței sale pentru boli metabolice și potențial alte.
Referințe
Hotamisligil, G. S. Natură 444, 860–867 (2006).
Cani, P. D. și colab. Diabet 56, 1761–1772 (2007).
Cani, P. D. și colab. Nat. Metab. 1, 34–46 (2019).
Udayappan, S. D. și colab. Plus unu 12, e0181693 (2017).
Amar, J. și colab. Diabetologie 54, 3055–3061 (2011).
Tilg, H., Zmora, N., Adolph, T. E. și Elinav, E. Nat. Rev. Immunol. 20, 40-54 (2020).
Cani, P. D. și colab. Bun 58, 1091-1103 (2009).
Mulțumiri
P.D.C. este asociat senior de cercetare la Fonds de la Recherche Scientifique (FRS-FNRS), Belgia. Este susținut de Fonds Baillet Latour (Grant for Medical Research 2015), Fondsde la Recherche Scientifique (FNRS, FRFS-WELBIO: WELBIO-CR-2019C-02R și programul EOS nr. 30770923).
Informatia autorului
Afilieri
UCLouvain, Université catholique de Louvain, Walloon Excellence in Life Sciences and Biotechnology (WELBIO), Louvain Drug Research Institute, Metabolism and Nutrition Research Group, Bruxelles, Belgia
Patrice D. Cani și Matthias Van Hul
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
- Sindromul metabolic sau „Sindromul obezității centrale” Îngrijirea diabetului
- Sensul obezității metabolice și obezității hedonice - Yu - 2017 - Journal of Diabetes - Wiley
- Hipertensiune arterială, obezitate, diabet, hiperlipidemie și sindrom metabolic în insuficiența cardiacă - american
- Cum luptă fibrele dietetice cu obezitatea și diabetul
- Foamea și obezitatea Înțelegerea unei paradigme a insecurității alimentare Rezumatul atelierului Academiile naționale