Cuprins
- 1 Definiție/Descriere
- 2 Prevalență
- 3 Caracteristici/Prezentare clinică
- 4 Comorbidități asociate
- 5 Medicamente
- 6 Teste de diagnostic/Teste de laborator/Valori de laborator
- 7 Cauze
- 8 Implicare sistemică
- 9 Management medical (cele mai bune dovezi actuale)
- 10 Managementul terapiei fizice (cele mai bune dovezi actuale)
- 11 Diagnostic diferențial
- 12 Rapoarte de caz
- 13 Resurse
- 14 Referințe
Definiție/Descriere
Sindromul Cushing este un termen general pentru secreția crescută de cortizol de către cortexul suprarenal. Când corticosteroizii sunt administrați extern, apare o afecțiune a hipercortizolismului numită sindrom iatrogen Cushing. [1] Când hipercortizolismul rezultă dintr-o excreție de ACTH din hipofiză, afecțiunea se numește boala Cushing. Prezentarea clinică este aceeași pentru toate aceste afecțiuni. [2]
- ACTH: hormon adrenocorticotrop
Prevalenta
De departe, cea mai frecventă cauză a sindromului Cushing în prezent (până la 12 cazuri/1 milion de persoane) este utilizarea medicamentelor cu corticosteroizi pentru a trata o mare varietate de stări de boală, inclusiv artrita reumatoidă, astmul și scleroza multiplă. Prevalența hipercotizolismului din toate celelalte cauze combinate este de doar 13 cazuri la 1 milion de persoane la nivel național. Incidența generală este estimată la 2 cazuri noi la 1 milion de persoane pe an. [3]
Femeile au de opt ori mai multe șanse decât bărbații să dezvolte hipercortizolismul dintr-o tumoare hipofizară și de trei ori mai probabil să dezvolte o tumoare suprarenală care secretă cortizol: Cu toate acestea, tumorile pulmonare producătoare de hormoni care cauzează hipercortizolismul sunt mai frecvente la bărbați. [3]
Nouăzeci la sută din toate cazurile de sindrom Cushing apar la vârsta adultă. Incidența sindromului Cushing la copii este estimată la aproximativ 0,2 cazuri la 1 milion de persoane pe an: Incidența maximă a sindromului Cushing din cauza unei tumori suprarenale sau hipofizare apare la persoanele cu vârste cuprinse între 25 și 40 de ani. [3]
Sindromul Cushing non-iatrogen apare în principal la femei, cu o vârstă medie de debut între 20 și 40 de ani, deși poate fi observat la persoanele cu vârsta de până la 60 de ani. [2]
Caracteristici/Prezentare clinică
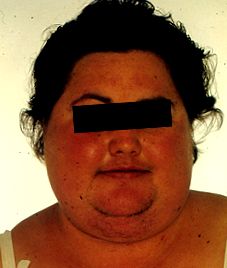
Manifestările clinice includ fața de „lună” (foarte rotundă), cocoașă de bivol (obezitate truncală cu tampoane de grăsime cervicală supraclaviculare și dorsale proeminente) [4], abdomen protuberant cu acumulare de țesut gras și vergeturi cu striuri purpurii, irosire și slăbiciune musculară extremități, scăderea densității osoase (în special a coloanei vertebrale), cifoză și dureri de spate (secundare pierderii osoase), vânătăi ușoare și vindecarea slabă a rănilor datorită pielii subțiri și atrofice [4], acnee, tulburări psihiatrice sau emoționale, afectarea funcției reproductive și modificări ale ciclul menstrual și diabetul zaharat. La femei se remarcă efecte masculinizante, cum ar fi hipertricoza, atrofia sânilor, modificările vocii și alte semne de virilism. Încetarea creșterii liniare este caracteristică la copii. [1] [4]
Comorbidități asociate
Sindromul Cushing implică axa HPA provocând eliberarea excesivă de cortizol din glandele suprarenale. Când funcția normală a glucocorticoizilor devine exagerată, se poate declanșa o gamă largă de răspunsuri fiziologice. [2]
Comorbiditățile implicate în boala Cushing sunt hiperglicemia persistentă, hipertrofia și hipertensiunea cardiacă, pierderea musculară proximală (pierderea țesutului proteic), osteopenia sau osteoporoza, hipokaliemia, modificările mentale și pierderea memoriei, depresia, calculii renali, susceptibilitatea crescută la infecție, hiperplazia suprarenală și tumori suprarenale [2] [4] [1]
Medicamente
Inițial, starea generală a pacientului ar trebui să fie susținută de un aport ridicat de proteine și administrarea adecvată de vitamina K. Dacă manifestările clinice sunt severe, poate fi rezonabil să se blocheze secreția de corticosteroizi cu metiraponă 250 mg până la 1 g pot id sau ketoconazol 400 mg o dată pe zi, crescând la maximum 400 tid. Ketoconazolul este mai ușor disponibil, dar cu un debut mai lent și uneori hepatatoxic. [4]
Inhibitorii suprarenali, cum ar fi metyrapone 500 mg pot id (și până la un total de 6 g/zi) sau mitotan 0,5 g pe dată/zi, crescând până la maxim 3 până la 4 g/zi, controlează de obicei tulburările metabolice severe (de ex. .Hipokaliemia). Când se utilizează mitotan, pot fi necesare doze mari de hidrocortizon sau dexametazonă. Măsurătorile producției de cortizol pot fi nesigure și se poate dezvolta hipercolesterolemie severă. Ketoconazolul 400 până la 1200 mg o dată pe zi blochează, de asemenea, sinteza corticosteroidelor, deși poate provoca toxicitate hepatică și poate provoca simptome addisoniene. Alternativ, receptorii corticosteroizi pot fi blocați cu mifepristonă (RU 486). Mifepristonul crește cortizolul plasmatic, dar blochează efectele corticosteroidului. Uneori, tumorile secretoare de ACTH răspund la analogi de somatostatină cu acțiune îndelungată, deși administrarea timp de> 2 ani necesită o monitorizare atentă, deoarece se pot dezvolta gastrite ușoare, calculi biliari, colangită și malabsorbție. [4]
Teste de diagnostic/Teste de laborator/Valori de laborator
Deși există un aspect clasic cushingoid la persoanele cu hipercortizolism și diagnosticul este de obicei suspectat pe baza simptomelor și semnelor caracteristice, pentru a confirma diagnosticul sunt utilizate studii de laborator de diagnostic, inclusiv teste hormonale și imagistice. [2] [4] De asemenea, revizuirea istoricului primirii corticosteroizilor este importantă.
În unele centre, testarea începe cu măsurarea cortizolului urinar liber (UFC), cel mai bun test pentru excreția urinară. UFC este crescut> 120 µg/24h (> 331 nmol/24h) la aproape toți pacienții cu sindrom Cushing. Cu toate acestea, mulți pacienți cu creșteri UFC între 100 și 150 µg/24h (276 și 414 nmol/24h) au obezitate, depresie sau ovare polichistice, dar nu sindromul Cushing. Un pacient cu sindrom suspectat de Cushing cu UFC crescut (> 4 ori limita superioară a normalului) are aproape sigur sindromul Cushing. Două-trei colecții normale exclud practic diagnosticul. Nivelurile ușor ridicate necesită, în general, investigații suplimentare. [4]
Dacă testele inițiale de laborator sunt pozitive (niveluri crescute de cortizol), atunci se poate face un test de suprimare a dexametazonei pentru a determina cauza. [2] O cantitate de 1, 1,5 sau 2 mg de dexametazonă a fost administrată la 11-12 PM și cortizolul plasmatic a fost măsurat la 8-9 AM dimineața următoare. La majoritatea pacienților normali, acest medicament suprimă cortizolul plasmatic de dimineață la ≤ 1,8 µg/ml (≤ 50 nmol/L), în timp ce pacienții cu sindrom Cushing au întotdeauna un nivel mai ridicat. Un test mai specific, dar la fel de sensibil, este de a da dexametazonă 0,5 mg la fiecare 6 ore timp de 2 zile (doză mică). În general, un eșec clar de a suprima nivelurile ca răspuns la doze mici de dexametazonă stabilește diagnosticul. [4]
Dacă rezultatele acestor teste sunt nedeterminate, pacientul este internat în spital pentru măsurarea cortizolului seric la miezul nopții, ceea ce este mai probabil să fie concludent. Cortizolul variază în mod normal de la 5 la 25 µg/dL (138 la 690 nmol/L) dimineața devreme (6 la 8 AM) și scade treptat la [4]
Nivelurile serice de ACTH ajută la determinarea faptului dacă sindromul Cushing este dependent de ACTH (tumoră hipofizară) sau independent de ACTH (tumoră suprarenală). [2] Nivelurile nedetectabile, atât bazal, cât și în special ca răspuns la hormonul care eliberează corticotropina (CRH), sugerează o cauză suprarenală primară. Nivelurile ridicate sugerează o cauză hipofizară. Dacă ACTH este detectabil (sindromul Cushing dependent de ACTH), testele provocatoare ajută la diferențierea bolii Cushing de sindromul ACTH ectopic, care este mai rar. Ca răspuns la doze mari de dexametazonă (2 mg pe 6 h timp de 48 de ore), cortizolul seric de la 9 AM scade cu> 50% la majoritatea pacienților cu boala Cushing, dar rareori la cei cu sindrom ACTH ectopic. În schimb, ACTH și cortizolul cresc cu> 50% și, respectiv, 20%, ca răspuns la secvența umană sau ovină CRH (100 µg IV sau 1 µg/kg IV) la majoritatea pacienților cu boală Cushing, dar foarte rar la cei cu ACTH ectopic sindrom. O abordare alternativă la localizare, care este mai precisă, dar mai invazivă, este cateterizarea ambelor vene petrosale (care drenează hipofiza) și măsurarea ACTH din aceste vene la 5 minute după un bolus de CRH 100 µg sau 1 µg/kg. Un raport ACTH central-periferic> 3 exclude practic sindromul ACTH ectopic, în timp ce un raport [4]
Imagistica hipofizară se face dacă nivelurile de ACTH și testele provocatoare sugerează o cauză hipofizară; RMN-ul îmbunătățit cu gadoliniu este cel mai precis, dar unele microadenoame sunt vizibile pe CT. Dacă testarea sugerează o cauză nepituitară, imagistica include CT de înaltă rezoluție a pieptului, pancreasului și suprarenalelor; scintiscanare cu octreotidă radiomarcată; și scanarea PET. [4]
Pot fi necesare radiografii sau scanări DEXA pentru a evalua fracturile sau pentru a exclude osteopenia sau, respectiv, osteoporoza. Aceste teste pot fi efectuate pentru a obține o măsurare de bază a densității osoase sau pot fi obținute ca răspuns la raportul unui individ de simptome musculo-scheletice, cum ar fi dureri osoase sau dureri de spate. [2]
La copiii cu boala Cushing, tumorile hipofizare sunt foarte mici și de obicei nu pot fi detectate cu RMN. Eșantionarea sinusului petrosal este deosebit de utilă în această situație. RMN este preferat CT la femeile gravide pentru a evita expunerea fetală la radiații. [4]
Cauze
Cauzele principale ale sindromului Cushing sunt dozele hiperfiziologice de adrenocorticosteroizi și tumori adrenocorticale. [2] Hiperfuncția cortexului suprarenal poate fi dependentă de ACTH sau independent de ACTH. [4]
Sindromul Cushing dependent de ACTH poate rezulta din hipersecreția de ACTH de către glanda pituitară, secreția de ACTH de către o tumoare nepituitară, cum ar fi carcinomul cu celule mici al plămânului sau o tumoare carcinoidă (sindromul ACTH ectopic) sau administrarea de ACTH exogen. [4]
Sindromul Cushing independent de ACTH rezultă de obicei din administrarea terapeutică a corticosteroizilor sau din adenoamele suprarenale sau carcinoamele. Cauzele rare includ displazie suprarenală nodulară pigmentată primară (de obicei la adolescenți) și displazie macronodulară (la pacienții vârstnici). [4]
Sindromul pseudo-Cushing apare atunci când afecțiuni precum depresia, alcoolismul, terapia cu estrogeni sau tulburările alimentare cauzează modificări similare cu cele ale sindromului Cushing. În sindromul pseudo-Cushing, simptomele vor dispărea când se elimină cauza. [2]
Implicare sistemică
Sindromul Cushing implică axa HPA provocând eliberarea excesivă de cortizol din glandele suprarenale. Cortizolul are un rol cheie în metabolismul glucozei și o parte mai mică în metabolismul proteinelor, glucidelor și grăsimilor. Cortizolul ajută, de asemenea, la menținerea tensiunii arteriale și a funcției cardiovasculare, reducând în același timp răspunsurile inflamatorii ale corpului. Supraproducția de cortizol determină eliberarea aminoacizilor din țesutul muscular, rezultând slăbirea structurilor proteice (în special țesutul muscular și elastic). Rezultatul final poate include un abdomen protuberant cu striuri purpurii, vindecare slabă a rănilor, subțierea pielii, slăbiciune musculară generalizată și osteoporoză marcată, care se agravează prin pierderea excesivă de calciu în urină. [2] [1] În cazurile severe de sindrom Cushing prelungit, slăbiciunea musculară și demineralizarea osului pot duce la fracturi patologice și înfășurarea vertebrelor, cifoză, osteonecroză (în special la nivelul capului femural), dureri osoase și dureri de spate. [2]
Efectul nivelurilor circulante de cortizol asupra mușchilor variază de la ușor la marcat. Pierderea musculară poate fi atât de extinsă încât starea simulează distrofia musculară. Slăbiciunea marcată a mușchiului cvadriceps împiedică adesea persoanele afectate să se ridice fără asistență din scaun. [2] [1]
Este important să ne amintim de fiecare dată când se administrează corticosteroizi, creșterea nivelului seric de cortizol declanșează un semnal de feedback negativ către glanda pituitară anterioară pentru a opri secreția sa de ACTH. [1] Această scădere a stimulării ACTH a cortexului suprarenal are ca rezultat atrofie suprarenală în timpul perioadei de administrare exogenă de corticosteroizi. Dacă aceste medicamente sunt întrerupte brusc, mai degrabă decât reduse treptat, glanda suprarenală atrofiată nu va putea furniza cortizolul necesar pentru nevoile fiziologice. Se poate dezvolta o situație care pune viața în pericol, cunoscută sub numele de insuficiență suprarenală acută, necesitând înlocuirea de urgență a cortizolului. [2]
Management medical (cele mai bune dovezi actuale)
Tratamentul pentru restabilirea echilibrului hormonal și inversarea sindromului sau bolii Cushing poate necesita radiații, terapie medicamentoasă sau intervenții chirurgicale, în funcție de cauza de bază (de exemplu, rezecția tumorilor). Pentru persoanele cu irosire musculară sau cu risc de atrofie musculară, poate fi prescrisă o dietă bogată în proteine. Prognosticul depinde de cauza principală și de capacitatea de a controla excesul de cortizol. Tumorile secretoare de cortizol pot reapărea, de aceea este recomandată verificarea ulterioară. [2]
Tumorile hipofizare care produc ACTH excesiv sunt îndepărtate chirurgical sau extirpate cu radiații. Dacă nu se demonstrează nicio tumoare pe imagistică, dar este probabil o sursă hipofizară, se poate încerca hipofizectomia totală, în special la pacienții vârstnici. Pacienții mai tineri primesc, de obicei, iradiere de supratensiune a hipofizei, eliberând 45 Gy. Îmbunătățirea apare de obicei în [4]
Adrenalectomia bilaterală este rezervată pacienților cu hiperadrenocorticism hipofizar care nu răspund atât la explorarea hipofizară (cu posibilă adenomectomie), cât și la iradiere. Adrenalectomia necesită înlocuirea corticosteroizilor pe tot parcursul vieții. [4]
Tumorile suprarenale sunt îndepărtate chirurgical. Pacienții trebuie să primească cortizol în timpul perioadelor chirurgicale și postoperatorii, deoarece cortexul suprarenal netumoros va fi atrofic și suprimat. Adenoamele benigne pot fi îndepărtate laparoscopic. În cazul hiperplaziei suprarenale multinodulare, poate fi necesară suprarenalectomia bilaterală. Chiar și după o presupusă suprarenalectomie totală, recreșterea funcțională apare la câțiva pacienți. [4]
Managementul terapiei fizice (cele mai bune dovezi actuale)
Terapeuții au mai multe șanse să trateze persoanele care au dezvoltat sindromul Cushing indus de medicamente. Această afecțiune apare după ce acești indivizi au primit o doză mare de cortizol (cunoscut și sub denumirea de hidrocortizon) sau derivați ai cortizolului. Steroizii exogeni sunt administrați pentru o serie de afecțiuni inflamatorii și de altă natură, cum ar fi astmul sau artrita reumatoidă. [1]
- Deoarece cortizolul suprimă răspunsul inflamator al corpului, acesta poate masca semnele timpurii ale infecției. Orice febră inexplicabilă fără alte simptome ar trebui să fie un avertisment pentru terapeutul fizic cu privire la necesitatea urmăririi medicale. [1]
- Consultați medicul înainte de a începe orice program de exerciții. [6]
Faceți exerciții regulate pentru a ajuta la menținerea mușchilor și a masei osoase și pentru a preveni creșterea în greutate. Pentru menținerea masei musculare și osoase, sunt utile exercițiile de susținere a greutății, cum ar fi flotări, așezări sau ridicarea greutăților. Pentru a preveni creșterea în greutate, exercițiile aerobe sunt bune pentru a vă crește ritmul cardiac. Exemple de exerciții aerobice includ mersul pe jos, joggingul, ciclismul și înotul. [6]
Educație privind evitarea căderilor și îndepărtarea covoarelor libere și a altor pericole din casă. Căderea poate duce la fracturarea oaselor și alte leziuni. [6]
Acordați o atenție deosebită tuturor rănilor. Prea mult cortizol încetinește vindecarea rănilor. Educația privind vindecarea și curățarea corespunzătoare a rănilor este importantă. Curățați imediat toate rănile cu săpun antibacterian și folosiți unguent și pansamente antibiotice pentru a preveni infecția. [6]
Diagnostic diferentiat
Diagnosticele diferențiale pentru sindromul Cushing sunt obezitatea, diabetul, sindromul ovarian polichistic, alte probleme metabolice și endocrine. [1]
Diferențierea sindromului Cushing de pseudo-sindromul Cushing poate fi uneori o provocare. O stare pseudo-Cushing este definită ca având unele dintre caracteristicile clinice și dovezile biochimice ale sindromului Cushing. Cu toate acestea, rezolvarea stării primare duce la dispariția trăsăturilor cushingoide și a anomaliilor biochimice. [7]
La pacienții care abuzează cronic de alcool, se întâlnesc adesea constatări clinice și biochimice sugestive ale sindromului Cushing. Întreruperea alcoolului determină dispariția acestor anomalii și, prin urmare, acest sindrom este adesea denumit în mod specific sindromul pseudo-Cushing indus de alcool. [7]
Pacienții cu depresie au adesea perturbarea axei HPA, cu hipersecreție anormală de cortizol. Acești pacienți rareori dezvoltă sindromul Cushing clinic. Deoarece excesul de glucocorticoizi poate duce la răspundere emoțională și depresie, distincția între depresie și sindromul Cushing ușor este adesea o provocare de diagnostic. [7]
Rapoarte de caz
Faceți clic pe linkurile de mai jos pentru a vizualiza studiile de caz ale pacientului cu sindrom Cushing:
- Cushing cu sindromul Cigna
- Cushing; Sindromul dvs. Tu și hormonii tăi de la Society for Endocrinology
- Boala Cushing Sindromul Cushing - Centrul clinic al tumorilor neuroendocrine și hipofizare MGH -
- Ectopic Cushing cu sindromul de sănătate UCLA
- Articolul complet Modificări reproductive și biochimice în sindromul ovarului polichistic obez și non obez