J. H. Stupin
1 Fundația Clara Angela, Witten, Berlin
2 Clinica de obstetrică, Charité-Universitätsmedizin Berlin, Berlin
B. Arabă
1 Fundația Clara Angela, Witten, Berlin
2 Clinica de obstetrică, Charité-Universitätsmedizin Berlin, Berlin
3 Centrul pentru mamă și copil, Phillips-Universität Marburg, Marburg
Date asociate
Abstract
Abstract
Asambla
Introducere
Prevalența supraponderalității și a obezității a crescut dramatic în ultimii 20 de ani, inclusiv femeile în vârstă fertilă. Potrivit studiului național privind consumul german, în 2005 și 2006, 29% dintre femeile germane în vârstă de 20 până la 29 de ani erau supraponderale și 8,7% erau obeze. La femeile cu vârsta cuprinsă între 30 și 39 de ani, chiar 35,3% erau supraponderali și, în plus, 14,3% erau obezi 1. Există încă o tendință de creștere care reprezintă o provocare pentru generațiile viitoare.
Excesul de greutate și obezitatea au un impact asupra unei varietăți de modificări fiziologice și procese biologice moleculare în timpul sarcinii. În partea 1 a celor două publicații, ne concentrăm asupra mecanismelor fiziopatologice și moleculare ale unui IMC ridicat și efectele sale asupra metabolismului matern și efectele epigenetice asupra fătului. Trebuie să fim conștienți de riscurile asociate pe termen scurt și lung.
În partea 2, evaluăm studii bazate pe dovezi și orientări internaționale pentru a documenta etapele de diagnostic, prevenire și reducere a riscurilor. Clasificarea OMS pentru supraponderalitate și obezitate este explicată în partea 2, tab. 2. Datele experimentale și epidemiologice se pot completa reciproc și pot reflecta realitatea.
Excesul de greutate și obezitatea în timpul sarcinii
Sarcina, excesul de greutate și obezitatea cauzează rezistență crescută la insulină, un hiperinsulinism inițial și o secreție redusă de insulină de către celulele beta pancreatice, ducând la diabet de tip 2 (T2D) 2, 3. În timpul sarcinii, modificările ușoare pot fi fiziologice. la femeile însărcinate obeze există un risc ridicat ca modificările fiziologice să se transforme într-o stare patologică a diabetului gestațional (GDM) 5. În studiile observaționale, s-a găsit o corelație strânsă între supraponderalitate (IMC 25-29,9 kg/m 2) sau obezitate (IMC ≥ 30 kg/m 2) și riscul de GDM 6, 7. GDM este prezent la numai 2,3% dintre femeile gravide cu un IMC între 18,5 și 24,9 kg/m 2, dar la 9,5% dintre pacienții obezi 8. O meta-analiză a constatat un risc crescut de 3,76 ori pentru GDM la obeză comparativ cu femeile însărcinate non-obeze, cu o creștere de 0,82% a prevalenței per IMC-câștig de 1 kg/m 2 9.
Rezistența la insulină în obezitate a fost legată de procesele (pro) inflamatorii și inflamația subclinică 10, 11. Acestea sunt asociate cu disfuncție vasculară, explicând riscul crescut de preeclampsie la femeile însărcinate obeze 12, 13, 14.
Mecanisme biologice moleculare
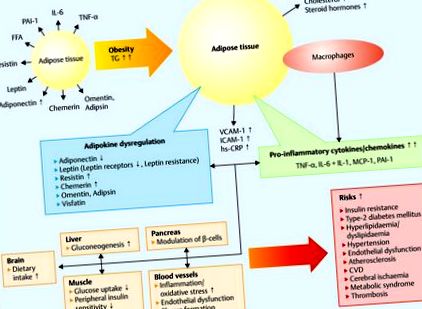
Baza moleculară a modificărilor endocrine se explică prin faptul că țesutul adipos stochează trigliceridele și reprezintă un țesut foarte activ din punct de vedere metabolic 15, 16, 17, 18, 19, 20. O creștere a țesutului adipos este asociată cu o reacție inflamatorie care induce rezistența la insulină. și tulburări cardiovasculare 18 (Fig. 1).
Adipokine, obezitate și factori de risc. Acizii grași sunt depozitați ca trigliceride (TG) de către adipocite. Hipertrofia adipocitelor duce la obezitate. Acest lucru crește secreția de proteine chemotactice monocite 1 (MCP-1) și o acumulare de macrofage care duce la un statut pro-inflamator cu o creștere a adipokinelor secretate de macrofage (TNF-α, IL-6 și -1). Consecința este inflamația cronică cu niveluri ectopice ridicate de lipide musculare, întreruperile β-oxidării mitocondriale și transportul glucozei stimulat de insulină. Adipokinele cresc producția de molecule de adeziune endotelială, cum ar fi molecula de adeziune intercelulară-1 (ICAM-1), molecula de adeziune vasculară-1 (VCAM-1) și de proteină C-reactivă (hs CRP), contribuind la disfuncția endotelială și ateroscleroză (modificată în în conformitate cu 18).
Țesutul adipos este format din adipocite (celule adipoase) și celule stromatice ale țesutului conjunctiv, care includ celule endoteliale, fibroblaste și celule hematopoietice. Țesutul adipos imatur se dezvoltă la făt între 14 și 16 săptămâni gestaționale. Pre-adipocitele se diferențiază treptat de grupurile de celule mezenchimale, dezvoltându-se în lobuli de grăsime cu vacuole lipidice caracteristice în citoplasmă. Acești lobuli grași sunt înconjurați de septuri dense de țesut mezenchimal perilobular 21, 22.
Țesutul adipos fetal începe să fie vizibil în cap și gât, iar mai târziu ca parte a corpului fetal și a extremităților superioare și inferioare 23. În jurul a 28 de săptămâni gestaționale, se finalizează formarea țesutului adipos, inclusiv numărul de lobuli grăsimi. Ulterior, lobulii adiposi cresc în dimensiune (hipertrofie). Cu toate acestea, dacă obezitatea în timpul copilăriei se dezvoltă, chiar și numărul de celule adipoase (hiperplazie) poate crește 24. Numai în cazul obezității extreme în timpul maturității, numărul de celule adipoase poate crește în continuare 25.
Se pot diferenția două tipuri de țesut adipos: țesutul adipos alb și maro, care au funcții specifice în depozitarea grăsimilor, activitate metabolică și respectiv termogeneză 26. La om se formează țesutul adipos visceral (TVA) și subcutanat (SAT). TVA joacă un rol cheie în dezvoltarea unui sindrom metabolic 16, 17, 21, 27.
TNF alfa, IL-6, IL-10, leptina și adiponectina fac parte din mai mult de 50 de „adipokine” diferite, peptide care sunt produse din țesutul adipos alb. Acestea circulă în sângele matern și joacă un rol important în morbiditatea specifică obezității 16, 17, 28, 31, 39 (Tabelul 1).
tabelul 1 Efecte fiziologice și fiziopatologice ale adipokinelor selectate 16, 18, 39).
| TNF-alfa | Inflamație, apoptoză, impact asupra rezistenței la insulină, stimularea disfuncției endoteliale și aterogeneză |
| IL-6 | Inflamație, reglarea imunitară (modularea receptorului de insulină), rezistența la insulină, aterogeneză |
| Adiponectina | Stimularea secreției de insulină, creșterea sensibilității la insulină, stimularea absorbției de glucoză în mușchi, reducerea inflamației, reducerea lipidelor plasmatice, efect ateroprotector |
| Leptina | Saturație, creșterea utilizării energiei, controlul greutății, modularea sensibilității la insulină, reducerea secreției de insulină, angiogeneză |
Placenta produce adipokine asemănătoare țesutului adipos alb, lipsită doar de adiponectină, un marker pentru sensibilitatea crescută la insulină 40, 41. Challier și colab. 42 au demonstrat că numărul de macrofage CD14 + și CD68 + în placenta femeilor obeze a fost de trei ori crescut comparativ cu femeile cu greutate normală. Aceste macrofage produc citokine pro-inflamatorii ca TNF-alfa și IL-6. Modificările inflamatorii locale la femeile însărcinate obeze se reflectă și în concentrațiile plasmatice crescute de peptidă C-reactivă (CrP) și IL-6. Interesant, macrofagele CD14 + au fost de origine maternă, dar nu fetală 43.
Până în prezent, puține studii au investigat efectul supraponderalității și obezității asupra inflamației în timpul sarcinii. Ramsay și colab. 13 au găsit concentrații serice mai mari de leptină, CrP și IL-6 la obezi comparativ cu femeile cu greutate normală. Aceste citokine proinflamatorii circulante au fost, de asemenea, corelate cu niveluri mai ridicate de TNF-alfa și IL-6-mRNA produse de celulele mononucleare periferice materne 42. Cu toate acestea, invazia macrofagelor în TVA a fost demonstrată până acum doar în adulți obezi însărcinați 44, 45. La babuinii obezi, Farley și colab. au demonstrat o infiltrare marcată de macrofage în țesutul adipos 46. Odată cu creșterea gradului de obezitate, macrofagele produc din ce în ce mai mulți factori de transcripție, adipokine și molecule inflamatorii 47, ceea ce are ca rezultat și rezistența la insulină 44.
Obezitatea viscerală asociată cu intoleranța la glucoză și rezistența la insulină 13, 48, poate duce la GDM la femeile obeze 20. Din păcate, există o lipsă de cercetări legate de căile biochimice ale GDM la femeile gravide. Potrivit lui Kirwan și colab. 49 de niveluri de TNF-alfa la femeile însărcinate cu greutate normală pot prezice rezistența la insulină în etapele ulterioare ale sarcinii. Tulburările în cascada de semnalizare a insulinei la femeile însărcinate obeze cu toleranță normală la glucoză ar putea fi demonstrate atât în țesutul adipos, cât și în mușchiul scheletal 50. Efectele negative ale supraponderabilității și obezității devin mai evidente în ceea ce privește intoleranța la glucoză și rezistența la insulină 21, 51, 52. Procesele inflamatorii sunt strâns legate de prevalența hipertensiunii sau pre-eclampsiei induse de sarcină la femeile însărcinate obeze 53.
Obezitatea maternă asociată cu GDM și hipertensiune este astfel legată de o reacție inflamatorie în țesutul adipos alb, în plasmă și placentă. Se presupune că această „stare pro-inflamatorie” este principalul mecanism care stă la baza rezistenței la insulină și a hipertensiunii arteriale la femeile însărcinate obeze 20.
Programarea perinatală a supraponderalității și obezității
„Programarea perinatală” a fost între timp stabilită ca un domeniu de cercetare pentru tratarea impactului mediului intrauterin și postnatal precoce asupra mecanismelor fundamentale de sănătate și boli 54, 55, 56, 57, 58, 59 (Fig. 2). Accentul principal este fenomenul unei transmisiuni epigenetice, materno-fetale a condițiilor dobândite.
Mecanisme patogenetice și consecințele malprogramării perinatale. Etiologia supraalimentării pre și neonatale și a hiperinsulinismului pentru creșterea excesivă în greutate, supraponderalitatea/obezitatea, diabetul zaharat de tip 2 și bolile cardiovasculare ulterioare în viața ulterioară (modificat în conformitate cu 58).
Rezultatele studiilor experimentale epidemiologice, clinice și animale indică impactul nutriției în timpul dezvoltării prenatale și postnatale precoce și impactul acesteia asupra apariției supraponderabilității, obezității, T2D și a bolilor cardiovasculare în viața ulterioară 60, 61. Starea metabolică în timpul sarcina și tipul de nutriție în perioada neonatală (de exemplu, alăptarea și efectul său pe termen lung) pot avea ambele sechele negative sau pozitive pentru copilul în creștere până la vârsta adultă 62, 63, 64, 65.
Günter Dörner de la Charité a postulat în anii 1970 că T2D a fost „transmis” mai frecvent din linia maternă decât din linia paternă 66. El a dezvoltat conceptul de „programare perinatală” și a stabilit o „teratologie funcțională” 67. În anii 1990 grupurile al lui Hales și Barker a descris conceptul de „origine prenatală a bolii adulte” la fetuții cu ritard de creștere și la nou-născuți 68.
În afară de factorii genetici, dieta maternă și starea nutrițională în timpul sarcinii au un impact critic asupra creșterii intrauterine și a greutății la naștere. În țările dezvoltate, greutatea generală la naștere a crescut cu 126 g în ultimii 20-30 de ani. În consecință, rata macrosomiei a crescut cu 25% pe deceniu 69, 70, 71, 72, prin care se presupune că cauzele epigenetice sunt mecanismul de bază.
Riscul de macrosomie (greutate la naștere> 4000 g) este mai mult decât dublat sau chiar triplat la copiii obezi sau morbi obezi 73 și în principal combinat cu creșterea excesivă în greutate 69, 76. În partea 2, explicăm consecințele clinice și complicațiile 74 Indiferent de greutatea preconcepțională, creșterea în greutate a mamei în timpul sarcinii se corelează pozitiv cu greutatea la naștere 69, 75.
Studiile epidemiologice au arătat o corelație pozitivă între greutatea la naștere și greutatea corporală la vârsta adultă, ceea ce înseamnă că macrosomia fetală legată de obezitatea maternă este asociată cu obezitatea în viața ulterioară 77, 78. O meta-analiză a unui total de 643 902 de persoane cu vârsta cuprinsă între 1 și 75 de ani vârsta din 26 de țări a relevat o conexiune liniară pozitivă între greutatea la naștere și supraponderalitatea ulterioară în 59/66 (89,4%) din studii. În patru dintre studii (6,1%), nu a fost observată nicio corelație. În trei studii (4,5%) a fost descrisă o relație în formă de U, adică o creștere similară a riscului în greutatea mică și mare la naștere. Cu toate acestea, nu a fost descrisă nicio relație inversă liniară. Pe baza estimărilor ajustate, s-a arătat că riscul de supraponderalitate la o viață ulterioară la copiii cu greutate mare la naștere a fost aproape dublu (OR 1,96, 95% CI 1,43-2,67) comparativ cu copiii cu greutate normală la naștere (2500-4000 g) 78.
O meta-analiză a corelației dintre greutatea la naștere și riscul ulterior de T2D a relevat, în consecință, o relație în formă de U în toate studiile publicate, explicând că copiii cu naștere mică și greutate mare la naștere prezintă un risc crescut de T2D în viața ulterioară 79.
Se pare că este un cerc vicios că obezitatea în timpul sarcinii provoacă GDM matern și o creștere a greutății la naștere și obezitate la descendenți care apoi dezvoltă tulburări metabolice diabetice asociate, de exemplu, GDM la femei 80, 81, 82, 83, 84.
În mod similar, studiile efectuate pe animale au arătat că nu numai supraponderalitatea maternă și obezitatea, ci și nutriția în timpul sarcinii au un impact asupra descendenților: Macacii japonezi gravide care au primit fie o dietă bogată în grăsimi (35% grăsime), fie o dietă normală (13% grăsime) ) în timpul sarcinii au prezentat diferențe în microbiomul juvenil al tractului gastro-intestinal în primul an de viață 85. Campylobacter nu a fost detectabil în microbiomul juvenil după dieta bogată în grăsimi. Aceste modificări au fost foarte stabile și nici nu au putut fi corectate postnatal printr-o dietă normală.
Programarea perinatală poate implica, de asemenea, centrele de reglare nervoase centrale ale metabolismului și controlul greutății corporale. Astfel, supraponderalitatea maternă și/sau diabetul matern (hiperglicemie) în timpul sarcinii și supranutriția precoce postnatală duc la creșterea nivelului de insulină, glucoză, proteine și/sau leptină în timpul etapelor critice de dezvoltare (de exemplu, hiperinsulinism fetal). Malprogramarea prin mecanisme epigenetice are ca rezultat o dispariție pe tot parcursul vieții pentru supraponderalitatea, obezitatea și tulburările metabolice diabetice în generațiile 54, 58, 63, 89, 90.
Mecanismele epigenetice sunt metilarea ADN-ului, modificarea histonelor și reglarea microARN-urilor. Metilarea bazelor de citidină în dimerii nucleotidici de citozină-guanozină (CpG) (metilarea ADN) a fost investigată 91. ADN foarte metilat (în special așa-numitele regiuni promotor) reduce expresia genei 91. Doar câteva studii au investigat contribuția mecanisme epigenetice ale programării metabolice fetale la nivel molecular 92, 93, 94, 95, 96. În placentele femeilor cu diabet gestațional, s-au găsit modificări ale metilării genelor leptinei și adiponectinei (LEP și ADIPOQ). LEP și ADIPOQ sunt clasificate ca gene candidate pentru obezitate și GDM 93, 96. În plus, s-a arătat că metilarea totală în placentele femeilor obeze este semnificativ mai mare decât la femeile cu greutate normală 97. Aceste modificări au efecte durabile asupra reglementării metabolismul descendenților dacă reflectă metilarea ADN-ului în alte țesuturi, declanșând astfel dezvoltarea tulburărilor metabolice cronice.
La obezitatea maternă fără intoleranță la glucoză, expresia microARN rămâne neschimbată. Într-un studiu pe 16 femei obeze și 20 de femei însărcinate cu greutate normală, cu o toleranță normală la glucoză, expresia microRNA din sângele cordonului ombilical nu a diferit semnificativ 98. Autorii au concluzionat că în programarea fetală alte mecanisme sunt mai relevante.
Prevenirea viitoare ar trebui să înceapă înainte de concepție pentru a evita obezitatea maternă, GDM și modificările epigenetice. La șobolanii însărcinați s-a demonstrat că un program de exerciții fizice în timpul sarcinii ar putea avea efecte pozitive asupra fenotipului metabolic al descendenților 99. Procentul de masă corporală fără grăsimi la descendenții masculi a crescut și masa de grăsime a scăzut. Intervențiile și studiile longitudinale ar putea ajuta la detectarea dacă putem modifica, de asemenea, epigenetica și programarea perinatală a GDM, supraponderalității sau obezității.
Concluzii
Excesul de greutate și obezitatea duc la o creștere a morbidității și mortalității materne și perinatale. Mecanismele biologice moleculare, cum ar fi diabetul gestațional sau sindromul metabolic, nu au fost încă suficient investigate. Procesele inflamatorii locale și sistemice, declanșate de țesutul adipos, par să joace un rol cheie. În ciuda prevalenței tot mai mari a supraponderalității și a obezității la femeile însărcinate din țările occidentale, inclusiv Germania, cercetările clinice privind mecanismele și intervențiile sunt rare, deși diagnosticul este ușor. Sunt necesare investigații suplimentare despre biologia țesutului adipos și asocierea acestuia cu rezistența la insulină, formarea adipokinelor și disfuncția endotelială.
Trebuie implementate programe de prevenire primară. Evitarea supraponderalității și a obezității în copilărie și adolescență și creșterea corespunzătoare în greutate în timpul sarcinii 100 sunt esențiale. Programele educaționale anterioare concepției sunt importante. Trebuie luată în considerare și promovarea alăptării pentru nou-născuți.
Note de subsol
Conflict de interese Nici unul.
- Recunoașterea și gestionarea supraponderalității și a obezității în asistența medicală primară în Germania - PubMed
- PPT - Prezentare PowerPoint supraponderală, obezitate și subponderală pentru gestionarea greutății - ID 3359245
- Echivalent metabolic (MET) la supraponderalitate și obezitate
- Excesul de greutate și obezitatea la pacienții cu fibroză chistică O analiză bazată pe centru - Hanna - 2015 -
- Supraponderabilitatea, obezitatea și pierderea în greutate afectează funcția creierului - Herbalife Nutrition Institute -