Teri L. Hernandez
1 Departamentul de Medicină, Divizia de Endocrinologie, Metabolism și Diabet; Universitatea din Colorado, Anschutz Medical Campus, Aurora, CO
2 Colegiul de asistență medicală; Universitatea din Colorado, Anschutz Medical Campus, Aurora, CO
Archana Mande
3 Colorado Clinical and Translational Science Institute, Universitatea din Colorado, Anschutz Medical Campus, Aurora, CO
Linda A. Barbour
1 Departamentul de Medicină, Divizia de Endocrinologie, Metabolism și Diabet; Universitatea din Colorado, Anschutz Medical Campus, Aurora, CO
4 Departamentul de Obstetrică și Ginecologie, Divizia de Medicină Materno-Fetală, Universitatea din Colorado Școala de Medicină, Aurora, CO
rezumat
Introducere
Prevalența ridicată a obezității la femeile tinere a schimbat peisajul sarcinii într-unul caracterizat în mod obișnuit prin supra-nutriție. În prima și a doua decadă a duratei de viață a femeilor, factorii și comportamentele metabolice cheie contribuie la rezistența la insulină (IR) și la intoleranța la glucoză, manifestându-se adesea în timpul sarcinii. Acest risc începe cu o greutate ridicată la naștere sau cu adipozitate în exces, urmată de o creștere postnatală accelerată potențial promovată de hrana cu formulă, ceea ce duce la revenirea precoce a adipozității, la supraponderalitatea copilului sau la sindromul metabolic. Acest fenotip este ulterior agravat de ani de calitate slabă a dietei, supra-nutriție, stil de viață sedentar și somn slab [1], ceea ce duce la agravarea IR a pubertății care nu se normalizează [2] după adolescență. La vârsta adultă tânără, aceste influențe culminează cu un fenotip de graviditate caracterizat prin obezitate și IR preexistent, unde hiperglicemia ușoară și hiperlipidemia sunt deja prezente, doar pentru a se manifesta și a fi amplificate cu adaptări metabolice ale sarcinii suprapuse [3].
Liderii seminali în domeniul diabetului în timpul sarcinii au recunoscut că excesul de creștere a fătului este o preocupare principală la sarcinile afectate de diabet [4], iar Freinkel [5] a susținut că lecțiile din diabetul în timpul sarcinii se aplică tuturor sarcinilor. Douăzeci și cinci [6] până la aproape 40% [7] dintre femeile tinere sunt obeze în întreaga lume și, deși femeile cu obezitate singură reprezintă cel mai mare număr de sarcini complicate de creșterea excesivă a fătului [8], terapia de nutriție este instituită doar o dată cu diabetul zaharat gestațional (GDM) a fost diagnosticat. Cu toate acestea, pe măsură ce mai multe femei sunt diagnosticate cu GDM însoțite de grade mai ușoare de hiperglicemie [9], acum estimată la
20% din sarcini [10], mai multe femei supraponderale și obeze se vor califica pentru diagnostic. Terapia nutrițională este singura componentă de management aplicabilă fiecărei femei cu diagnostic GDM, indiferent de severitatea fenotipică. Deși abordarea optimă a terapiei nutriționale rămâne evazivă și poate necesita o strategie personalizată, este esențial să se identifice componentele terapeutice eficiente care să minimizeze necesitatea terapiei medicale la această populație în creștere de mame. Mai mult, opțiunile economice, adaptabile și eficiente pentru GDM ar putea oferi beneficii mamelor care sunt supraponderale sau obeze, care împărtășesc adesea un fenotip metabolic mai ușor și oferă cel mai mare număr de sugari cu vârstă mare pentru gestație (LGA) [8].
Direcționarea metabolismului în timpul sarcinii folosind nutriție
De zeci de ani s-a recunoscut că afecțiunile in-utero sunt formate din nutriția maternă [5]. Organizat de hormoni placentari, metabolismul normal al sarcinii se caracterizează prin sensibilitate redusă la insulină, creștere a glucozei postprandiale [29], creștere de 2-3 ori a producției de insulină [30, 31] și creștere a FFA plasmatic, TG, colesterol total și fosfolipide [31-33 ]. Când creșterea fetală crește în al treilea trimestru, IR crește cu fiecare săptămână de gestație pentru a asigura manevrarea nutrienților la făt [34-36]. Obezitatea înainte de concepție este frecvent asociată cu afectări ale absorbției glucozei stimulate de insulină, suprimarea insulinei gluconeogenezei hepatice și suprimării insulinei lipolizei care se intensifică până în al treilea trimestru [33, 37, 38]. De fapt, aproape 50% din GDM în Statele Unite poate fi explicat prin supraponderalitate/obezitate [39] și este rezultatul unei combinații de IR și rezerva de celule beta insuficiente [31, 40].
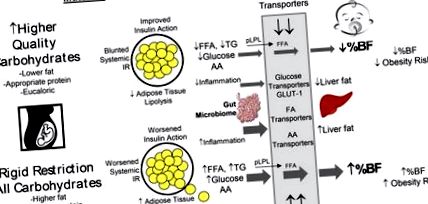
Recent, am demonstrat că femeile cu GDM controlat de dietă randomizate la un carbohidrat cu un complex mai ridicat, o dietă cu conținut scăzut de grăsimi (comparativ cu restricția carbohidraților cu grăsimi mai ridicate) au demonstrat o acțiune mai mare a insulinei după 6-7 săptămâni din dieta oferită. Estimările IR la ambele grupuri au fost puternic corelate cu adipozitatea sugarului [41] (Figura 1). Deși femeile cu GDM prezintă modele mai ridicate de glicemie [42, 43], am arătat că folosim diete fixe eucalorice că femeile obeze sănătoase au, de asemenea, modele mai ridicate de glicemie de 24 de ore decât mamele cu greutate normală (de
Indicele glicemic și carbohidrații de calitate superioară
Indicele GIemic este o proprietate a unui aliment cu carbohidrați care descrie capacitatea sa de a crește glucoza din sânge: un aliment cu conținut scăzut de IG are o capacitate mai mică de a crește glucoza postprandială, în timp ce alimentele cu conținut ridicat de GI cresc în mod acut glicemia [47]. Alimentele cu IG mai mic produc o sațietate mai mare, în timp ce alimentele cu IG mai ridicate sunt asociate cu foamea crescută, nivelurile de insulină și aportul de energie [47]. În ultimul deceniu, alimentele cu conținut scăzut de IG au fost din ce în ce mai recomandate pentru nutriție în timpul sarcinii [48]. Freinkel [5] a demonstrat că glucoza postprandială crește gradientul de glucoză materno-fetală, facilitând transportul glucozei placentare. Deoarece glicemia postprandială este mai mare cu IR crescut și toleranță redusă la glucoză (adică obezitate, GDM, diabet preexistent), alimentele cu IG scăzut au un potențial ridicat de a ajuta la reducerea riscului de LGA/macrosomie [48]. Sarcina glicemică (GL) descrie cererea de insulină creată de un aliment cu carbohidrați [49]. Atunci când se ia în considerare o abordare mai puțin restrictivă pentru aportul de carbohidrați în GDM, consensul internațional susține că carbohidrații complecși ar trebui să fie de calitate superioară [47, 50] pentru a reduce cererea de insulină. Un model nutrițional care include carbohidrați de calitate superioară îi liberalizează pe cei care tind să fie densi în nutrienți (mai multe vitamine/minerale), au fibre mai mari și sunt mai scăzute în calorii și GI/GL [47, 50-52].
Anxietatea și frica subminează terapia nutrițională în GDM
Un diagnostic de GDM generează anxietate și teamă. La
Din experiența clinică a autorilor, unele femei sunt atât de temătoare de macrosomie încât consumă diete extreme restricționate în carbohidrați, consumând în schimb grăsimi în loc, motivând că mai puține vor îmbunătăți rezultatele sugarilor. Deși glicemia lor este de obicei controlată, sunt anxioși, nefericiți și consumă doar o gamă îngustă de alimente adecvate și sunt expuși riscului de cetoză. Alții sunt atât de stresați de planul nutrițional încât pur și simplu nu îl respectă și, în concordanță cu experiența recentă din China [58], auto-monitorizarea glucozei este mai puțin decât recomandată, deoarece oferă feedback despre eșecul perceput al acestora. O abordare mai puțin restrictivă a terapiei nutriționale în GDM ar putea crește încrederea în sine, conformitatea și ar putea evita aportul compensatoriu mai mare de grăsimi.
Consecințe neintenționate: restricționarea carbohidraților în GDM
Lipidele și FFA sunt substraturi puternice de creștere a fătului, recunoscute acum ca având efecte negative de programare intrauterină asociate cu excesul de creștere a fătului și cu o sănătate mai slabă a descendenților pe termen lung [65]. Restricția intensificată a carbohidraților la aportul minim prezintă un risc de cetoză maternă [66] din cauza lipolizei crescute și generării de FFA (Figura 1). Cu restricție severă de carbohidrați, aportul obligatoriu de glucoză fetoplacentală, care depinde de o glucoză maternă mai mare, ar putea provoca transferul de glucoză placental-fetal [67]. Femeilor însărcinate li se recomandă să consume în medie 175g de carbohidrați/zi, care include 33g necesare pentru a sprijini dezvoltarea creierului fetal [68]. Cu toate acestea, dovezi mai noi sugerează recomandarea
175g/zi nu iau în considerare necesarul de glucoză placentară, care probabil depășește 135g singur în al treilea trimestru la o mamă din NV și ar fi crescut cu IMC mai mare [67]. Extremele din aportul de proteine ar trebui, de asemenea, să fie luate în considerare cu atenție, deoarece atât aportul restricționat, cât și aportul excesiv de proteine au fost asociate cu o greutate redusă la naștere [69, 70]. Efectele diferențiale ale carbohidraților dietetici asupra glucozei postprandiale [71] susțin că, deși carbohidrații simpli cresc intens glucoza din sânge [47], carbohidrații complecși cu nutrienți (polizaharide și amidon în principal din cereale, legume și leguminoase) [50] duc la o atenuare a excursia postprandială de glucoză [29]. Cu un carbohidrat dietetic optim și un aport mai scăzut de grăsimi, terapia nutrițională ar putea susține în siguranță un plan mai puțin restrictiv care să îndeplinească obiectivele glicemice, obiectivele de stabilizare a greutății [72], să susțină creșterea fetală adecvată și, mai important, să evite nevoia de medicamente și supravegherea fetală costisitoare.
Dovezi care susțin aportul mai puțin restrictiv de carbohidrați pentru GDM
Efecte asupra metabolismului glucozei materne
65% carbohidrați, în principal complexi) vs. A
Dieta cu 55% carbohidrați Deși femeile cu GDM au demonstrat o scădere a glucozei la jeun [77] și un răspuns îmbunătățit la un test oral de toleranță la glucoză [78], rezultatele sunt surprinzătoare, dat fiind că intervenția a fost de doar 4 săptămâni, imediat după diagnosticul GDM, și nu a fost menținută pentru ultimele 8-10 săptămâni de sarcină.
În studiul nostru, am examinat răspunsul la glucoză și FFA după 6-7 săptămâni de dietă și până la naștere (toate mesele au fost oferite mamelor). În mod surprinzător, femeile randomizate la dieta complexă cu carbohidrați (60% din totalul caloriilor, similar în carbohidrați, zaharuri și fibre cu DASH) au avut de fapt o scădere a glucozei de post, în timp ce cele randomizate la dieta cu carbohidrați mai mici (40% din totalul caloriilor) au demonstrat creșterea glucozei de post. În aceste studii, proteinele au variat între 15 și 20%, iar grăsimile totale au fost mai mici (10-25%), cu grăsimi saturate mai mici în brațul cu carbohidrați mai mare. Conținutul total mai scăzut de grăsimi s-ar fi putut adăuga la efecte benefice asupra metabolismului glucozei, datorită diminuării agravării IR cauzate de FFA [79]. În general, aceste studii subliniază faptul că femeile cu GDM au obținut un control glicemic bun cu o abordare mai puțin restrictivă a carbohidraților în terapia nutrițională.
Efecte asupra lipidelor, rezistenței la insulină, inflamație
Efect asupra creșterii în greutate gestațională (GWG)
S-a sugerat că o dietă de 50-60% carbohidrați duce la GWG excesiv și hiperglicemie postprandială [80], care alimentează concentrarea asupra restricției rigide a carbohidraților în GDM. Creșterea în greutate ar putea fi de așteptat în cazul excesului caloric și al consumului ridicat de carbohidrați simpli care cresc acut glicemia, unde insulinemia mai mare ar favoriza stocarea lipidelor [81]. În Spania [82], femeile randomizate la un conținut scăzut de carbohidrați (40% carbohidrați/40% grăsimi) au câștigat 1,4 kg față de 2,3 kg în lotul martor (55% carbohidrați/25% grăsimi). Cu toate acestea, doar GWG total a fost raportat și greutatea câștigată în timpul intervenției nu este clară. În Australia [83], 42% dintre cei dintr-un grup cu IG mai mare au avut GWG excesiv [84], comparativ cu 25% dintre femeile randomizate cu IG scăzut. Din nou, doar GWG total a fost raportat și greutatea a crescut înainte de intervenție este necunoscută. Proporția mai mare de terapie cu insulină în ambele grupuri ar putea confunda în continuare observația GWG, deoarece administrarea insulinei este în mod clar asociată cu creșterea în greutate. Chiar mai mult este un factor de confuzie dacă mamele consumă mai mulți carbohidrați pentru a evita hipoglicemia de la administrarea prea mare de insulină. Trei studii au raportat greutatea crescută în timpul intervenției dietetice [41, 77, 78, 85], care a fost
1-2 kg pe o dietă eucalorică cu conținut ridicat sau mai scăzut de carbohidrați, susținând că un consum mai puțin restrictiv de carbohidrați complexi, cu IG mai scăzut, nu favorizează excesul de GWG.
Nevoia de terapie cu insulină
Din punct de vedere istoric, studiile non-randomizate efectuate în GDM au demonstrat că controlul glicemic ar putea fi realizat folosind dieta + insulină [4], iar consumul de 2 admiși într-o secție metabolică a fost randomizat la 4 zile de la înlocuirea orezului în mesele cu un IG scăzut. alimente de bază (orez brun) vs. control (orez alb) (conținut total de carbohidrați/energie menținut constant). Femeile randomizate la capsul cu IG scăzut au scăzut glucoza de repaus alimentar (-3,7% față de -1,2%, respectiv) și o reducere mai mare a glucozei postprandiale (-19 până la -22% față de -7 până la -12%, respectiv). În general, studiile sugerează un beneficiu al dietelor cu conținut scăzut de GI în GDM privind glucoza post/prandial și greutatea la naștere la sugari, în special atunci când aportul de fibre este crescut.
Conformitate necunoscută sau slabă în terapia nutrițională pentru GDM
Respectarea terapiei nutriționale în GDM rămâne unul dintre cei mai mari factori confuzi din toate studiile [16]. Pentru a spori conformitatea, anchetatorii au implementat strategii în care toate produsele alimentare sunt oferite participanților [41, 45, 75, 95], este furnizat un coș cu produse alimentare [83] și urmărire telefonică, întâlniri cu un dietetician înregistrat și meniuri pentru au fost folosiți participanții de urmat. Conformitatea a fost măsurată cu instrumente de notare folosind un chestionar și aportul auto-raportat (înregistrări alimentare). În ciuda acestor strategii, conformitatea continuă să submineze rezultatele studiilor [15]. În ECA în care fibrele au fost manipulate, nu a existat nicio diferență în controlul glicemic, dar respectarea marginală, în ciuda faptului că a fost raportată ca fiind „bună” atunci când doar 60% s-a auto-raportat conformitatea și „acceptabilă” când doar 40% au raportat conformitatea și a existat o uzură semnificativă ]. În Polonia [94] s-a comparat un conținut total de carbohidrați între 60% și 45% și, deși a fost raportat un control glicemic îmbunătățit în cadrul grupurilor, conformitatea auto-raportată a fost
50%. În ciuda faptului că a furnizat probe de coșuri de alimente, participanții la ECA australiană a dietelor cu IG scăzut vs mai mare nu au reușit să atingă obiectivele GI [83], rezultând o diferență mică între diete (GI: 53 vs. 47), explicând probabil studiul negativ rezultat. În Spania [82], unde mai mare vs. dietele cu conținut scăzut de carbohidrați au fost comparate, aproximativ 2/3 dintre femei au returnat înregistrările dietetice, doar grupul cu conținut scăzut de carbohidrați a raportat că a atins obiectivul de carbohidrați, iar uzarea în grupul de control a fost de 20%. În studiile DASH de 4 săptămâni, sodiul urinar nu a fost inclus ca metrică de conformitate [77, 78, 85]. Chiar și în studiul nostru în care alimentele au fost furnizate timp de 6-7 săptămâni până la livrare [41, 45], nu se poate garanta conformitatea deplină. Aceste ilustrații demonstrează necesitatea critică de a considera conformitatea ca un factor major în interpretarea rezultatelor studiului, mai ales atunci când se raportează de la sine prin chestionare. Încercările care asigură toate mesele, la fel ca în RCT-ul nostru pilot [41, 45] (în curs de desfășurare a unui studiu mai mare), sunt probabil cea mai riguroasă metodă de maximizare a conformității, dar sunt costisitoare și intensivă în muncă.
Adaptabilitatea culturală a unei abordări mai puțin restrictive a terapiei nutriționale în GDM
Pentru ca o abordare a terapiei nutriționale în GDM să fie cu adevărat optimă, aceasta trebuie să fie adaptabilă și economică (Tabelul 1). Unul dintre factorii principali care subminează terapia nutrițională în GDM este inacceptabilitatea sa culturală [54-56]. Legată de o abordare restrictivă, femeile cred că nu pot consuma multe alimente în concordanță cu cultura lor regională. În mod evident, diferite regiuni ale lumii au tipare dietetice variate definite de disponibilitatea alimentelor locale, practicile culturale/tradiționale și factorii socio-economici. În consecință, recomandările dietetice trebuie să varieze pe tot globul pentru a se potrivi tiparelor dietetice locale. În tabelul 1, oferim exemple de alimente care sunt sensibile din punct de vedere cultural, care pot fi încorporate în abordările nutriționale pentru GDM în rândul populațiilor etnice de mare amploare. Tranziția nutrițională globală, care afectează în principal părțile în curs de dezvoltare ale lumii, cum ar fi Asia, America Latină și Africa, provoacă o trecere de la dietele tradiționale la tiparele de alimentație care depind în mare măsură de alimentele procesate, mesele bogate în grăsimi/bogate în calorii și mâncarea departe. de acasă [106]. O creștere consecventă a incidenței bolilor netransmisibile, cum ar fi obezitatea și diabetul, reprezintă provocări majore de sănătate și economice în aceste părți relativ slabe ale lumii.
tabelul 1
Alimente locale/tradiționale din regiuni geografice variate care se califică pentru o abordare dietetică mai puțin restricționată în carbohidrați în GDM.
Pâine din cereale integrale, paste, orez brun sau fierte, ovăz
- Terapie IV la domiciliu pentru nutriție parenterală
- Consiliere nutrițională pentru alimentația intuitivă, sarcina, diabetul și tulburările de alimentație din Charlotte
- Nutriția în viața timpurie poate afecta IQ - Blog de terapie
- Copii rezistenți - nutriție și dincolo
- Aportul nutrițional al femeilor însărcinate cu diabet gestațional sau diabet zaharat tip 2